GSE1在肝细胞性肝癌中的表达及临床意义
2020-08-05刘大潮吴文涌吴正升
刘大潮,吴文涌,吴正升
我国罹患恶性肿瘤的患者中,肝癌的发病率排在第3位,病死率处于第2位[1]。最新公布的数据表明,在所有恶性肿瘤疾病中,新发肝癌患者人数排名第6[2]。肝细胞性肝癌(hepatocellular carcinoma,HCC)作为肝癌中最常见的组织学亚型,人们对HCC的研究也进一步深入,信号通路在HCC的进程中扮演了重要的角色[3-5]。GSE1螺旋蛋白(Gse1 coiled-coil protein,GSE1)是一种富脯氨酸蛋白质,在研究中被发现可以促进乳腺癌细胞的增殖和转移[6],并且和人胃癌临床病理及预后情况密切相关[7]。但是对于GSE1在HCC的表达情况,国内外文献目前尚未发现报道。因此该研究对HCC组织进行GSE1的检测,从蛋白及mRNA水平探讨GSE1在临床样本中的表达情况,并分析其与HCC临床病理特征的关系,为HCC患者的疾病发展机制及潜在的治疗方法提供新的依据。
1 材料与方法
1.1 材料收集安徽医科大学第一附属医院病理科2012年1月~2013年12月HCC的石蜡包埋标本71例,同时选取癌旁的非肿瘤组织41例作为对照组。在上述病例中,女性患者共计12例,男性患者共计59例,患者年龄27~78(54.06±10.63)岁。癌肿直径≤5 cm 33例;>5 cm 38例;脉管浸润16例;无脉管浸润55例。在本实验中,依据国际抗癌联盟(Union for International Cancer Control,UICC)所制定的TNM分期系统[8],对患者临床标本进行病理分期;分级采用Edmondson分级法。依据双盲原则,邀请2名读片经验丰富的病理医师对结果进行评定。
新鲜标本收集于安徽医科大学第一附属医院2019年5月~9月经手术切除的30对HCC及癌旁非肿瘤组织标本(HCC诊断经明确病理证实)。标本离体后0.5 h内置入液氮速冻,续置入-80 ℃冰箱冻存。
1.2 主要试剂和仪器实时荧光定量PCR试剂盒及RNA逆转录试剂盒购自全式金生物公司;兔抗人GSE1抗体购自美国proteintech公司,工作滴度1 ∶200;RIPA蛋白裂解液购自武汉BOSTER生物工程公司;聚偏氟乙烯(polyvinylidene fluoride,PVDF)购自上海罗氏公司;电化学发光液(electrochemiluminescence,ECL)购自上海拜力(Pierce)生物科技有限公司;小鼠/兔聚合物法检测系统(PV-6000)及DAB显色试剂盒(ZLI-9018)购自北京中杉金桥生物技术有限公司。
1.3 实验方法
1.3.1免疫组化方法 免疫组化使用EnVision法。所需临床标本在术中取下后均使用10%福尔马林溶液固定24 h,石蜡包埋机包埋组织,切片机切片厚度为4 μm,石蜡切片烤片后依下列顺序过缸脱蜡:二甲苯(10 min)2遍→无水乙醇(5 min)2遍→95%乙醇(5 min)1遍→90%乙醇(5 min)1遍→80%乙醇(5 min)1遍→70%乙醇(5 min)1遍→蒸馏水(5 min)。随后放置于加有抗原修复液(柠檬酸钠溶液)的容器内高压加热进行抗原修复120 s,取片静置至室温,并滴加3% H2O2作用10 min。滴加一抗后置入4 ℃冰箱中过夜,待孵育完成后滴入二抗50 μl,置入37 ℃温箱中孵育30 min,最后在避光环境下滴加DAB显色,显色情况在光学显微镜下观测,待显色完全,流水冲洗终止显色反应,再使用苏木素染色液对切片复染,脱水后中性树脂封片,在光学显微镜下观察染色情况。
1.3.2提取RNA和qRT-PCR检测 使用TRIzol试剂从待检测组织中提取总RNA,cDNA制备工作在逆转录反应试剂盒的说明书指导下完成,qPCR检测以上述步骤所得cDNA为模板进行。将GAPDH作为内参,同时每组设定3个平行副孔。引物均由上海生工生物公司合成,qRT-PCR引物序列如下:GAPDH上游:5′-AGCAAGAGCACAAGAGGAAG3′,GAPDH下游:5′-GGTTGAGCACAGGGTACTTT3′;GSE1上游:5′-ATGGTGTCTGGAGGAGTGAGAGC-3′,GSE1下游:5′-AGGTCGTCGGTGGTGTGGTAG-3′。实验步骤如下:94 ℃下预变性、变性,后60 ℃退火延伸,重复循环40次,继而进行融解曲线反应,基因样本的扩增Ct值经由软件分析并导出,记录所得实验数据。
1.3.3蛋白提取和Western blot检测 收集新鲜组织并用蛋白裂解液裂解后提取蛋白,使用10% SDS-PAGE凝胶电泳,在300 mA恒流条件下转膜90 min,浆膜置于浓度为5%脱脂牛奶中,室温下摇床封闭1 h,TBST洗膜3次,4 ℃冰箱内一抗孵育过夜;TBST洗膜后加入二抗,37 ℃温箱内孵育1 h,洗膜后配置ECL液进行检测。
1.4 结果判定GSE1免疫反应阳性以细胞质中即见棕黄色颗粒状物质沉积作为判断并进行计数,并随机选择5个不重复的视野对免疫组化切片进行观察,对所挑选的每个视野范围内对细胞进行计数。依据半定量积分法对最终结果进行判断,并由2名资深病理科医师完成打分,标准如下:① 依照反应着色强度打分。0分:细胞无明显的着色反应;1分:浅黄色;2分:棕黄色;3分:棕褐色。② 依照同一视野下阳性细胞个数占观测所得细胞总数比例进行打分。0分:视野中未发现阳性细胞;1分:阳性细胞所占比率≤10%;2分:阳性细胞所占比率为11%~50%;3分:阳性细胞所占比率51%~75%;4分:阳性细胞所占比率>75%。将上述各切片打分后的① ②两项得分相乘,依据相乘后所得的分数将结果划分为4个等级:“-”:≤2分;“+”: 3~4分;“2+”:6~8分;“3+”:≥9分,依所得分数判定≥6分为反应阳性[9]。
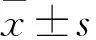
2 结果
2.1 GSE1在HCC组织及癌旁非肿瘤组织中的表达本实验收集30组新鲜HCC和30组癌旁非肿瘤组织进行qRT-PCR实验,测定GSE1 mRNA在不同组织中的表达。结果发现HCC组中GSE1的mRNA表达与癌旁非肿瘤组织相比上调(P<0.000 1),见图1。接着运用Western blot实验进一步检测GSE1在实验组和对照中的表达情况,结果表明在HCC组织中GSE1的表达上调,见图2。

图1 GSE1 mRNA在HCC组织及癌旁非肿瘤组织中的表达
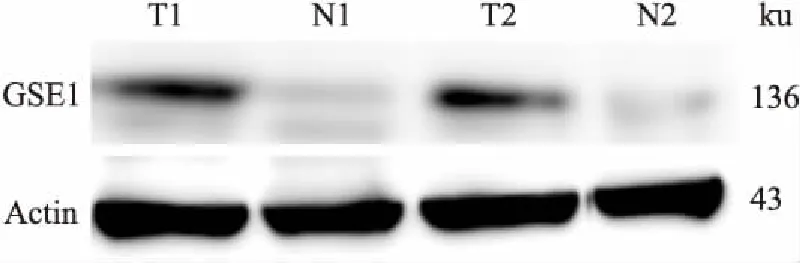
图2 GSE1蛋白在HCC组织及癌旁非肿瘤组织中的表达
在免疫组化实验中,GSE1的表达定位于细胞质,见图3。GSE1蛋白在71例HCC组织中阳性率为50.70%(36/71),41例癌旁非肿瘤组织阳性率为19.51%(8/41)。GSE1蛋白在HCC组织与癌旁非肿瘤组织中的表达存在差异(P<0.05),见表1。

图3 GSE1在不同肝组织中的表达

表1 GSE1在不同肝组织中的表达
2.2 GSE1蛋白在HCC组织中的表达结果与临床病理参数之间的相关性在HCC组织中,GSE1蛋白水平的变化与TNM分期相关(P<0.01),与统计的其余参数均未见相关,见表2。
3 讨论
恶性肿瘤发生的根本原因包括了原癌基因的激活和抑癌基因功能的丧失。HCC作为肝癌中最为常见的组织学亚型,其预后不佳,经统计患者5年生存率不足15%[10],因此对可能参与到HCC进展过程中关键因素的研究十分重要。既往的研究中Yao et al[11]发现ASB16-AS1可作为癌基因调节miR-1827/FZD4/Wnt/β-catenin途径促进HCC的进程;Salah et al[12]则发现MiR-34a可作为抑癌基因并能被制成纳米制剂用于HCC的治疗。而对于早期HCC患者,经射频消融治疗的短期生存率优异[13]。
GSE1是一种富脯氨酸蛋白质,分子量136 ku[14],首次Nagase et al[15]通过使用离子阱质谱法被分离和鉴定,定位于16q24.1。Chai et al[6]在GSE1的研究中发现GSE1在体外可以介导乳腺癌的进展。通过实验证明了GSE1在乳腺癌中高表达,siRNA对乳腺癌细胞系GSE1基因敲除抑制乳腺癌细胞的增殖、迁移和侵袭。通过qRT-PCR对新鲜冰冻乳腺癌组织进行检测发现,miR-489-5p在乳腺癌组织中的表达减少。此外,miR-489-5p的高表达抑制了乳腺癌细胞的增殖、迁移和侵袭,并且miR-489-5p的靶基因是GSE1。同时Ding et al[7]在对GSE1的进一步研究中,选取了100组人胃癌组织和正常胃组织进行免疫组化实验,结果发现相比于正常组织,胃癌组织中高表达,并对上述100名胃癌患者临床病理数据进行分析,发现GSE1的表达与淋巴结转移及临床分期相关,对患者术后5年随访调查发现,胃癌组织中GSE1高表达患者的无复发生存率及总生存率均低于低表达组,这些数据表明GSE1与胃癌患者的预后不良有关。

表2 GSE1在HCC中的表达与临床病理参数的关系
本研究检测首先使用qRT-PCR方法检测GSE1 mRNA在新鲜HCC组织及癌旁非肿瘤组织中的表达情况。结果显示,GSE1在HCC组织中的表达上调;接着使用Western blot检测GSE1蛋白在新鲜HCC组织及癌旁非肿瘤组织中的表达情况。结果显示,GSE1蛋白在HCC组织中表达水平较高;最后使用免疫组化的方法测定GSE1在石蜡样本中的表达,结果显示GSE1在HCC组织中表达上调且GSE1的高表达与HCC的临床分期正相关。这与Ding et al[7]在胃恶性肿瘤研究结果相一致,提示了GSE1可能扮演着癌基因的角色。
