miR-373-3p通过靶向Rab22a调节结肠癌SW480细胞增殖和转移
2020-08-05丁永斌宋冬梅颜雪方
杨 熹, 丁永斌, 宋冬梅,葛 军, 颜雪方
结肠癌是临床常见的癌症类型,是癌症导致死亡的主要原因之一,癌基因的过度激活与抑癌基因的失活是导致结肠癌发生的主要因素[1]。目前对结肠癌的治疗方案主要包括手术治疗、化学治疗、放射治疗以及靶向治疗[2]。手术治疗是目前结肠癌治疗的一线方案,然而由于肿瘤的转移和复发,能够取得的效果有限[3]。MicroRNA(miRNA)是一类非编码RNA分子,在细胞分化、细胞增殖与生存等各个方面均发挥着重要的作用,miRNA可靶向结合于目的mRNA,导致目的mRNA翻译抑制或者降解,miRNA在癌组织中的异常表达与癌症的发生发展有着密切联系,因此,基于miRNA的理论,目前已发展出了一系列全新的诊断和治疗方案[4]。miR-373-3p是一种人类胚胎干细胞特异性的miRNA,研究表明,其在癌细胞中扮演着截然不同的角色。有证据指出miR-373-3p在一些癌症中发挥着致癌基因的角色,然而,同样有文献报道了miR-373-3p对一些癌症的抑制作用[5]。该研究在前人研究的基础上,培养结肠癌细胞SW480,并通过miR-373-3p mimic和Rab22a过表达细胞株,探究了在结肠癌细胞中miR-373-3p与Rab蛋白22a(Rab22a)的相互作用关系及其调控作用。
1 材料与方法
1.1 主要试剂RPMI 1640培养液、胎牛血清购自美国Gibco公司;青链霉素、TRizol提取液、RIPA裂解液、BCA试剂盒、CCK-8试剂盒购自上海碧云天生物技术研究所;lipofectamine 2000购自美国Thermo Fisher公司;miR-373-3p mimic、阴性对照mimic(mimic NC)、Rab22a重组慢病毒由上海吉玛制药技术有限公司合成;所用引物由上海生工生物公司合成;Primescript RT Reagent kit和SYBR PremixEX Taq II试剂盒购自日本Takara公司;荧光素酶报告系统购自美国Promega公司;GAPDH、Rab22a、Ki67、上皮性钙黏附蛋白(E-cadherin)、神经性钙黏附蛋白(N-cadherin)抗体购自美国Santa Cruz公司。
1.2 细胞培养NCM460人正常结肠上皮细胞和SW480、SW620、HCT116和LOVO人结肠癌细胞株购自美国ATCC公司,使用加入了10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的RPMI 1640培养液培养细胞,培养条件5%CO2、37 ℃。
1.3 细胞分组及处理将SW480细胞分为不经任何处理的结肠癌SW480细胞组(SW480组)、阴性对照组(mimic NC组)、miR-373-3p mimic组、pLV-Rab22a组、pLV-Rab22a+miR-373-3p组, mimic NC转染mimic NC组细胞,miR-373-3p mimic转染miR-373-3p组细胞,Rab22a重组慢病毒转染pLV-Rab22a组、miR-373-3p mimic和Rab22a重组慢病毒共转染pLV-Rab22a+miR-373-3p组,miRNA转染的操作按照lipofectamine2000说明书进行。转染48 h用于后续实验。
1.4 结肠癌样本获取27例结肠癌组织及配对正常结肠组织样本取自南京医科大学附属江苏盛泽医院2016年12月~2019年1月结肠癌患者手术切除标本,年龄37~77(61.33±12.27)岁,术前未经过任何放化疗治疗处理,样本取材后使用液氮速冻,-80 ℃冰箱中保存,本研究已获该院伦理委员会批准并取得患者或家属同意。
1.5 慢病毒转染SW480细胞取对数生长期的细胞接种于6孔板,细胞数量约为5×104个,细胞铺满板中70%时,每孔加入10 μl 1×108TU/ml重组慢病毒转染24 h,换完全培养液5% CO2、37 ℃继续培养48 h,用于后续实验。
1.6 RT-PCR检测使用TRIzol溶液,抽提各组样品总RNA,反转录获得cDNA,根据SYBR PremixEX Taq Ⅱ试剂盒说明书进行RT-PCR检测mRNA或miRNA水平,PCR按95 ℃预变性2 min,95 ℃变性5 s,60 ℃退火10 s,重复40个循环的条件进行扩增。通过2-ΔΔCt法进行计算。
1.7 荧光素酶实验通过生物信息学预测miR-373-3p和Rab22a的靶向结合位点,根据位点序列构建pGL3 luciferase promoter野生型(wt)和突变型(mut)载体,载体分别与miR-373-3p mimic和mimic NC共转染HEK293细胞,转染48 h后检测荧光素酶活性。
1.8 CCK-8检测细胞增殖将各组细胞按1.3项的方法处理后,常规条件下继续培养,每1 d使用CCK-8法测定细胞增殖倍数,连续测定3 d。测定时将细胞接种于96孔板,每孔10 μl的CCK8试剂处理4 h,通过酶标仪测定在450 nm的吸光度值。
1.9 划痕法检测细胞迁移细胞接种于6孔板,当细胞在板内铺满80%后,使用中等枪头垂直于水平面进行划线,使用PBS缓冲液清洗,在常规条件下继续培养24 h,通过显微镜观察划痕愈合率。
1.10 Transwell法检测细胞侵袭在Transwell小室中加入50 μl基质胶,37 ℃凝固3 h,上室和下室分别加入无血清培养液和完全培养液,细胞接种于上室,常规条件下培养48 h,擦洗掉未能通过膜的细胞,残余细胞通过多聚甲醛进行固定,结晶紫染色后显微镜观察。
1.11 Western blot检测使用RIPA溶液,抽提各组样品总蛋白,BCA试剂盒定量,根据蛋白浓度,在点样孔中按每孔30 μg上样量加样,10% SDS-PAGE分离蛋白,半干转膜法将蛋白转至PVDF膜上,5%脱脂牛奶封闭2 h后,加入适量一抗4 ℃孵育过夜,PBS清洗后加入适量二抗继续孵育2 h,ECL显色液显影。
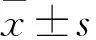
2 结果
2.1 miR-373-3p在结肠癌组织和细胞中表达下调对27例临床样本进行RT-PCR检测,如图1所示,与配对正常结肠组织比较,结肠癌组织中miR-373-3p表达降低,差异有统计学意义(t=10.58,P<0.01);对人正常结肠上皮细胞和结肠癌细胞进行RT-PCR检测,与正常结肠上皮细胞株NCM460比较,SW480、SW620、HCT116和LOVO细胞株中miR-373-3p表达均下降,差异有统计学意义(F=35.44,P<0.01)。
2.2 miR-373-3p抑制Rab22a mRNA转录miR-373-3p转染SW480细胞,并通过RT-PCR检测细胞中miR-373-3p和Rab22a相对表达水平,如图2所示,与SW480组比较,mimic NC组中miR-373-3p表达差异无统计学意义,miR-373-3p mimic组中miR-373-3p表达升高,差异有统计学意义(F=358.42,P<0.01),表明miR-373-3p成功转染了SW480细胞株;同时,与SW480组比较,mimic NC组Rab22a转录水平差异无统计学意义,miR-373-3p mimic组Rab22a转录水平降低,差异有统计学意义(F=92.33,P<0.01)。
2.3 miR-373-3p靶向作用于Rab22a生物信息学分析了miR-373-3p与Rab22a的相互作用位点,检测荧光素酶活性,如图3所示,与Rab22a WT+mimic NC组比较,Rab22a WT+miR-373-3p mimic组荧光素酶活性降低,差异有统计学意义(F=74.33,P<0.01);同时,Rab22a MUT+miR-373-3p mimic组与Rab22a MUT+mimic NC组比较差异无统计学意义。

图1 RT-PCR检测miR-373-3p在结肠癌组织及细胞株中的表达

图2 RT-PCR检测SW480细胞株中miR-373-3p

图3 荧光素报告基因检测miR-373-3p与Rab22a靶向作用关系
2.4 miR-373-3p抑制细胞增殖通过CCK-8检测了各组细胞在3 d内的细胞增殖水平,如图4所示,与SW480组比较,miR-373-3p mimic组细胞增殖水平降低(F=178.42,P<0.01),pLV-Rab22a组细胞增殖水平升高,差异有统计学意义(F=62.48,P<0.01);与pLV-Rab22a组比较,pLV-Rab22a+miR-373-3p组SW480细胞增殖水平降低,差异有统计学意义(F=49.21,P<0.01)。
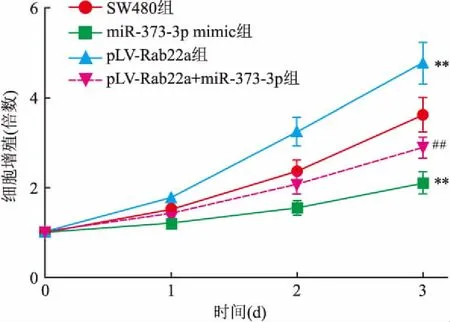
图4 CCK-8检测SW480细胞株细胞增殖水平
2.5 miR-373-3p抑制细胞迁移通过划痕愈合法检测了各组细胞的迁移能力,如图5所示,SW480、miR-373-3p mimic、pLV-Rab22a、pLV-Rab22a+miR-373-3p各组细胞划痕愈合率分别为(67.3±8.0%)、(26.8±5.1%)、(89.3±9.3%)、(51.0±6.5%),与SW480组比较,miR-373-3p mimic组细胞划痕愈合率降低(F=78.85,P<0.01),pLV-Rab22a组细胞划痕愈合率升高(F=31.43,P<0.01),差异有统计学意义;与pLV-Rab22a组比较,pLV-Rab22a+miR-373-3p组细胞划痕愈合率降低,差异有统计学意义(F=62.61,P<0.01)。

图5 划痕愈合法检测SW480细胞株迁移能力 ×100
2.6 miR-373-3p抑制细胞侵袭通过Transwell法检测了各组细胞的侵袭能力,如图6所示,SW480、miR-373-3p mimic、pLV-Rab22a、pLV-Rab22a+miR-373-3p各组细胞侵袭数目分别为(147±11)、(56±7)、(241±22)、(134±15),与SW480组比较,miR-373-3p mimic组细胞侵袭数目降低(F=89.30,P<0.01),pLV-Rab22a组细胞侵袭数目升高(F=55.28,P<0.01),差异有统计学意义;与pLV-Rab22a组比较,pLV-Rab22a+miR-373-3p组细胞侵袭数目降低,差异有统计学意义(F=75.35,P<0.01)。
2.7 miR-373-3p抑制Rab22a蛋白表达并调控增殖和转移相关蛋白表达通过Western blot检测了各组中Rab22a和增殖转移相关蛋白的表达,如图7所示,与SW480组比较,miR-373-3p mimic组Rab22a、Ki67、N-cadherin蛋白表达降低,E-cadherin蛋白表达升高(F=102.03,P<0.01),同时pLV-Rab22a组Rab22a、Ki67、N-cadherin蛋白表达升高,E-cadherin蛋白表达降低(F=233.43,P<0.01),差异有统计学意义;与pLV-Rab22a组比较,pLV-Rab22a+miR-373-3p组Rab22a、Ki67、N-cadherin蛋白表达降低,E-cadherin蛋白表达升高,差异有统计学意义(F=172.35,P<0.01)。

图6 Transwell检测SW480细胞株侵袭能力 ×200
3 讨论
Rab家族属于Ras小GTP酶超家族,在细胞内与蛋白囊泡运输有着重要的关系,已有超过60种已知的Rab蛋白定位于不同的膜结合区域。这些GTP酶与GDP结合时处于失活状态,与GTP结合时处于激活状态,活化的Rab蛋白可与特定胞膜结合并促进效应因子复合物的形成,在膜识别、融合、膜脂成分改变、细胞器运动等各个方面起着重要作用[6]。Rab22a是Rab家族的成员之一,在内体囊泡转运过程中发挥着关键作用,Rab22a过表达可导致内体形态改变,并妨碍内体向高尔基体的分子交流[7]。研究[8]表明,Rab22a在多种人类癌症疾病中表达上调,在粘着斑形成、肿瘤细胞增殖、侵袭和迁移等过程中起着重要调节作用,被认为是一种致癌基因。Rab22a在结肠癌中也起着促进肿瘤发生的作用,Yin et al[9]报道了miR-204-5p可通过下调Rab22a的表达抑制结肠直肠癌细胞的增殖与侵袭,并增加其对化疗药物的敏感性。miR-373-3p是一种在人类胚胎干细胞中特异性高表达的miRNA[10],在不同肿瘤组织中miR-373-3p呈现异常表达,根据肿瘤细胞类型的不同,分别发挥着促瘤和抑瘤的作用,表明miR-373-3p在肿瘤中的调控作用具有细胞特异性[11]。在结肠癌中,文献报道了miR-373-3p具有肿瘤抑制作用,Tanaka et al[12]发现在结肠癌中miR-373-3p发生异常甲基化,导致表达量下调,同时促癌基因Rab22a mRNA表达水平升高;同时Zhang et al[13]研究表明在卵巢癌中miR-373-3p通过靶向下调Rab22a表达抑制肿瘤侵袭和转移,推测在结肠癌中miR-373-3p也可通过靶向下调Rab22a的表达抑制肿瘤生长和转移。为了证实这一推测,本研究首先检测了miR-373-3p在结肠癌组织和细胞中的表达水平,结果表明在结肠癌组织和细胞中miR-373-3p表达水平降低。进一步通过miR-373-3p mimic转染SW480细胞株,结果显示miR-373-3p抑制了Rab22a的转录和蛋白表达水平,证实了miR-373-3p对Rab22a存在调控作用。通过双荧光素酶报告实验,验证了miR-373-3p与Rab22a的靶向作用关系。结合以上实验结果表明miR-373-3p在SW480细胞内可靶向抑制Rab22a的表达。

图7 Western blot检测Rab22a、Ki67、N-cadherin、E-cadherin蛋白表达
细胞增殖不受限制、易发生转化和转移是肿瘤细胞主要特征,Rab22a具有促进结肠癌细胞增殖和转移的作用[9]。为了进一步探究miR-373-3p靶向作用于Rab22a对结肠癌细胞SW480的增殖和转移的调控作用,本研究对SW480细胞增殖、迁移和侵袭等方面进行了检测,结果表明miR-373-3p抑制了SW480细胞的增殖,Rab22a过表达可减轻miR-373-3p对增殖的抑制作用;同时,本研究显示miR-373-3p抑制了SW480细胞的迁移和侵袭,Rab22a过表达可减轻miR-373-3p对迁移和侵袭的抑制作用。此外,miR-373-3p降低了Ki67和N-cadherin的蛋白表达,提高了E-cadherin的表达,Rab22a可逆转miR-373-3p的调控作用。Ki67是常见的细胞增殖标志物,其水平变化可反映出细胞增殖的情况[14];N-cadherin是一种间叶细胞标志物,E-cadherin是一种上皮细胞标志物,E-cadherin下调以及N-cadherin上调标志着细胞从上皮细胞向间叶细胞表型的转变,细胞的迁移和侵袭能力提升[15-16]。结合以上实验结果表明miR-373-3p可通过下调Rab22a表达抑制SW480细胞增殖和转移。
综上,在结肠癌细胞中,miR-373-3p可靶向作用于Rab22a,降低Rab22a的基因和蛋白表达水平,抑制Ki67和N-cadherin的表达,提高E-cadherin的表达,进而抑制结肠癌细胞的增殖、迁移和侵袭。本研究从体外水平SW480研究了miR-373-3p对Rab22a的靶向关系及其对结肠癌细胞增殖、迁移和侵袭的作用,今后考虑构建裸鼠移植瘤模型,进一步探讨miR-373-3p和Rab22a在裸鼠体内的调控作用及机制。
