miR-17通过调节脂肪酸代谢抑制非小细胞肺癌A549细胞的生长和转移
2020-08-05秦新新吕雪莲白义凤
秦新新,邱 竞,吕雪莲,李 佳,刘 宇,白义凤
肺癌(lung cancer,LC)是最常见的恶性肿瘤之一,也是全球最致命的癌症,约占所有癌症死亡人数的25%[1]。而非小细胞肺癌(non-small cell lung cancer,NSCLC)约占LC病例的85%,且在诊断时,大约75%的患者处于中晚期,五年生存率非常低[2]。尽管近年来在肺癌领域中研发了新药和新疗法,但是仍然存在生存率低和副作用强等缺陷。因此,急需探索新的分子靶标来改善NSCLC的治疗。miR-17是常见抑癌基因之一,在前列腺癌、乳腺癌、卵巢癌等多种癌症中低表达,可通过调节肿瘤细胞增殖、凋亡和侵袭抑制癌症的发展[3]。miR-17在NSCLC中低表达[4],miR-17-5p下调导致NSCLC细胞对厄洛替尼耐药[5]。但miR-17对NSCLC的作用和机制尚不清楚。miRNA可通过调节脂肪酸代谢改变NSCLC细胞生长,如miR-21[6]。该研究探讨miR-17通过调节脂肪酸代谢对NSCLC作用及机制。
1 材料与方法
1.1 主要试剂DMEM培养液(杭州吉诺生物医药技术有限公司,货号:CNM-12851);胎牛血清(上海素尔生物科技有限公司,货号:16000-044);青霉素和链霉素双抗溶液(上海素尔生物科技有限公司,货号:15140122);Lipofectamine 2000转染试剂(上海恪敏生物科技有限公司,货号:11668-027);miR-17 mimic 质粒、mimic-NG质粒、pc-CD36质粒、pc-SCD质粒及各种引物由上海生工生物工程股份有限公司设计并合成;磷脂测定试剂盒(上海艾研生物科技有限公司,货号:bs20193);三酰甘油测定试剂盒(南京博全科技有限公司,货号:E1013);RIPA裂解缓冲液(南京海克尔生物科技有限公司,货号:SBJ-0999);BCA试剂盒(上海易色医疗科技有限公司,货号:BC201);分化簇36(cluster of differentiation 36,CD36)、脂肪酸合成酶(fatty acid synthase,FASN)、乙酰辅酶a羧化酶(acetyl-CoA carboxylase,ACC1)、脂肪酸结合蛋白5(fatty acid binding protein 5,FABP5)抗体(上海艾博抗生物科技有限公司,货号:ab133625、ab22759、ab45174、ab37267);双荧光素酶报告基因检测试剂盒(北京原平皓生物技术有限公司,货号:GN201-01)。
1.2 细胞培养人NSCLC细胞系(H1703、A549、H1299、L78、PGCL3、H460)和正常肺细胞(BEAS-2B)购自美国典型培养物保藏中心。用含有100 U/ml青霉素和100 μg/ml链霉素的10%牛血清的DMEM培养基,在37 ℃、5% CO2培养箱培养。
1.3 细胞转染取对数期的A549细胞,接种于6孔板(1×106/孔)。当达到80%融合,根据Lipofectamine 2000说明书将100 nmo/L 的miR-17 mimic 质粒、mimic-NG质粒、pc-CD36质粒、pc-SCD质粒分别或联合转染进入A549细胞。
1.4 RT-qPCR检测miR-17 mRNA的表达采用QIAzol裂解试剂提取总RNA,采用cDNA逆转录试剂盒合成cDNA。RT-qPCR采用SYBR-Green PCR试剂盒说明书操作进行。U6作为内参,使用2-ΔΔCt方法计算。U6的上游引物序列:5′-CTCGCTTCGG CAGCACA-3′,下游引物序列:5′-AACGCTTCACG AATTTGCGT-3′;miR-17的上游引物序列为:5′-TGCGGCAAAGTGCTTACAGTG-3′,下游引物序列为:5′-CCAGTGCAGGGTCCGAGGT-3′。
1.5 克隆形成实验检测细胞生长将各组A549细胞接种于96孔板,按照2×103个细胞/孔,直到生长至可见菌落。用甲醇固定菌落,0.25% 结晶紫染色30 min,计数菌落数量。
1.6 划痕实验检测细胞迁移能力将各组A549细胞消化铺满单层,并用小号枪头垂直划痕,加入无血清培养基,在5% CO2、37 ℃恒温的培养箱培养24 h后,分别在显微镜下拍照,用 Image J 软件分析。
1.7 Transwell法检测细胞侵袭能力在Transwell小室上室接种A549细胞悬浮液和不含血清的培养基,终浓度为 2.5×105个/ml,并在Transwell小室下室加入含血清和丝裂霉素C的培养基,培养48 h后,取出Transwell 小室,用结晶紫染色,并在显微镜下观察分析,侵入细胞数表示为每视野的平均细胞数。
1.8 试剂盒检测磷脂和三酰甘油含量根据磷脂测定试剂盒和三酰甘油测定试剂盒说明书,测定各组细胞中磷脂和三酰甘油的含量。
1.9 Western blot检测CD36、FASN、ACC1、FABP5蛋白表达水平收集各组细胞,用RIPA裂解液提取总蛋白,并用BCA试剂盒检测蛋白浓度,然后经 SDS-PAGE分离蛋白后,用半干转膜仪转移蛋白质至PVDF膜,并用脱脂牛奶室温封闭蛋白2 h,再加入兔来源的单克隆一抗(CD36 1 ∶1 000、FASN 1 ∶500、ACC1 1 ∶1 000、FABP5 1 ∶1 000)在4 ℃ 封闭过夜,接着加入对应山羊抗兔二抗(1 ∶2 000)室温封闭1 h,最后滴ECL曝光,以GAPDH为内参,使用Quantity One软件分析目标蛋白的相对表达水平。
1.10 双荧光素酶报告检测靶向关系收集生长至对数期的A549细胞,铺于96孔板,每孔约4×103个细胞,24 h后,分别转染mimic-NC+SCD wt、mimic-NC+ SCD mut、miR-17 mimic+SCD wt、miR-17 mimic+SCD mut,根据双荧光素酶报告基因试剂盒说明进行测定,用萤火虫荧光素酶活性和肾荧光素酶活性比值表示荧光素酶的相对活性。
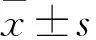
2 结果
2.1 miR-17在NSCLC中表达下调RT-qPCR结果显示,不同细胞组间 miR-17 mRNA的表达水平差异有统计学意义(F=46.258,P=0.000)。与正常肺细胞BEAS-2B相比,NSCLC细胞系(H1703、A549、H1299、L78、PGCL3、H460)中miR-17 mRNA的表达下调(P<0.01),并选择A549细胞做后续实验。见图1。

图1 RT-qPCR检测miR-17 mRNA的表达与正常肺细胞BEAS-2B比较:**P<0.01
2.2 miR-17抑制NSCLC细胞A549的细胞生长和转移克隆实验结果显示,对照组、mimic-NC组、miR-17 mimic组克隆细胞数目分别是(187.67±12.56)、(185.43±11.82)、(98.67±10.92),组间差异有统计学意义(F=672.344,P=0.000)。划痕实验结果显示,对照组、mimic-NC组、miR-17 mimic组划痕闭合率分别是(45.13±9.12)%、(44.52±8.76)%、(19.46±8.69)%,组间差异有统计学意义(F=527.346,P=0.000)。Transwell结果显示,对照组、mimic-NC组、miR-17 mimic组克隆细胞数目分别是(271.21±11.37)、(268.33±12.14)、(109.67±11.86),组间差异有统计学意义(F=976.552,P=0.000)。与对照组相比,mimic-NC组克隆细胞数目、划痕闭合率、侵袭细胞数目均无变化(P>0.05),miR-17 mimic组克隆细胞数目、划痕闭合率、侵袭细胞数目均减少(P<0.01)。见图2。
2.3 miR-17抑制NSCLC细胞中脂肪酸代谢各组间细胞磷脂和三酰甘油含量及FASN、ACC1、FABP5蛋白表达差异均有统计学意义(F=326.574,P=0.000;F=533.813,P=0.000;F=126.576,P=0.000;F=143.645,P=0.000;F=203.744,P=0.000)。与Control组相比,mimic-NC组细胞磷脂和三酰甘油含量及FASN、ACC1、FABP5蛋白表达均无变化(P>0.05),miR-17 mimic组细胞磷脂和三酰甘油含量均降低(P<0.01),FASN、ACC1、FABP5蛋白表达均下调(P<0.01)。见图3。
2.4 CD36逆转了miR-17对非小细胞肺癌细胞生长、转移和脂肪酸代谢的调控各组间CD36蛋白表达水平差异有统计学意义(F=187.394,P=0.000)。与Control组相比,mimic-NC组CD36蛋白表达均无明显变化,miR-17 mimic组细胞CD36蛋白表达均明显下调(P<0.01)。各组间克隆细胞数目、划痕闭合率、侵袭细胞数目、磷脂和三酰甘油含量、FASN、ACC1、FABP5蛋白表达水平,差异均有统计学意义(F=686.457,P=0.000;F=592.341,P=0.000;F=964.162,P=0.000;F=346.242,P=0.000;F=564.183,P=0.000;F=193.465,P=0.000;F=206.497,P=0.000;F=239.674,P=0.000)。与miR-17 mimic组相比,miR-17 mimic + pc-CD36组细胞克隆数目增加(P<0.01),划痕闭合率升高(P<0.01),侵袭细胞数目增加(P<0.01),磷脂和三酰甘油含量均升高(P<0.01),FASN、ACC1、FABP5蛋白表达均上调(P<0.01),见图4、5。
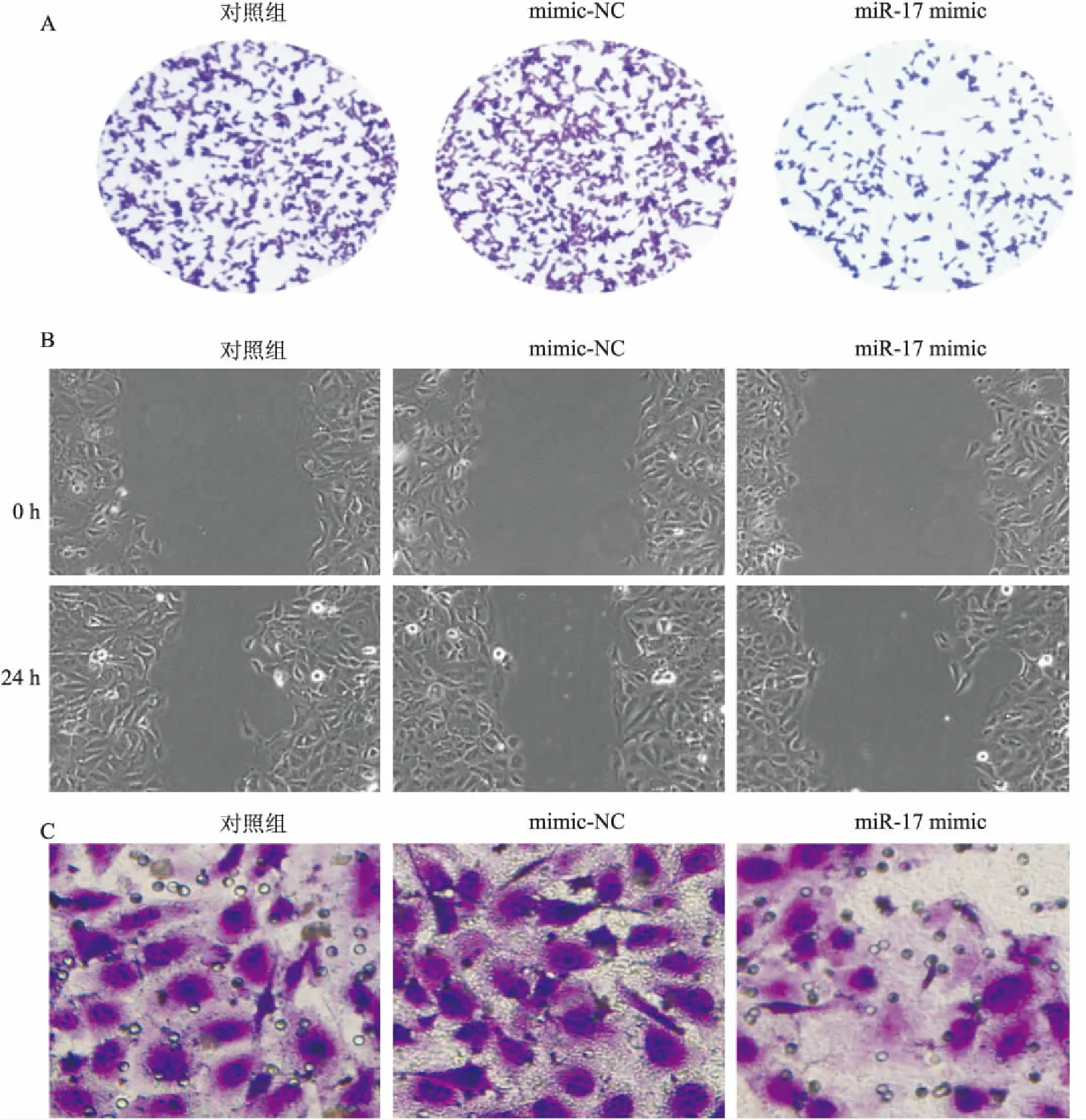
图2 miR-17抑制NSCLC细胞A549的细胞生长和转移

图3 miR-17抑制非小细胞肺癌细胞中脂质代谢

图4 CD36逆转了miR-17对非小细胞肺癌细胞生长和转移的调控
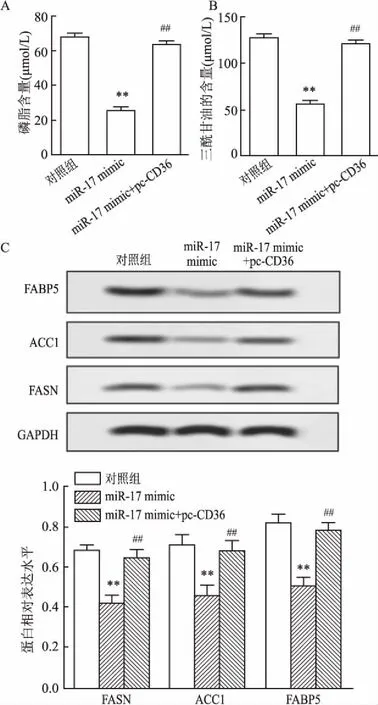
图5 CD36逆转了miR-17对非小细胞肺癌细胞脂质代谢的调控
2.5 miR-17靶向SCD调控CD36通过TargetScan数据库的预测miR-17与硬脂酰辅酶A去饱和酶(stearoyl CoA desaturase,SCD)的3′UTR存在结合位点(图6A)。双荧光素酶测定发现,各组间荧光素酶活性差异有统计学意义(F=843.643,P=0.000);miR-17 mimic明显抑制了含有野生型SCD质粒的荧光素酶活性(P<0.01),但对突变型SCD质粒的荧光素酶活性无影响(P>0.05)。各组间CD36表达水平,差异有统计学意义(F=163.454,P=0.000);与miR-17 mimic组相比,miR-17 mimic + pc-SCD组细胞中CD36蛋白表达均上调(P<0.01)。见图6。
图6 miR-17靶向SCD调控CD36
3 讨论
尽管近年来NSCLC的诊断和治疗取得了很大的进步,但5年生存率仍然很低,复发和死亡率也仍然很高。 因此,急需进一步研究NSCLC的分子靶点和机制来改善NSCLC的治疗。miRNA参与包括细胞增殖、生长、分化、凋亡等多种生物学过程。miR-17是常见抑癌基因之一,同Huang et al[4]研究结果miR-17在NSCLC中低表达相一致,本研究结果表明:与正常肺细胞BEAS-2B相比,非小细胞肺癌细胞系(H1703、A549、H1299、L78、PGCL3、H460)中miR-17 mRNA的表达明显下调。研究还发现高表达miR-17能够明显减少A549细胞克隆数目、降低划痕闭合率、减少侵袭细胞数目,说明miR-17抑制非小细胞肺癌细胞A549的细胞生长和转移。
有研究[7]显示,miRNA在葡萄糖代谢,脂肪代谢和氨基酸代谢等能量代谢中起重要作用,如miR-181a通过异柠檬酸脱氢酶1调节脂质代谢。脂质代谢的改变已被公认是癌细胞的标志性特征。脂质主要包括脂肪酸、甘油三酸酯和胆固醇,脂肪酸是癌细胞中能量存储、膜合成、信号分子生成所需的基本底物[8]。而在癌症的发展过程中,脂肪酸代谢途径的改变不仅为癌症的发生和发展提供能量,而且在生物膜大分子和信号分子中也起着重要的作用[9]。为了研究miR-17对NSCLC细胞脂肪酸代谢的影响,测定了脂质和关键脂质代谢酶的细胞内含量,结果发现,高表达miR-17明显降低A549细胞内磷脂和三酰甘油含量,下调FASN、ACC1、FABP5蛋白表达,说明miR-17抑制非小细胞肺癌细胞中脂肪酸代谢。
CD36是脂质和脂肪酸的受体,在代谢综合征和相关的心脏活动中起重要作用,参与脂质代谢、长链脂肪酸吸附、凋亡残基清除和巨噬细胞吞噬作用[10]。CD36调节的脂肪酸代谢与肿瘤的发生和发展密切相关,如外源性脂质通过CD36促进乳腺癌细胞的生长[11]。脂肪酸受体CD36和脂质代谢基因具有启动细胞转移的能力,如棕榈酸通过CD36启动癌细胞的转移潜能[12]。本研究显示,高表达miR-17下调A549细胞CD36蛋白表达。随后共转染pc-CD36质粒发现,CD36的上调逆转了miR-17对非小细胞肺癌细胞生长、转移和脂肪酸代谢的调控。
为了研究miR-17调节CD36表达的详细机制,通过TargetScan数据库的预测SCD是miR-17的直接靶标。SCD一种负责脂肪酸合成的限速酶,参与维持细胞快速增殖,逃避细胞凋亡,促进各种类型癌症中的癌细胞起始和恶性转化[13]。SCD在肺癌、乳腺癌和前列腺癌等多种癌症中发现高表达,具有致癌作用[14]。SCD可通过调节内质网应激来调节肝肿瘤启动细胞[15]。本研究结果表明,SCD的上调逆转了miR-17高表达对CD36表达的抑制作用,说明miR-17通过靶向下调SCD来调控CD36表达,进而影响CD36介导的脂肪酸代谢,从而抑制非小细胞肺癌细胞生长和迁移。综上所述,miR-17靶向SCD通过调节CD36介导的脂肪酸代谢来抑制非小细胞肺癌细胞生长和转移,为临床治疗非小细胞肺癌提供一种新的治疗方法,但更为动物体内实验还有待进一步研究。
