胃食管反流病大鼠模型探讨
2020-08-05陈小苏王艳鲍云王艳娟林琳叶必星
陈小苏 王艳 鲍云 王艳娟 林琳 叶必星
胃食管反流病(gastroesophageal reflux disease,GERD)为消化系统常见病之一,因胃十二指肠内容物反流入食管引起反酸、烧心等症状[1]。2018年发表于Gut杂志的meta分析显示GERD全球发病率为25%‐51.2%,并呈逐年升高趋势[2]。
GERD可分为非糜烂性反流病(non‐erosive reflux disease,NERD)、糜烂性食管炎(erosive esophagitis,EE)和Barrett食管(Barrett`s esophagus,BE)三种类型[3][4]。动物模型对于人类疾病的病因学、病理学,分子机制以及治疗和预防至关重要,迄今为止,科研人员已用多种方法构建了猪、狗、兔,鼠等GERD模型[5]。因鼠类的基因组结构、解剖学结构、繁育过程、生化代谢途径都与人类接近,且大鼠的繁殖能力极快,容易取得、价钱便宜,大鼠容易受反流诱导发展成GERD;而小鼠造模相对困难,如不能耐受手术,小鼠食管较小;大动物造模代价较大。尽管大鼠的食管与人类的食管在角化和黏膜下腺体方面有很大不同,GERD模型的实验动物主要来源于大鼠[6,7]。本文综述了GERD大鼠常见造模方法、优缺点、存活率、成功率等。
一、急性GERD模型
1.完全幽门结扎术(total pyloric ligation):1938年Selye等[8]首次用大鼠行完全幽门结扎术(见图1),他们也首次提出了酸诱导的反流性食管炎的概念[9]。该术式的特点:幽门被完全结扎以后,胃排空受阻,胃液潴留,胃液可明显反流入食管,引起急性酸性食管炎。缺点:该大鼠模型存活时间短,约1~2天,GERD是一种慢性病,因而对反流性食管炎的研究价值有限[9]。2003年Tugay M等用此模型研究了食管炎对食管平滑肌反应性的影响[10]。

图1 完全幽门结扎术
2.完全空肠结扎术(total jejunal ligation):Tugay等[10]通过结扎距Treitz韧带远端1 cm的空肠,建立混合性反流模型。术后24 h实验大鼠出现食管炎表现。缺点:该模型只能短期观察反流物对食管的急性损伤情况,不能很好地模拟人类GERD的自然病程。由于混合反流比单纯的酸反流产生更多的自由基,该模型可用于探讨自由基介导食管损伤的机制及防治[11,12]。
3.外源性食管灌注液体(External esophageal perfusion,EEP):Li等[13]在大鼠颈背部皮下包埋微渗透泵,在颈部高度将PE‐50导管置入大鼠食管中,这种泵把外源性胆汁(0.5%胎牛胆汁,pH7.4)小量持续灌注到大鼠食管,通过胆汁直接损伤食管黏膜来构建急性GERD模型(见图2)。这种微渗透泵灌注速度有2.5 ul/h,5 ul/h,10 ul/h。优点:这种方法创伤小,术后恢复快,存活率高,成功率约100%。缺点:人食管炎是一个多因素的慢性过程,单纯胆汁损伤食管黏膜,不完全符合GERD的自然规律.该模型一般用于食管黏膜损害和防御机制的研究,还可用于评价食管炎药物疗效[14]。

图2 外源性食管灌注微渗透泵模式图
二、慢性GERD模型
1.慢性单纯性酸反流
(1)部分幽门结扎+前胃结扎术(Partial pyloric ligation+ligation of forestomach)N.Omura等[15]用18Fr Ne´laton导管部分结扎幽门,同时用2‐0丝线在前胃和腺胃之间结扎,这种方法可限制食物通过幽门、缩小胃容量、使胃内容物反流入食管(见图3)。优点:实验大鼠出现反流性食管炎约100%,3周存活率达90%。该模型有助于评估药物对食管炎的作用以及食管黏膜对损伤的反应。利用该模型,Sugawa T等[16]在2008年研究了胃食管反流病与支气管哮喘的关系;Ishiyama F等[17]在2009年研究了外源性NO对食管损伤的作用;2014年日本学者Takeuchi K等[18]研究了酸/胃蛋白酶,前列腺素和氨基酸在反流性食管炎(reflux esophagitis,RE)中的作用。此模型是目前使用较多的慢性酸反流动物模型之一。值得一提的是,单纯的酸反流并不会引起BE或食管腺癌[6]。
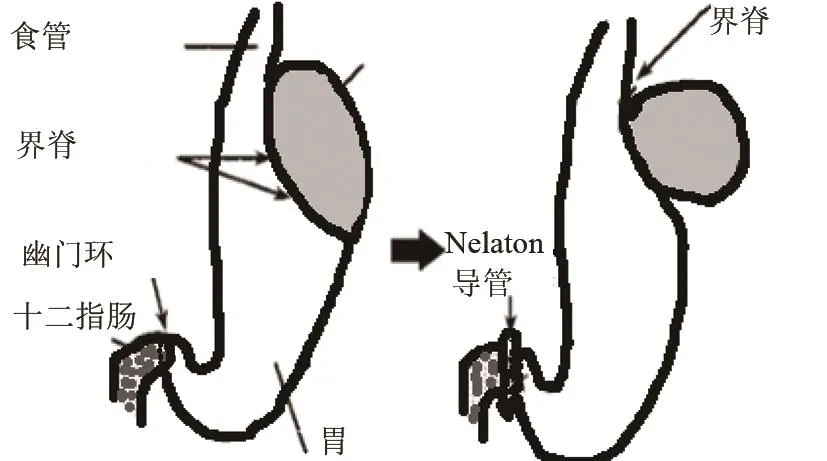
图3 部分幽门结扎+前胃结扎术
(2)食管-胃成形术(esophagogastroplasty):Attwood SE等[19]在8周龄雄性SD大鼠上行食管-胃成形术,通过在胃食管交界处做一个纵行的6 mm切口(全层切开),将胃食管交界处均匀分成两部分,然后横向分层吻合来构建胃食管反流模型(见图4)。优点:该模型能很好地模拟人类反流[20]。Melo LL等[21]借助此模型研究胃反流对食管癌变的影响。
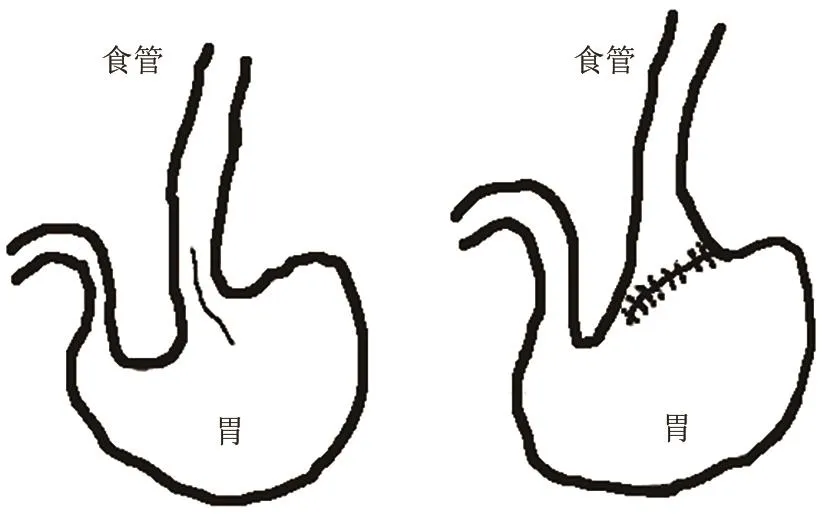
图4 食管-胃成形术
(3)esophagus):1962年LEVRATM等[22]在大鼠(见图5),胃食管交界处切断食管,关闭胃残端,将食管残端吻合到幽门前的腺胃上(端侧吻合)来构建仅有胃酸反流入食管的模型。特点:该实验组11只大鼠术后4周均未出现食管炎的表现。
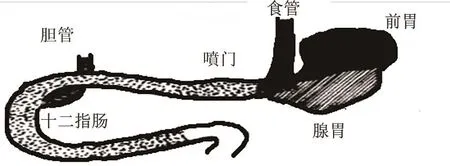
图5 食管-幽门前吻合术
(4)贲门成形+幽门结扎+胃Roux‐en‐Y式吻合术 (Cardioplasty+pyloric ligation+Roux‐en‐Y esophagojejunostomy):国内学者王雯等在大鼠上行贲门成形+幽门结扎+胃Roux‐en‐Y式吻合术构建GERD模型(见图6)。距幽门10 cm处切断空肠,其远切端与腺胃的大弯侧吻合,近切端吻合于距切断缘约15 cm处的小肠侧壁(端侧吻合)。特点:该模型仅胃液反流入食管。术后4周食管炎发生率36.4%,死亡率37.1%。缺点:该模型术式复杂,大鼠死亡率高,成功率低[23]。

图6 贲门成形+幽门结扎+胃Roux‐en‐Y式吻合术
2.慢性单纯性碱反流模型
(1)食管-空肠吻合+全胃切除术(esophagojejunostomy with total gastrectomy):Seto Y等[24]和Miwa K等[25]分别在1991年和1996年在8周龄雄性Wistar大鼠上行此术式(见图7),即在胃食管交界处做横向切口,在十二指肠与幽门交界处做纵向切口,切除全胃,关闭十二指肠残端,然后在距Treitz韧带以下约4 cm处,肠系膜对侧做一纵行切口,将食管残端进行端侧全层间断吻合到空肠的切口上,该模型单独将十二指肠内容物通过吻合口引流到食管,构建GERD模型,实验组中大鼠食管全部出现了溃疡,RE模型大鼠成功率100%[26]。
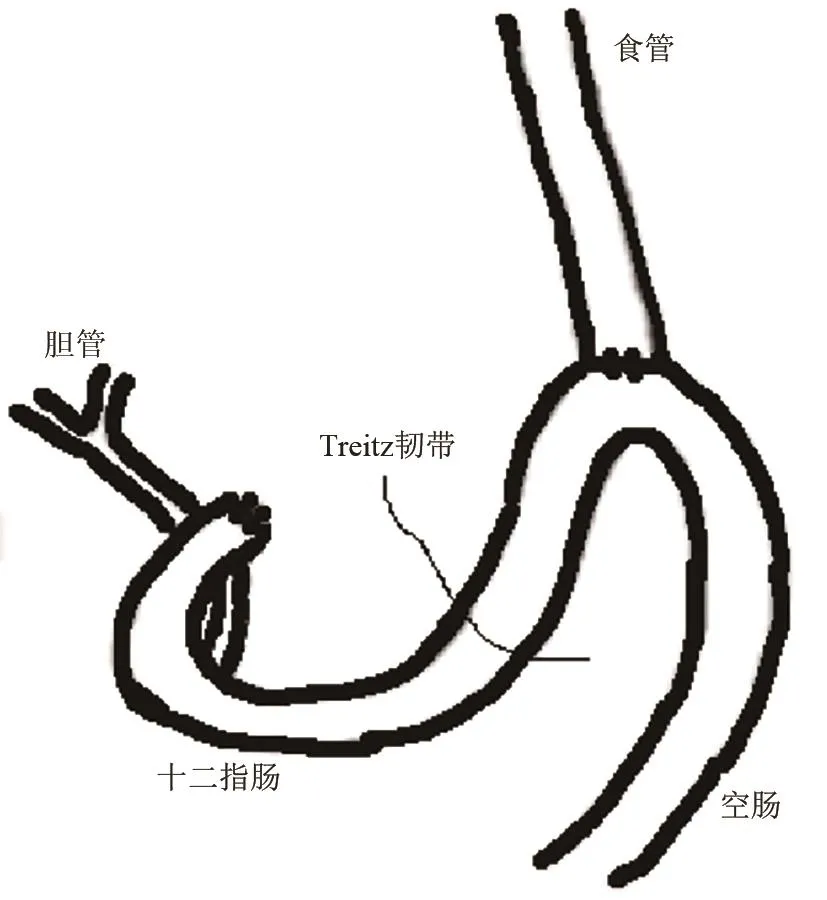
图7 食管-空肠吻合+全胃切除术
(2)食管-十二指肠吻合+全胃切除术(esophagoduodenostomy with total gastrectomy):王雯等[23]在SD大鼠上(见图8),结扎贲门,切断食管,切除全胃;十二指肠残端结扎并荷包包埋。距残端约1 cm处肠系膜对侧纵行切开十二指肠壁约0.5 cm,与食管下端行端侧吻合术。术后4周成活率为76.7%,RE发生率100%。该模型[27]产生的食管炎症更重,容易诱发食管癌。缺点:大鼠术后体重下降。
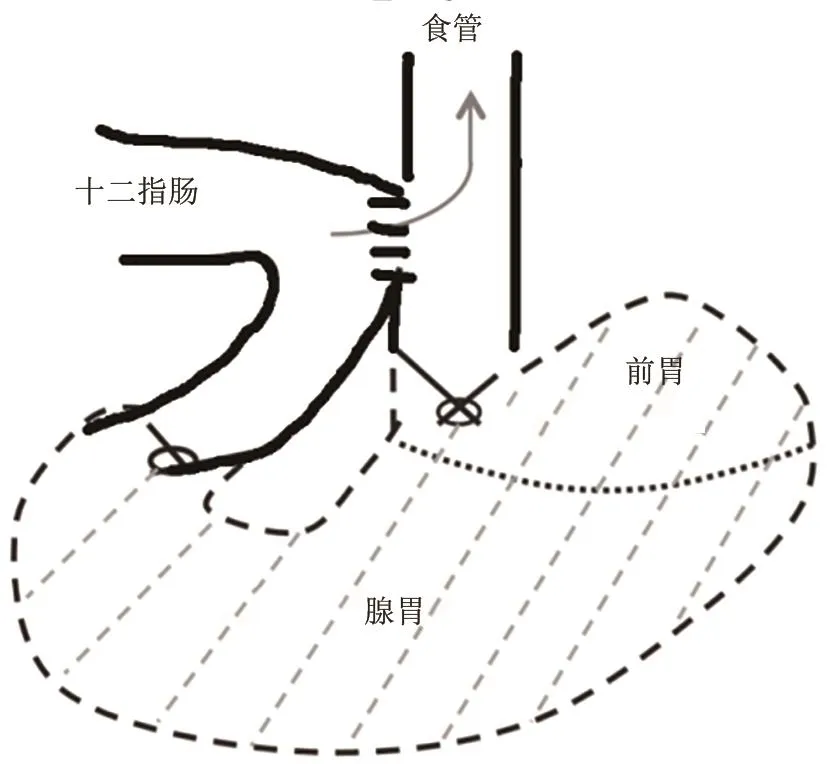
图8 食管-十二指肠吻合+全胃切除术
3.慢性混合反流模型
(1)食管-十二指肠侧侧吻合术(side‐to‐side esophagoduodenostomy):1992年Attwood SE等[19]在8周龄雄性SD大鼠(见图9)靠近胃食管交界处上方做1 cm纵行切口,全层切开食管,在距幽门1 cm附近的十二指肠近端肠系膜对侧做1 cm切口,行侧侧吻合。该模型将胃、十二指肠内容物引入食管,属于以碱反流为主的混合反流模型[7]。Fang Y等[28]用此模型研究了胃食管反流对食管屏障功能的影响。Melo LL等[21]在此模型基础上进行了改进,结扎了胃食管交界处研究胃十二指肠内容物对食管癌变的影响(见图10)。
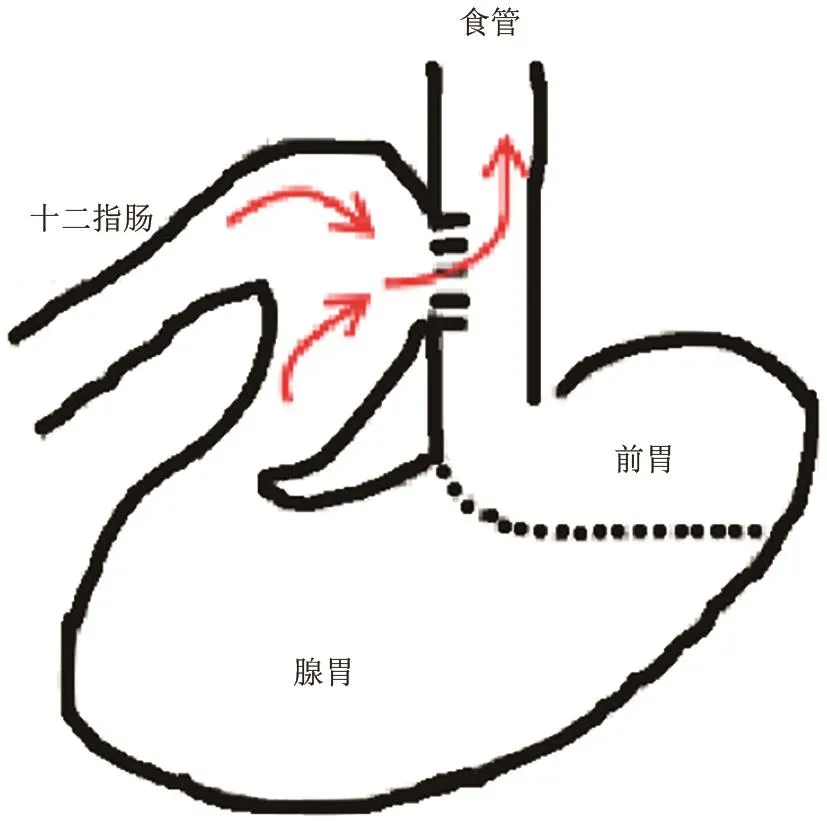
图9 食管-十二指肠侧侧吻合术

图10 食管-十二指肠侧侧吻合+贲门结扎术
(2)食管-胃-十二指肠吻合术(esophagogastroduodenal anastomosis, EGDA):Chen X等[29]在6周龄雄性SD大鼠上(见图11),分别在胃食管连接处及幽门附近的十二指肠近端肠系膜对侧做2个1.5 cm的纵向切口,全层间断吻合切口。该模型成功率100%,存活率93%。它是目前最成功、最有效的GERD模型,将胃十二指肠内容物转移到食管,但它无法控制回流物的量和浓度[7]。与其他GERD模型相比,EGDA优点:①避免了其他手术并发症,如胃功能丧失,营养不良。食物沿正常消化道传递,EGDA大鼠营养状况正常;②胃和十二指肠内容物大量回流到食道[29]。缺点:该模型会导致胃畸形,不能模拟自然发生的十二指肠反流。
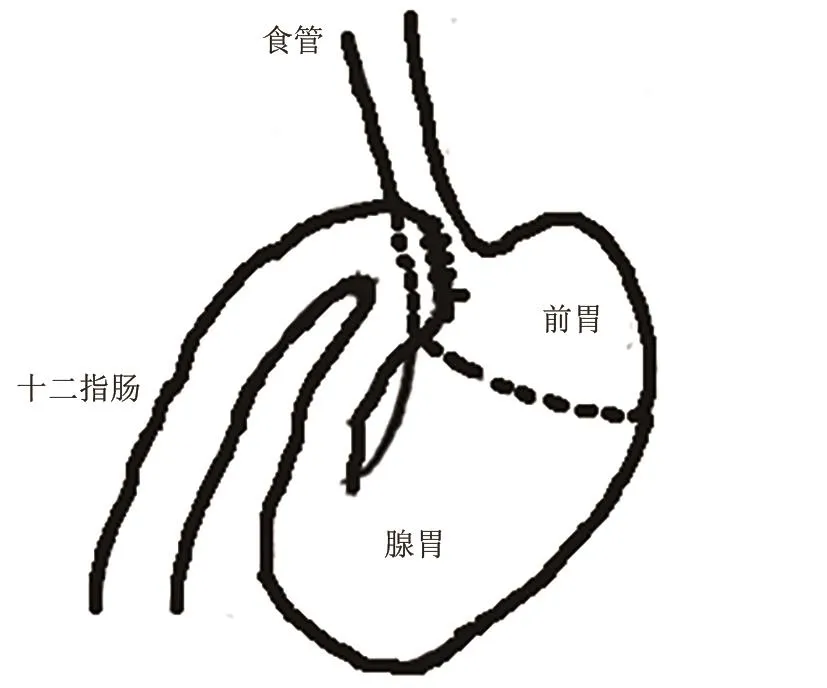
图11 食管-胃-十二指肠吻合术
(3)食管-十二指肠端侧吻合+保留全胃术(end‐to‐side esophagoduodenostomy with gastric preservation):Clark GW等[30]在8周龄SD大鼠上(见图12)在胃食管交界处离断食管,封闭胃残端,在距离幽门1 cm远的十二指肠的肠系膜对侧做一4 mm大小的纵向切口,将食管残端全层间断吻合到十二指肠上。该模型引起胃十二指肠内容物反流到下段食管导致严重的食管炎症。实验组15只大鼠(术后自由饮食组),存活13只,存活率为86.7%,存活的模型大鼠全有RE组织学表现(术后34周取材)。该术式不仅可构建BE模型,也可研究诱发食管癌的因素缺点:该模型会出现手术相关的缺铁性贫血等问题[31]。1996年Ireland AP[32]等用此模型研究了胃液对大鼠食管腺癌的的作用。
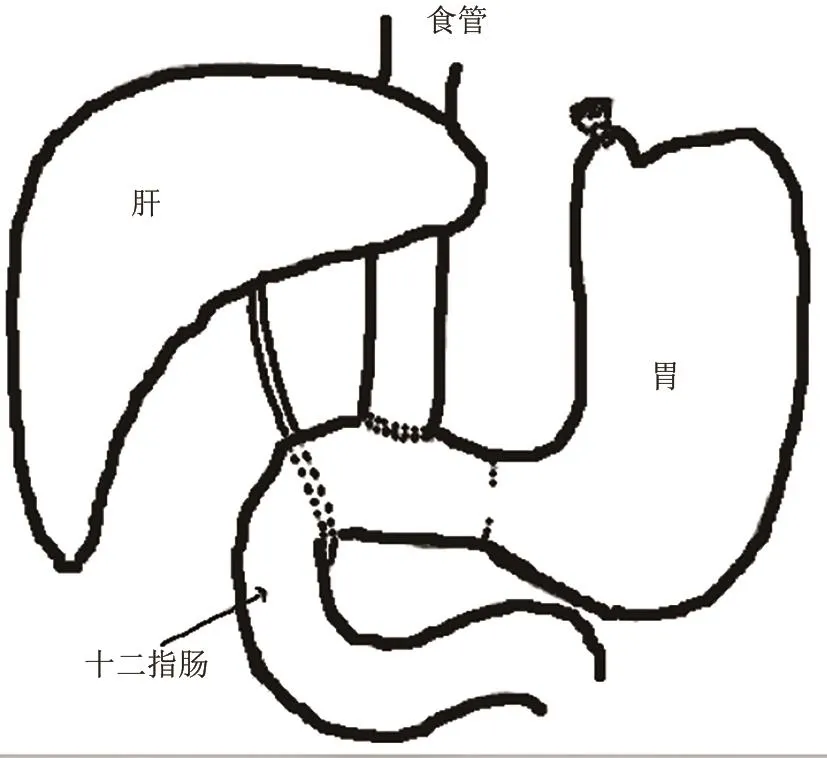
图12 食管-十二指肠端侧吻合+保留全胃术
(4)食管-胃-空肠吻合术(esophagogastrojejunostomy):H.Kumagai等[33]在雄性8周龄Wistar大鼠上行食管-胃-空肠吻合术来构建GERD模型(见图13),即在胃食管交界处和距离Treitz韧带3 cm远端的肠系膜对侧分别做1.5 cm的切口,然后侧侧全层间断吻合,这样胃液、十二指肠内容物经吻合口反流入食管。术后10周,实验组大鼠出现了食管炎以及BE组织学上的表现,随着模型大鼠存活至50周,部分大鼠发展成了食管腺癌。缺点:①模型大鼠术后会出现严重营养不良问题如体重下降,血清铁蛋白低,脂溶性维生素低;②强迫肠内容物反流入食管,这和人类生理和病理性反流不同。
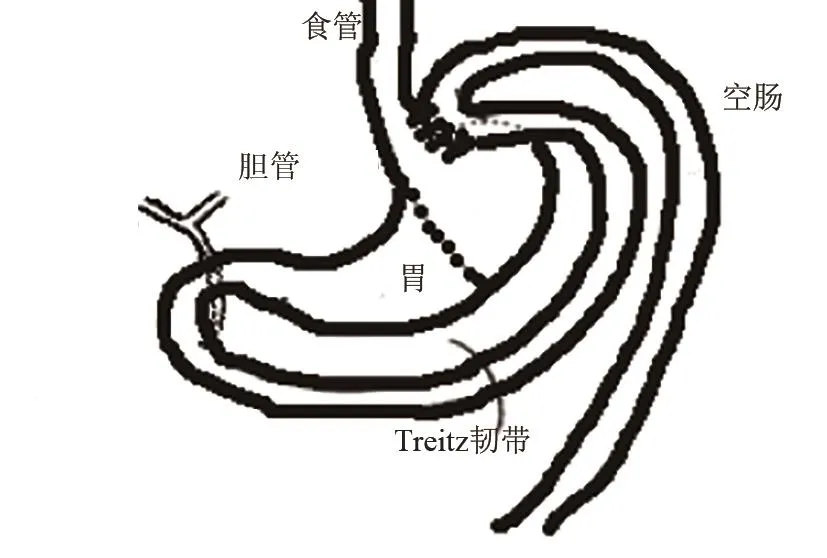
图13 食管-胃-空肠吻合术
(5)食管-空肠吻合+保留全胃术(esophagojejunostomy with gastricpreservation):Kuan‐Hao Chen等[34]按照 Pera M 等[35]和 Miwa K等[25]在8周龄雄性Wistar大鼠(见图14)胃食管交界处做横向切口,关闭远端切口,在距Treitz韧带约4 cm远处,肠系膜对侧做一纵行切口,将食管近端切口进行端侧全层间断吻合到空肠的切口上。该模型将胃、十二指肠内容物(胃液、十二指肠液、胰液)引流到食管,构建慢性反流性食管炎模型。优点:食管空肠吻合减少了十二指肠内容物反流量,也可构建食管癌模型[35,36]。同时也是研究BE和食管腺癌发病机制的可靠模型[37]。
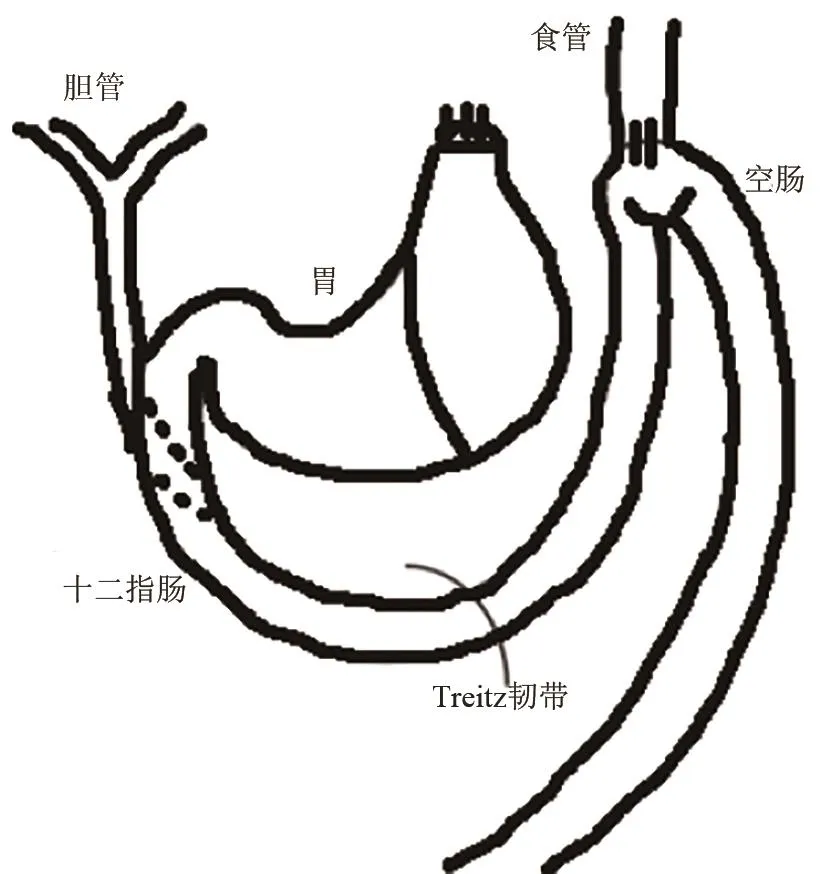
图14 食管-空肠吻合+保留全胃术
(6)Roux‐en‐Y式食管-空肠吻合+保留全胃术(Roux‐en‐Y esophagojejunostomy without total gastrectomy):1996年Miwa K等[25]行Roux‐en‐Y式食管-空肠吻合术+保留全胃术来构建GERD模型。(见图15),即在胃食管交界处做一横切口,切断食管,并用缝合线封闭远端切开端(a)。从幽门和腺胃的交界处切断十二指肠,缝合十二指肠残端(b)。在距离Treitz韧带约4 cm的远端将空肠横切(靠近十二指肠端的断端为近端,另一端为远端),并用缝合线封闭远端切开端(c)。将胃残端全层间断吻合到靠近空肠远端切开端的肠系膜对侧(端侧吻合),空肠环靠近缝合端(d)。将食管残端吻合到空肠-胃吻合口远端约1 cm处的肠系膜对侧(e)。最后,将空肠近端切口处与距离食管-空肠吻合口远端约4 cm处肠系膜对侧行端侧全层间断吻合(f)。特点:此模型阻止了十二指肠内容物(胆汁、胰液)反流入食管,仅使胃酸反流入食管[37,38]。

图15 Roux‐en‐Y式食管-空肠吻合+保留全胃术
(7)食管空肠吻合+胃空肠吻合术(esophagojejunostomy+gastrojejunostomy): Zhang T等[39]在6周龄SD雄性大鼠上(见图16)在距幽门5 mm处离断十二指肠,关闭十二指肠残端,将胃残端吻合到距离Treitz韧带约4 cm远处肠系膜对侧,在胃食管交界处上方2 mm处,离断食管,关闭胃残端,在距离胃空肠吻合口5 mm远处将食管残端吻合到肠系膜对侧(端侧吻合),该模型比食管空肠吻合或食管十二指肠吻合更能模拟GERD的病理生理状态,可作为BE研究的动物模型[40]。

图16 食管空肠吻合+胃空肠吻合术
此外,我国学者还构建了完全结扎幽门+贲门肌切开术[41];贲门钢圈置入固定术[42];不同管径内支架支撑幽门及前胃结扎术[43];全胃切除术+食管十二指肠端侧吻合术+胆管空肠吻合术[44]等模型;食道移植模型有可能用于BE起源的研究[5]。
理想的GERD动物模型应该尽量和人类结构特点相似,模拟GERD的自然演变过程,且易于实践、成活率及成功率高[7]。相对而言,目前大鼠仍是较为理想的造模动物[45]。
目前国内外通过结扎法,胃十二指肠吻合法、胃空肠吻合法、食管十二指肠吻合法、食管空肠吻合法、外源性食管灌注法等构建了GERD大鼠模型,为研究GERD的病因,机制,病理变化,治疗和预防提供了更多的可能。
尽管我们已经构建了各种大鼠反流模型,但是仍然很难将这些动物模型的结果直接外推到人类疾病中去。一方面要谨慎考虑人类和啮齿动物在结构和功能上的差异,比如大鼠的胃由前胃和腺胃组成,而人的胃全是腺胃[46];大鼠食管上皮是角化的,人的食管上皮是非角化的;大鼠食管没有黏膜下腺体,而人类则有[7,47]。Yano F等[47]研究表明不同国家的大鼠生长曲线和饮食行为即使在同一物种中也存在显著差异。这限制了在特定地区复制动物模型的普遍适用性。
GERD是由多种因素引起上消化道动力障碍性疾病,与一过性下食管括约肌松弛(transient lower esophageal sphincter relaxation,TLESR)、胃排空延迟、内脏高敏感性、食管廓清障碍、食管黏膜屏障异常,食管裂孔疝等有关[48,49],脑肠轴互动异常也参与其中[50]。然而目前的GERD大鼠模型主要依靠单一的手段(手术或外源性食管灌注)来构建[45]。它们仅符合GERD某一方面的病理生理机制,难以完全解释人体内多因素的相互作用[48]。大鼠术后死亡原因有梗阻(机械性肠梗阻、吻合口梗阻)、感染(腹腔感染、肺部感染)、窒息、出血、吻合口漏、和穿孔等[29,33]。上述问题仍然有待解。
总之,我们要根据实验目的科学地选择造模方式来构建尽可能理想的GERD模型,能够把动物研究的结果很好的外推到人类GERD疾病研究中去。
