黄芩素与黄芩苷微生物和肝脏代谢异同研究
2020-08-04解立科田小亭郭小珍刘欢王洋洋陈明苍包海鹰
解立科 田小亭郭小珍刘 欢王洋洋陈明苍*包海鹰*
(1.吉林农业大学中药材学院,吉林长春 130300; 2.中国科学院上海药物研究所,上海 201203)
黄芩为唇形科黄芩属植物黄芩Scutellaria baicalensisGeorgi 的干燥根,可清热燥湿、凉血解毒、泻火安胎等[1],其主要黄酮类成分黄芩素和黄芩苷具有抗炎、抗菌、抗病毒、抗氧化、保肝等活性[2-7]。
黄芩苷是由黄芩素与一分子葡萄糖醛酸结合形成的糖苷类化合物,大鼠分别静脉注射等量的黄芩苷和黄芩素后在血中均能同时检测到两者,表明它们可以在体内相互转化[8],但体内药效并不一致。在饮水电击冲突实验中,黄芩素、黄芩苷抗焦虑的药效剂量分别为10、20 mg/kg[9],这可能与黄芩素有比黄芩苷更高的生物利用度有关,为后者的236%[10]。目前,尽管已有多篇文献对动物口服黄芩苷或黄芩素的体内代谢物进行了系统研究[11-12],但并不能明确其具体的生成位点,需要借助体外代谢工具进行验证。针对黄芩苷和黄芩素的体外代谢,仅有文献鉴定前者在人体外肠道菌中的代谢物[13],尚未比较两者在大鼠肝脏和肠道菌的体外代谢。
近年来,LC-MS 由于其灵敏高、速度快、准确度好等优势,在药物代谢物鉴定方面广泛应用[14]。质谱分析数据的可靠性和可信度取决于所用的仪器,其中LC-Q-TOF 因其高分辨数据和快速扫描速度,成为高效率的代谢物鉴定工具;相比于低分辨数据,Q-TOF 质量分析器可提供精确的分子量,生成分子离子和碎片离子的元素组成式,区分具有相似分子量的化合物[15]。
本研究拟采用大鼠肠道菌和肝匀浆体外孵育模型,利用高分辨质谱HPLC-Q-TOF 鉴定黄芩苷、黄芩素微生物和肝脏代谢产物的异同,以期为阐释两者体内外代谢规律提供依据。
1 材料
1.1 仪器 Agilent 1260 系列高效液相色谱仪与具有双喷Jet stream 离子源的Agilent 6530 Q-TOF 相连(美国Agilent 公司);高速离心机(德国Eppendorf公司);精密天平(瑞士Mettler Toledo 公司);超纯水器(美国Millipore 公司);真空浓缩仪(美国Thermo Fisher 公司);Vortex-Genie 振荡器(美国Scientific 公司);超纯水器(美国Millipore 公司)。
1.2 试剂与药物 黄芩苷(纯度≥98%,批号MUST-14083014)、黄芩素 (纯度≥98%,批号MUST-17031608) 对照品均购自上海诗丹德标准技术服务有限公司。乙腈(色谱纯,德国Merck 公司);其他试剂均为国产分析纯。还原辅酶Ⅱ四钠盐(NADPH)(纯度>95%,瑞士罗氏公司);磷酸缓冲液(美国GE 公司);DMSO (美国Sigma 公司);厌氧培养液(批号20180616,青岛高科园海博生物技术有限公司)。
1.3 动物 SD 大鼠[生产许可证号SCXK (沪)2017-0005,体质量(200±20) g]购自上海斯莱克实验动物有限责任公司,饲养于中国科学院上海药物研究所屏障环境实验动物室 [温度 (24±2) ℃,相对湿度(70±5)%]。
2 方法
2.1 溶液制备
2.1.1 供试品溶液 精密称取适量黄芩素、黄芩苷对照品,DMSO 溶解后加入磷酸缓冲液制成400 μmol/L,即得(DMSO<1/1 000)。
2.1.2 还原型烟酰胺腺嘌呤二核苷磷酸(NADPH) 溶液 精密称取适量NADPH,加磷酸盐缓冲液制成1 mg/150 μL,即得,现配现用。
2.1.3 厌氧培养液 称取厌氧培养液9.5 g,加热搅拌溶于1 000 mL 蒸馏水中,121 ℃高压灭菌15 min,即得。
2.2 大鼠肝匀浆和肠道菌制备 空白大鼠过夜禁食,自由饮水,无菌条件下腹主动脉取血处死,迅速剪开腹腔取出肝脏,立即放于冰块上,用预冷生理盐水冲洗至灰色,称定质量,去除粘连组织后剪碎,加入5 倍量磷酸缓冲溶液,放入匀浆机中制备匀浆。
另取空白组大鼠过夜禁食,自由饮水,无菌条件下腹主动脉取血处死,取肠道内容物,肠壁用少量(生理盐水) 冲洗,与肠道内容物合并,按1 g/5 mL剂量加入无菌生理盐水,快速搅拌均匀,医用纱布过滤得肠道菌溶液。所有操作均在厌氧条件下进行。
2.3 大鼠肝匀浆和肠道菌孵化反应体系 肝匀浆孵化体系的总反应体积为200 μL。分为空白组(不含黄芩苷、黄芩素) 和400 μmol/L 黄芩苷、黄芩素组。先将50 μL 肝匀浆液加入EP 管中,再依次加入黄芩苷、黄芩素供试品溶液,NADPH 溶液,缓冲液各50 μL,反复吹打混匀以防止产生气泡,在37 ℃恒温摇床中孵育,于10、30、60、120 min时加入200 μL 预冷乙腈终止反应,4 ℃下14 000 r/min 离心10 min,取上清液待分析。所有样品平行制备3 份。
取厌氧培养液18 mL,加入肠道菌及黄芩素、黄芩苷供试品溶液各1 mL,使其终浓度为16 μmol/L,置于厌氧培养罐中,迅速放入厌氧产气袋中,封闭体系,在37 ℃下厌氧培养,于0、1、2、4、8、12、24 h 加3 倍量冰乙腈终止反应,14 000 r/min离心10 min,取上清液待分析。所有样品平行制备3 份。
2.4 分析条件
2.4.1 色谱条件 ACE Excel 3 super C18色谱柱(100 nm×2.1 nm,3.0 μm);流动相0.1% 甲酸(A) -乙腈(B),梯度洗脱(0~2 min,80% A;2~3 min,70%A;3~10 min,70%A;10~12 min,10%A;12~15 min,10% A;15~16 min,80% A;16~20 min,80%A);体积流量0.35 mL/min;柱温40 ℃;进样量10 μL。
2.4.2 质谱条件 ESI 离子源,正离子检测模式;毛细管电压4 kV;喷雾电压5 000 V;出口电压110 V;雾化气压力35 Pa;氮气体积流量5 L/min,温度300 ℃;鞘气体积流量11 L/min,温度350 ℃。采用高分辨全扫描,一级扫描分辨率30 000,二级扫描分辨率15 000,质量扫描范围m/z100~1 200。
2.5 数据分析 利用Qualitative Analysis B.06.00和MetaboliteID B.04.00 工作站进行处理。
3 结果
3.1 检测条件优化及其裂解规律推断 本研究考察了不同比例甲酸作为流动相改性剂对色谱-质谱分析的影响,发现0.1%甲酸可获得良好的色谱峰形和质谱响应信号。黄芩苷、黄芩素在正离子下产生的碎片离子种类和强度相关优于负离子,因此检测均采用正离子模式。另外,鉴于原形和代谢物具有共同骨架,后者推测要依赖于前者裂解途径。
原形成分M0-1黄芩素准分子离子峰为[M +H]+m/z271.060 3,保留时间12.174 min,分子式C15H10O5。其裂解途径遵循黄酮类化合物的经典RDA 裂解。从C 环1,3 位裂解,生成一对互补离子,即含有A 环的离子m/z169.012 8 和含有B 环的离子m/z103.053 9。碎片离子m/z169.012 8 相继脱去 H2O、CO 分子,形成碎片离子m/z151.002 2、123.007 2。准分子离子还可以先脱去一分子水形成碎片离子m/z253.049 8,并相继脱去 CO、CO 生成碎片离子m/z225.054 4、197.053 9。其裂解规律见图1A。
原形成分M0-2黄芩苷准分子离子峰为[M +H]+m/z447.091 9,保留时间为6.920 min,分子式C21H18O11。黄芩苷为黄芩素的葡萄糖醛酸化,因此在二级质谱图上首先脱去一分子葡萄糖醛酸(176 Da),形成基峰m/z271.059 5。碎片离子m/z271.059 5 的裂解途径同黄芩素一致,其裂解规律见图1B。

图1 各成分质谱裂解规律Fig.1 Framentation rules of various constituents
3.2 黄芩素、黄芩苷代谢产物在肝匀浆孵育体系中的分析鉴定 以黄芩苷和黄芩素的裂解规律为基础,根据精准分子质量数据结合质谱裂解碎片信息,在黄芩素、黄芩苷肝匀浆孵育样品中分别鉴定出12、15 个代谢物,离子流图见图2,各代谢产物质谱数据见表1,两者在肝匀浆中的代谢途径见图3。
M1准分子离子峰为[M+H]+m/z287.055 6,保留时间6.329 min,分子式C15H10O6。从分子式上看M1与黄芩素相差一个氧原子。二级质谱上准分子离子峰脱去一分子H2O,生成碎片离子m/z269.040 0,碎片离子m/z269.040 0 继续脱去CO、CO 生成碎片离子m/z241.045 8、213.049 7。另外M1可发生RDA 裂解生成带有A 环的碎片离子m/z169.014 2 和带有B 环的碎片离子m/z119.050 4。因此,确定羟基化发生在B 环上,M1为黄芩素的羟基化产物。
M2、M8准分子离子峰分别为[M +H]+m/z433.112 6、433.114 1,保留时间分别为6.924、8.543 min,分子式C21H20O10。二级图谱上,M2准分子离子峰脱去一分子葡萄糖(162 Da) 形成基峰m/z271.058 1。基峰依次脱去H2O、CO、CO形成碎片离子m/z253.046 8、225.052 5、197.059 4,也可发生RDA 裂解碎片离子m/z169.011 4、103.050 2。因此,确定M2、M8分别为黄芩素的糖基化反应产物。
M0-2、M9准分子离子峰分别为[M+H]+m/z447.092 6、447.093 0,分子式C21H18O11,保留时间分别为6.920、8.636 min,与对照品比对,鉴定M0-2为黄芩苷。M9二级质谱图给出基峰m/z271.060 7,为准分子离子峰脱去葡萄糖醛酸(176 Da) 形成,基峰接连脱去H2O、CO、CO 生成碎片离子m/z253.049 5、225.054 2、197.059 4。因此,确定M9为黄芩素的葡萄糖醛酸化产物。
M3准分子离子峰为[M+H]+m/z255.066 9,分子式C15H10O4,保留时间7.324 min。准分子离子峰接连脱去CO、CO 生成碎片离子m/z227.075 3、119.074 2,发生RDA 裂解生成碎片离子m/z153.073 6、103.054 3,表明M3的分子式及其碎片离子均比黄芩苷少了一个氧原子。因此,确定M3为黄芩素脱羟基化产物。
M4一级质谱图中给出的准分子离子峰[M+H]+m/z447.130 7,分子式C22H22O10,保留时间7.935 min。二级质谱图给出的基峰m/z285.067 9,与准分子离子峰相差一分子葡萄糖(162 Da),碎片离子m/z285.067 9 继续脱去甲基基团形成m/z270.043 1。因此,确定M4为黄芩素的甲基化糖基化反应产物。
M5、M10一级质谱图中给出的准分子离子峰分别为[M+H]+m/z403.103 8、403.104 0,保留时间分别为8.131、9.040 min,分子式C20H18O9。M5、M10的准分子离子峰脱掉分子量为132 Da 的基团后形成的碎片离子m/z271.058 4、271.059 0,即黄芩素的准分子离子峰。因此,确定M5、M10为黄芩素的糖基化(阿拉伯糖或木糖) 反应产物。
M6准分子离子峰为[M+H]+m/z461.108 1,保留时间8.139 min,分子式C22H20O11。二级图谱给出的碎片m/z285.075 1,为准分子离子峰脱去葡萄糖醛酸 (176 Da) 形成,碎片离子m/z285.075 1 继续脱去甲基基团形成碎片离子m/z270.053 1。因此,确定M6为黄芩苷的甲基化葡萄糖醛酸化。

图2 各成分提取离子流图Fig.2 Extracted ion current chromatograms of various constituents
M7准分子离子峰[M+H]+m/z431.097 7,分子式C21H18O10,保留时间8.204 min。二级图谱上基峰m/z255.064 9 为准分子离子峰脱去葡萄糖醛酸(176 Da) 形成。基峰发生RDA 裂解可生成碎片离子m/z153.016 9、103.051 9,推测M7在A环上发生了还原反应,丢失了羟基。因此,确定M7为黄芩苷的脱羟基反应产物。
M11、M16准分子离子峰分别为[M+H]+m/z301.072 2、301.070 3,分子式C15H8O4,保留时间分别为11.766、13.592 min。M11准分子离子峰脱去甲基基团形成基峰m/z286.048 1,基峰脱去CO生成m/z258.053 2。基峰发生RDA 裂解生成碎片m/z169.009 4、119.085 4。因此,确定M11为黄芩素羟基化甲基化代谢产物,M16为其同分异构体。
M12准分子离子峰为[M+H]+m/z253.048 8,分子式C15H8O40,保留时间12.523 min。从分子式上看,M12与黄芩素相差一个H2O 分子。M12二级质谱给出的碎片离子m/z225.058 1、197.062 9为准分子离子峰接连脱去CO 生成。M12也可发生RDA 裂解,生成碎片离子m/z169.014 2、103.055 4。因此,确定M12为5-羟基,6,7-环氧-2 苯基色原酮或7-羟基,5,6-环氧-2 苯基色原酮。
M0-1、M13准分子离子峰分别为[M+H]+m/z271.059 9、271.059 6,分子式C15H10O5,保留时间分别为12.574、13.491 min。与对照品比对,M0-1为黄芩素。M13准分子离子峰相继丢失H2O、CO、CO,分别生成碎片m/z253.044 3、225.058 6、197.062 9,发生RDA 裂解生成碎片离子m/z169.062 9、103.055 6。鉴于M13的裂解途径与黄芩素保持一致,但具有不同的保留时间,因此确定M13为黄芩素同分异构体。
M15准分子离子峰为[M+H]+m/z285.076 7,分子式C16H12O5,保留时间14.240 min。分子式与黄芩素相比相差一个甲基基团。M15准分子离子峰丢失一个甲基基团后形成基峰离子m/z271.049 6,基峰的裂解途径与黄芩素一致,即形成碎片离子m/z242.058 0、224.046 7、196.053 1、168.005 1 的碎片离子。因此,确定M15为黄芩素的甲基结合物。
3.3 黄芩素、黄芩苷代谢产物在肠道菌孵育体系中的分析鉴定 以黄芩苷、黄芩素的裂解规律为基础,根据精准分子质量数据结合质谱裂解碎片信息,在黄芩素、黄芩苷肠道菌孵育样品中分别鉴定出3、4个代谢物,离子流图见图4,各代谢产物质谱信息见表2,两者在肠道菌中的代谢途径见图5。
M16准分子离子峰为[M+H]+m/z287.053 7,保留时间7.739 min,分子式C15H10O6。M16与黄芩素在分子式上相差一个氧原子,推测为发生羟基化反应。M16准分子离子峰发生RDA 裂解生成带有A环的基峰m/z185.006 3 和带有B 环的碎片离子m/z103.054 3,基峰继续脱去H2O、CO 形成m/z166.996 8、139.001 4。因此,确定M16羟基化发生在A 环上,为黄芩素的羟基化产物5,6,7,8-四羟基黄酮。

表1 黄芩素、黄芩苷肝匀浆代谢产物质谱信息Tab.1 MS information of baicalein and baicalin metabolites in rat liver homogenate
M17准分子离子峰为[M+H]+m/z301.069 6,保留时间11.97 7 min,分子式C16H12O6。M17准分子离子峰脱去甲基基团生成碎片离子m/z286.045 5,也可发生RDA 裂解生成带有A 环的基峰m/z183.998 9和带有B 环的碎片离子m/z119.085 4。因此,确定M17的甲基化发生在A 环上,羟基化发生在B 环上,为黄芩素的甲基化、羟基化结合物。
M18准分子离子峰为[M+H]+m/z255.064 9,分子式C15H10O4,保留时间14.504 min。准分子离子峰接连发生RDA 裂解,生成带有A 环的基峰m/z153.017 4 和碎片离子m/z103.054 0,基峰可脱去一分子水形成碎片离子m/z135.044 8。因此,确定M18为黄芩素脱羟基化产物。
4 讨论
本实验建立HPLC-Q-TOF/MS 法研究黄芩苷、黄芩素在体外肝匀浆和肠道菌中的代谢情况,发现18 个代谢产物,包括在体外报道过的3 个[13]、体内报道过的11 个[11-12],其中M4、M5、M10、M16为首次发现。

图3 各成分肝匀浆中代谢途径Fig.3 Metabolic pathways of various constituents in liver homogenates

图4 各成分经肠道菌代谢产物提取离子流图Fig.4 Extracted ion chromatogram of various constituents in intestinal bacteria
在黄芩素、黄芩苷肝匀浆孵育液中分别检测到12、15 个代谢物。黄芩素主要经历的Ⅰ相反应有脱水反应、羟基化、脱羟基化反应,Ⅱ相反应有糖基化、葡萄糖醛酸化、甲基化等反应;黄芩苷主要经历的Ⅰ相反应有羟基化和脱羟基反应,Ⅱ相反应类型有糖基化、甲基化、葡萄糖醛酸化等。肝脏所含丰富的Ⅰ相、Ⅱ相代谢酶是黄芩苷、黄芩素发生广泛代谢途径的主要原因[16],其中共有的有12 个(M0-1、M0-2、M1、M2、M3、M4、M5、M8、M11、M13、M14、M15),而M6、M7、M9、M10只存在于黄芩苷肝匀浆孵育液中,M12只存在黄芩素肝匀浆孵育液中。黄芩苷、黄芩素在各自肝匀浆孵育体系中均能检测到,表明两者在肝脏中可相互转化,也可能是有上述共同代谢物的原因之一。
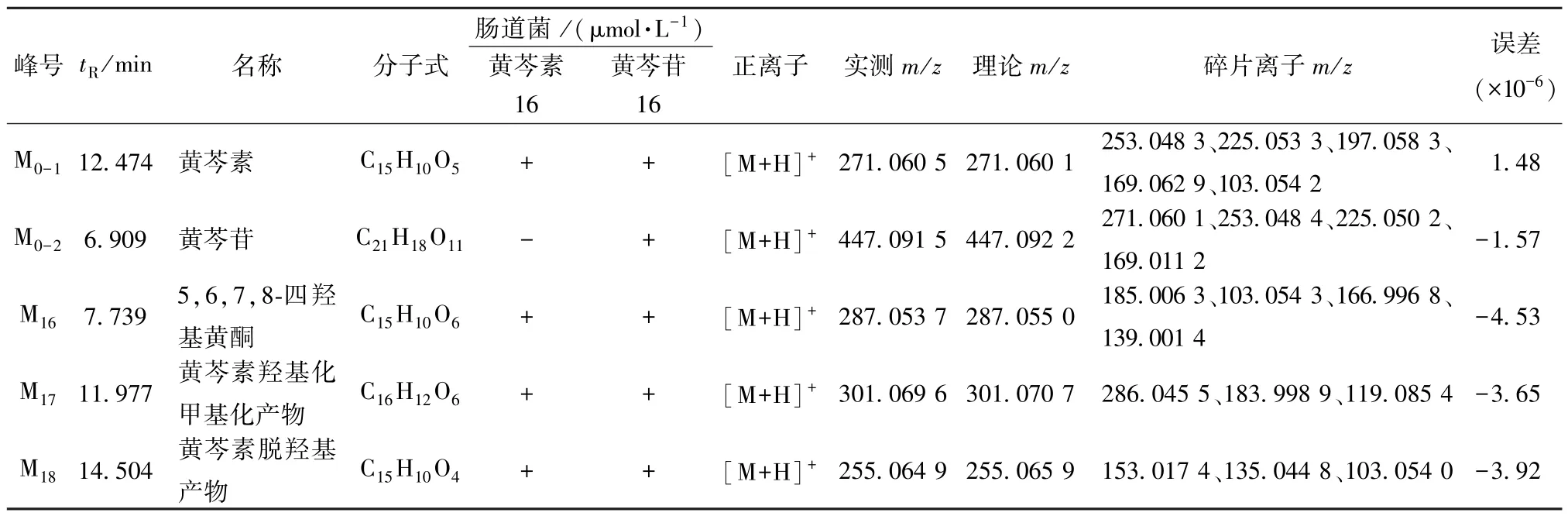
表2 黄芩素、黄芩苷肠道菌代谢产物质谱信息Tab.2 MS information of baicalein and baicalin metabolites in intestinal bacteria
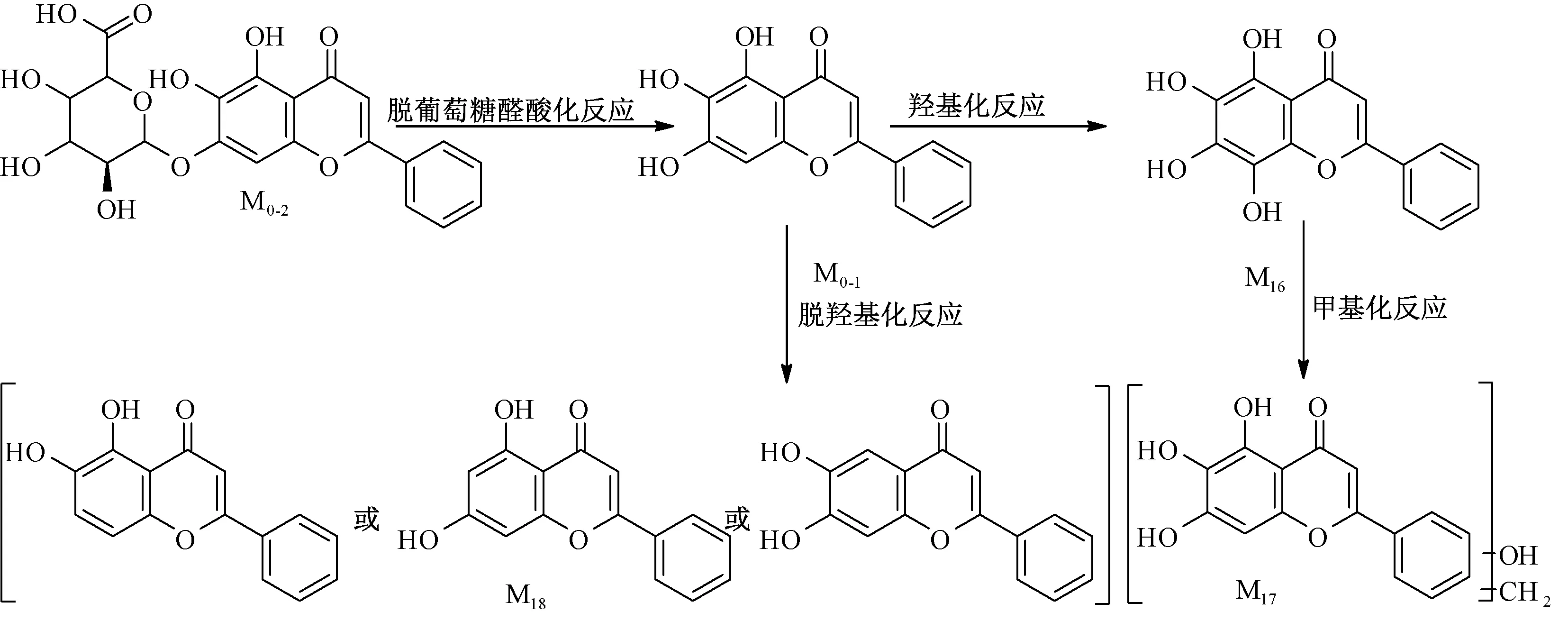
图5 各成分经大鼠肠道菌代谢途径Fig.5 Metabolic pathways of various constituents in intestinal bacteria
在黄芩苷的肠道菌孵育液中检测到其脱糖代谢物黄芩素,在肠道菌的作用下可继续发生甲基化、羟基化、脱羟基化代谢反应。但在黄芩素的大鼠肠道菌孵育液中并没有检测到黄芩苷,表明在大鼠肠道菌作用下它仅能单向生成黄芩素,而后者却不能代谢生成前者。
综上所述,本研究通过HPLC-Q-TOF 法鉴定黄芩苷、黄芩素在肝匀浆、肠道菌孵育液中的代谢物,明确了两者代谢物的生成位点,可为阐释其体内代谢行为提供依据。
