HIF-1α通过调控miR-544对A549肺癌细胞免疫逃逸及NCR1/NKP46通路的影响
2020-08-03彭文范长玲张浩
彭文 范长玲 张浩
资料与方法
一、实验细胞
肺癌A549细胞购自中国科学院上海细胞库,冻存在本实验室,复苏后采用含有10%胎牛血清(FBS)及含100U/mL青霉素、链霉素的DMEM培养基置于37℃ 5%CO2培养箱中培养。
自然杀伤细胞NK-92MI购自中国科学院上海细胞库,复苏后采用含有10%FBS及200U/mL重组人白细胞介素-2(IL-2)的α-MEM培养基,在37℃ 5%CO2培养箱中培养。
二、试剂与仪器
10%FBS(货号10270-106)及含双抗的DMEM培养基(R8758)均购于Sigma公司;Lipofectamine 2000试剂盒(1668-027)购于美国Invitrogen公司;RIPA裂解液( P0013B)、干扰素-γ(interferon-γ,IFN-γ)(PI511)、白介素-2(Interleukin-2,IL-2)(PI660)、肿瘤坏死因子-ɑ(Tumor necrosis factor-ɑ,TNF-ɑ)(PA038)检测试剂盒购自碧云天生物技术研究所;CCK8检测试剂盒(40203ES60)购自上海翊圣生物科技有限公司;实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR)检测试剂盒(E237)购自日本Takara公司;HIF-1α(ab1)、自然细胞毒性受体1(Natural cytotoxicity receptor 1,NCR1)(ab214468)、NKP46(ab14823)抗体购自英国Abcam公司;GloMax荧光读数器购自Promega公司;ABI7500PCR仪器购自于Applied Biosystems公司;Tetra垂直电泳仪、Gel Doc XR凝胶成像系统购于美国Bio-RAD公司;CytomicsTM FC 500流式细胞仪购于美国贝克曼库尔特公司。
三、实验方法
1 细胞转染:实验一:取培养至对数期A549细胞更换培养液为不含FBS培养液培养1h,参用Lipofectamine 2000转染试剂盒将转染试剂、阴性对照si-NC、si-HIF-1α 分别转染至A549细胞,分为Control组、si-NC组、si-HIF-1α,每组设定6个重复孔,继续培养6h更换为含有FBS的培养液培养48h。
实验二:取培养至对数期A549细胞,接种不含FBS培养液培养1h,参照Lipofectamine 2000转染试剂盒进行转染,将转染试剂、NC、miR-544 mimics转染至A549细胞,命名Control组、si-NC组、miR-544 mimics组,每组设定6个重复孔,其它步骤与实验一相同。
2 免疫印迹法检测转染后细胞中HIF-1α蛋白表达:收集1.3.1 转染后细胞,添加RIPA裂解裂解细胞30 min提取总蛋白,经SDS-PAGE电泳分离后将蛋白转移至PVDF膜上进行转膜反应,BSA封闭后,用HIF-1α一抗孵育膜,4℃过夜后用HRP标记IgG二抗室温下孵育膜2h,清洗后,经化学发光显影后,于凝胶成像仪内采集图像,并采用Image pro-plus软件定量分析HIF-1α蛋白相对表达量。
3 细胞中IFN-γ、IL-2、TNF-ɑ水平检测: 收集1.3.1中A549细胞,密度调整为1×104个与NK-92MI细胞(1 ∶5)混匀后共接种96孔板,孵育72h后,收集上清,采用酶联免疫吸附法检测细胞上清中IFN-γ、IL-2、TNF-ɑ水平,具体参照试剂盒说明书进行操作。
4 CCK8法检测NK-92MI细胞免疫杀伤率:以1.3.1中转染/未转染的A549细胞作为靶细胞,将NK-92MI细胞作为效应细胞,调节靶细胞密度为1×104个接种96孔板,以靶效比1:5将NK-92MI细胞、A549细胞混匀后于37℃共孵育72h后,每组设定6个重复孔,添加CCK-8试剂孵育4h,收集共培养上清,于490nm处检测各组OD值。免疫杀伤率(%)=(NK-92MI细胞OD+A549细胞OD-共培养OD)/NK-92MI细胞OD×100%。
5 qRT-PCR检测细胞中miR-544表达:应用TRIzol试剂提取细胞中总RNA,将RNA逆转录为cDNA,参照qRT-PCR试剂盒进行扩增反应,配制体系:0.5 μL上下游引物,2 μL cDNA,10 μL 2×SYBR Green Mix,7 μL ddH2O,总共20 μL,qRT-PCR反应条件: 95℃ 预变性30s,95℃ 15s,72℃ 15s,35个循环。以U6或β-actin作为内参,2-ΔΔCt算法定量分析miR-544和NCR1相对表达水平。
6 荧光素酶报告基因测定 分别用miR-544 mimic及阴性对照质粒与转染HIF-1α-wt/HIF-1α-mut荧光素酶报告基因表达载体共转染A549细胞系,48h后收集细胞,采用双荧光素酶报告基因检测系统进行分析,各组荧光酶活性变化情况,采用荧光读数器定量评估各组荧光素酶活性。
7 流式细胞术检测细胞中NKP46表达 以1.3.1中A549细胞密度调整为1×104个与NK-92MI细胞(1 ∶5)混匀后共接种96孔板孵育72 h后,收集上清,添加PMA、细胞因子阻断剂BFA、Ionomycin继续培养5h,收集细胞,洗涤后添加荧光素标记抗体NKP46,4℃避光孵育30 min,清洗细胞后,添加4%多聚甲醛固定10 min,PBS清洗后,添加破膜缓冲液重悬细胞,采用流式细胞仪分析细胞中NKP46表变化情况。
四、统计学处理

结 果
一、转染si-HIF-1α 后A549细胞中HIF-1α表达情况
与Control、si-NC组相比,si-HIF-1α 组A549细胞中HIF-1α表达显著降低(P<0.05)(见图1)。
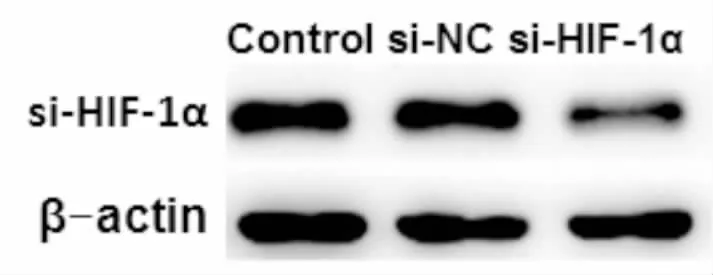
图1 免疫印迹法检测细胞中HIF-1α表达
二、转染si-HIF-1α 后对细胞IFN-γ、IL-2、TNF-ɑ水平的影响
与Control、si-NC组相比,si-HIF-1α 组细胞IFN-γ、IL-2、TNF-ɑ水平显著升高(P<0.05)(见表1、2)。
表1 各组细胞HIF-1α蛋白表达比较
表2 各组细胞中IFN-γ、IL-2、TNF-ɑ水平比较
三、转染si-HIF-1α 后对肺癌细胞免疫杀伤率的影响
与Control、si-NC组相比,si-HIF-1α 组NK-92MI细胞对肺癌细胞免疫杀伤率显著升高(P<0.05)(见表3)。
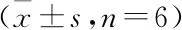
表3 si-HIF-1α转染后各组细胞免疫杀伤率比较
四、转染si-HIF-1α 后对细胞miR-544的影响
与Control、si-NC组相比,si-HIF-1α 组细胞miR-544表达显著升高(P<0.05)(见表4)。
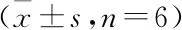
表4 si-HIF-1α转染后各组细胞miR-544表达比较
五、miR-544靶向HIF-1α促进肺癌细胞免疫逃逸
TargetScan鉴定HIF-1α、miR-544结合位点如图2。在HIF-1α 3’UTR-Wt细胞中,与si- NC组(2.26±0.37)相比,miR-544 mimics组荧光素酶活性(1.06±0.09)降低,差异有统计学意义(P<0.05)。在HIF-1α 3’UTR-Mut的细胞中, si-NC组(1.08±0.13)与miR-544 mimis组(1.06±0.11)荧光素酶活性比较无显著性(P>0.05)(见图2)。

图2 miR-544、HIF-1α靶向结合位点预测
六、转染miR-544 mimics后细胞miR-544表达情况
与Control、NC组相比,miR-544 mimics组细胞miR-544表达显著升高(P<0.05)(见表5)。
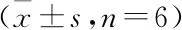
表5 各组细胞中细胞miR-544表达比较
七、转染miR-544 mimics后对细胞IFN-γ、IL-2、TNF-ɑ水平的影响
与Control、NC组相比,miR-544 mimics组细胞IFN-γ、IL-2、TNF-ɑ水平显著降低(P<0.05)(见表6)。
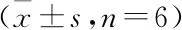
表6 各组细胞中细胞IFN-γ、IL-2、TNF-ɑ水平比较
八、转染miR-544 mimics 后对肺癌细胞免疫杀伤率的影响
与Control、NC组相比,miR-544 mimics组NK-92MI细胞对肺癌细胞免疫杀伤率显著降低(P<0.05)(见表7)。
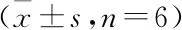
表7 miR-544 mimics 转染后肺癌细胞免疫杀伤率比较
九、转染miR-544 mimics后对细胞NCR1/NKP46表达的影响
与Control、NC组相比,miR-544 mimics组细胞NCR1、NKP46表达显著降低(P<0.05)(见表8)。
表8 各组细胞NCR1表达比较
十、miR-544靶向NCR1 促进肺癌细胞免疫逃逸
TargetScan预测NCR1、miR-544结合位点如4。在NCR1 3’UTR-Wt细胞中,与miR-544 NC组(2.35±0.29)相比,miR-544 mimics组荧光素酶活性(1.05±0.12)降低,差异有统计学意义(P<0.05)。在NCR1 3’UTR-Mut的细胞中,NC组(1.05±0.16)与miR-544 mimis组(1.06±0.08)荧光素酶活性比较无显著性(P>0.05)(见图3、4)。
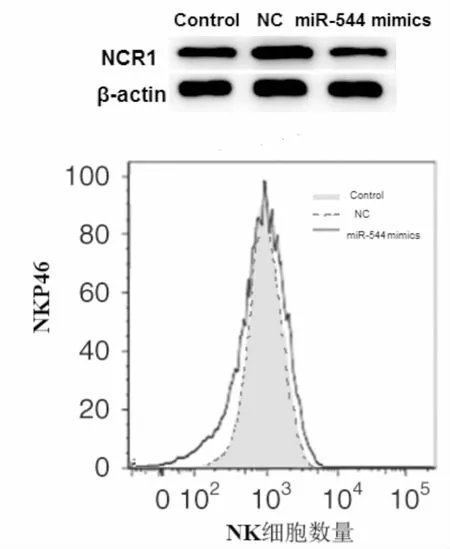
图3 细胞NCR1、NKP46检测结果
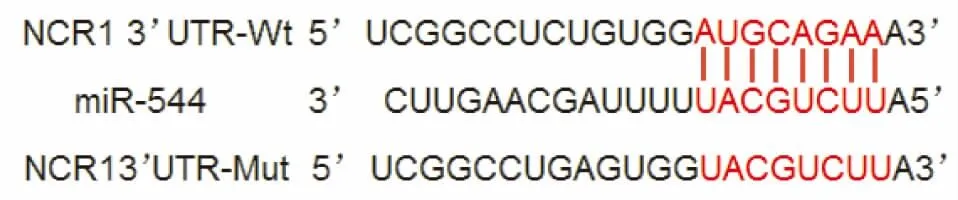
图4 miR-544、NCR1靶向结合位点预测
讨 论
机体免疫系统中存在较多毒性细胞,如NK细胞、T细胞等,均能够通过免疫监视,及时清理癌变细胞,然而一部分肿瘤细胞突变后,自身免疫原性丧失,逃过免疫系统进入平衡期,当两者平衡被肿瘤细胞打破后,则会发生免疫逃逸。NK细胞作为体内重要的淋巴细胞之一,在天然免疫和获得性免疫中发挥重要作用。研究发现NK细胞能够通过自身细胞毒性进而发挥对肿瘤细胞的免疫杀伤作用,如在白血病、非霍奇金氏淋巴瘤、胃癌、肝癌等[6]。临床研究发现非小细胞肺癌患者经治疗后可升高NK细胞、T淋巴细胞亚群、免疫调节因子水平,进而提高患者的免疫功能[7]。基于以上研究推测提高NK细胞对肺癌细胞免疫杀伤作用,可能为降低肺癌细胞免疫逃逸的靶向治疗途径,因此研究肺癌细胞免疫逃逸机制对深入探究肺癌的发生机制具有重要的意义。

NCR1又称NKP46,属于NK细胞的主要激活受体,过往研究发现NK受体NKP46/NCR1发挥在控制肿瘤转移中关键作用[15]。在前列腺癌中研究证实NKP46呈下调表达[16]。Picard等研究发现血液中NKP46+自然杀伤细胞具有潜在的调节特性,对非小细胞肺癌患者预后具有一定的预测价值[17]。受到低氧诱导后,NK细胞中HIF-1a表达水平升高,NKP46表达降低,且NK细胞杀伤肿瘤靶细胞的能力也降低[18]。Pan等在肝癌中研究发现过表达miR-544后可抑制NCR1/NKP46通路,促进免疫逃逸[19]。本研究发现过表达miR-544后细胞中NCR1、NKP46均降低,TargetScan预测发现,在NCR1 mRNA的3’-UTR中存在miR-544的靶位点,荧光素酶报告基因检测证实,miR-544是靶向NCR1 的调节分子之一,提示miR-544可能通过靶向NCR1/NKP46进而促进肺癌细胞免疫逃逸。
综上所述,HIF-1α可能通过调控miR-544靶向抑制NCR1/NKP46通路,进而降低A549细胞对NK细胞介导的细胞毒性敏感性,导致NK-92MI细胞的抗肿瘤免疫活性被抑制,从而抑制NK细胞对A549细胞的免疫清除,参与肿瘤细胞免疫逃逸过程。本研究也存在一定的缺陷,仅探究miR-544与下游NCR1/NKP46通路的关系,miR-544是否还可能通过其他途径参与细胞免疫逃逸,还有待后续深入研究。
