儿童难治性支原体肺炎感染诊治中MP-DNA载量及耐药检测的意义分析
2020-08-03郑玥刘秀芬刘朝阳
郑玥 刘秀芬 刘朝阳
肺炎支原体[1](Myoplasma pneumoniae,MP)是一种介于细菌与病毒之间的微生物,不仅是儿童呼吸道感染常见的病原体之一,也是社区获得性肺炎(community acquired pneumonia,CAP)中常见的病原体,其感染途径主要通过患者的口、鼻分泌物经过空气的传播,引起呼吸道各个部位的感染。据有关文献报道,MP全球感染率达到了9.6%~66.7%[2],并且有逐年递增的趋势,其发病与季节无关,在人口密集的地方,MP的发病率更高,在家庭成员中也能够相互传染。近几年随着对MP感染的研究越来越多,MP是MPP的病原体,有研究学者发现,2007年肺炎支原体肺炎(Myoplasma pneumoniae pneumonia,MPP)的发生率是1999年的10倍,并有上升趋势[3]。而近几年关于难治性肺炎支原体肺炎(refractory Mycoplasma Pneumoniae pneumonia,RMPP)的发病率上升趋势明显。RMPP是经过抗生素治疗后,病情仍然得不到控制。肺炎支原体感染可以造成呼吸道感染,也能引起急性重症肺炎并伴有其他严重的并发症,心肌炎、脑膜炎、溶血性贫血等,严重威胁儿童的生命健康。因此,尽早检测出病原体对患者的治疗和预后康复具有很大的意义。但是根据临床研究,支原体肺炎发病不明显,其发病症状、体征以及胸部X线缺乏特异性,确诊需要经过病原学检查。目前临床上常用的检测方法有MP培养分离、MP-IgM检测、血清学等方法,MP培养分离因为需要特殊的培养基、培养时间较长、实验操作繁琐,检出率不高等缺点,临床上应用较少;而MP-IgM检测因为容易受到病程、免疫状态以及抗体出现和转化的时间等影响,且在MP感染的早期诊断上性能不足,容易出现假阴性的结果;血清学方法主要通过检测出IgM抗体或双份血清IgG抗体滴度的增高作为感染的指标,由于IgG抗体与机体免疫状态有关,婴幼儿大都免疫力低下,一般检测不出抗体,且灵敏度较低[4]。目前临床普遍采用的实时荧光PCR技术主要用于进行感染的早期诊断,检测过程简单,只需要MP-DNA少量片段,通过PCR技术进行扩增就可以进行检测,不受病程的影响,且灵敏度及特异性高。因此,本研究通过检测肺炎支原体MP-DNA以及耐药性检测,为早期诊断治疗,缩短病程,同时为新型抗生素以及疫苗的研发提供依据。
资料与方法
一、一般资料
选择我院2016年12月至2017年12月儿科确诊肺炎支原体肺炎(MPP)的患儿206例,根据临床特征以及治疗的效果,分为普通支原体肺炎组(普通组)100例,难治性支原体肺炎(难治组)106例,普通组,男/女:56/44例,年龄(4.92±1.73)岁:病程(17.52±6.78)d,难治组,男/女:50/56例,年龄(4.84±1.52)岁:病程(16.85±7.13)d。两组一般资料比较无显著差异(P>0.05)(见表1)。所有患者均签署知情同意书。

表1 两组患者的一般资料比较
1 纳入标准 普通组:均确诊为支原体肺炎,且无其他细菌感染;存在呼吸道感染症状,以发热、干咳为主;胸部X片表现为点状或小斑片状浸润影;体征不明显,有呼吸音低,干湿啰音;入院前未接受其他治疗、没有应用抗生素[5-7]。难治组:应用大环内脂类抗生素7 d后,临床以及影像学表现存在无好转或恶化。
2 排除标准 存在肺结核、哮喘等其他肺部疾病的患儿;有严重的肝、肾功能障碍的患儿;用药过敏的患儿;合并其他急慢性感染、自身免疫疾病的患儿。
二、研究方法
1 标本采集方法 在患儿入院当天用生理盐水漱口或清洁口腔,并在同一天进行分泌物的采集,用舌压板轻压舌部,以轻快的动作,迅速擦拭咽及两侧腭弓部的分泌物,将拭子插入试管中,并及时送检,用于MP-DNA载量及耐药突变位点检测[8]。
2 检测方法 MP-DNA载量应用PCR荧光探针法,试剂盒用肺炎支原体核酸检测试剂盒(中山大学达安基因股份有限公司),仪器用ABI Prism 7300型荧光定量PCR仪。MP耐药检测应用荧光PCR法,试剂盒用肺炎支原体核酸及耐药突变位点检测试剂盒(江苏默乐生物科技股份有限公司),仪器用Stratagene MX 3000P实时荧光定量PCR仪,均严格按照试剂盒说明书进行操作[9]。
(1) MP-DNA载量检测:对采集的标本,加灭菌生理盐水1.5ml到无菌玻璃管,充分震荡摇匀,挤干棉拭子,立即12000rpm离心5 min,去上清,沉淀加灭菌生理盐水1ml混匀,12000rpm离心5 min,将处理后的样品放入仪器样品槽,按对应顺序设置阴性质控品、阳性定量参考品以及未知标本,选中所有设置样品孔,设置循环条件:93℃2 min,93℃45s→55℃60s→10个循环,93℃30s→55℃45s→30个循环,结果以Ct值显示,反应结束时电脑自动分析结果,结果判定:Ct值=30,实验结果为阴性;Ct值<30,实验结果为阳性。
(2)MP耐药检测:采用聚合酶链式反应(PCR)结合Taqman荧光探针对人痰液样本中肺炎支原体核酸及其耐药突变位点进行检测。针对P1基因保守设计引物检测肺炎支原体,探针采用VIC荧光标记;针对23SrRNA基因突变位点设计引物探针检测A2063G和A2064G突变,探针采用FAM荧光标记,人工合成一段序列作为试剂盒内标,该序列与已知物种的核苷酸序列无相似性,内标探针采用CY5荧光标记。强阳性质控品和弱阳性质控品,包含P1基因序列和23SrRNA A2063G发生突变的基因序列,质控品W包含23SrRNA 2063和2064位点均未发生突变的基因序列,不含P1基因序列。
三、观察内容
比较两组患儿MP-DNA检测结果;对所有抗生素耐药的患儿进行耐药突变位点结果分析;比较两组患儿临床及实验室特点;比较两组MPP影像学以及并发症;对难治性MPP临床特点采用Logistic进行多因素回归分析。
四、诊断标准
肺炎支原体诊断标准[10]:血清特异性IgM抗体明显升高,或者急性期和恢复期双份血清特异性IgG抗体比较有4倍以上的升高或者下降到原来的1/4。
难治性肺炎支原体诊断标准[10]:肺炎支原体肺炎经大环内脂素抗菌药物进行正规治疗7 d以上,临床征象加重、且持续发热、肺部影像学表现加重,表现为单侧或双侧大叶高密度肺实变,或合并胸腔积液,弥漫性间质性肺浸润。
五、统计学方法

结 果
一、两组患儿MP-DNA检测结果分析
难治组MP-DNA检测出的阳性率显著高于普通组χ2=7.192,P<0.001,阴性率显著低于普通组(χ2=5.162,P<0.001)(见表2)。
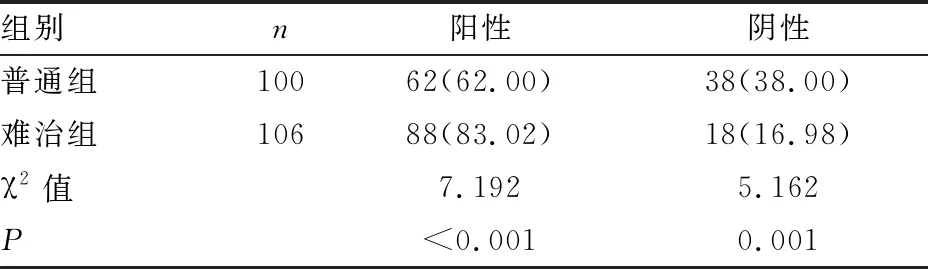
表2 两组患儿MP-DNA检测结果分析[n(%)]
二、两组患儿对不同抗生素药敏情况分析
难治组患儿对不同抗生素耐药性显著高于普通组患儿的耐药性(P<0.05)(见表3)。
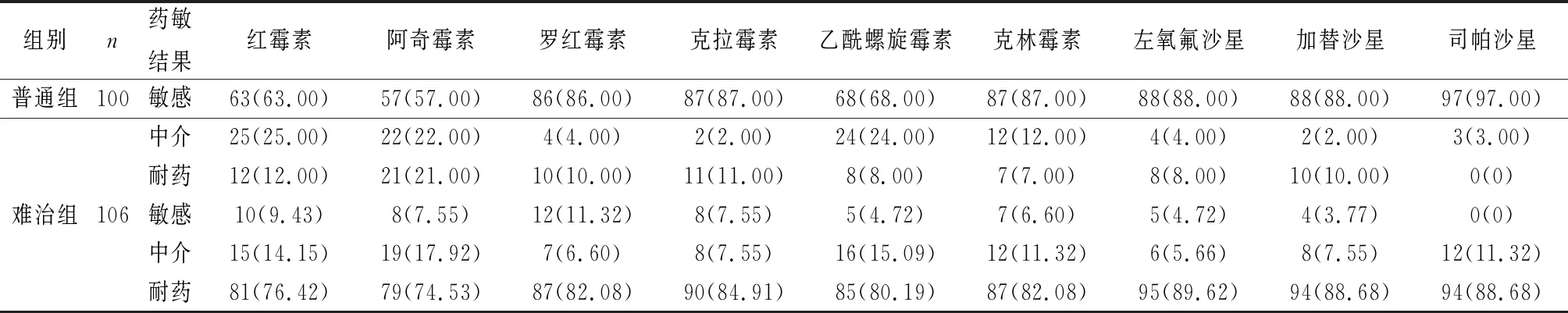
表3 两组患儿对不同抗生素药敏情况分析[n(%)]
三、 所有患儿中抗生素耐药患者的耐药突变位点结果分析
2063位A→G突变对大环内脂类抗生素耐药影响更大,60%以上产生大环内脂类药物耐药的病例均检测出2063位点G突变。其中,红霉素、阿奇霉素、罗红霉素、克拉霉素、克林霉素耐药病例基因型分布的差异有统计学意义(P<0.05);而乙酰螺旋霉素、左氧氟沙星、加替沙星、司帕沙星病例基因型分布的差异没有统计学意义(P>0.05)(见表4)。
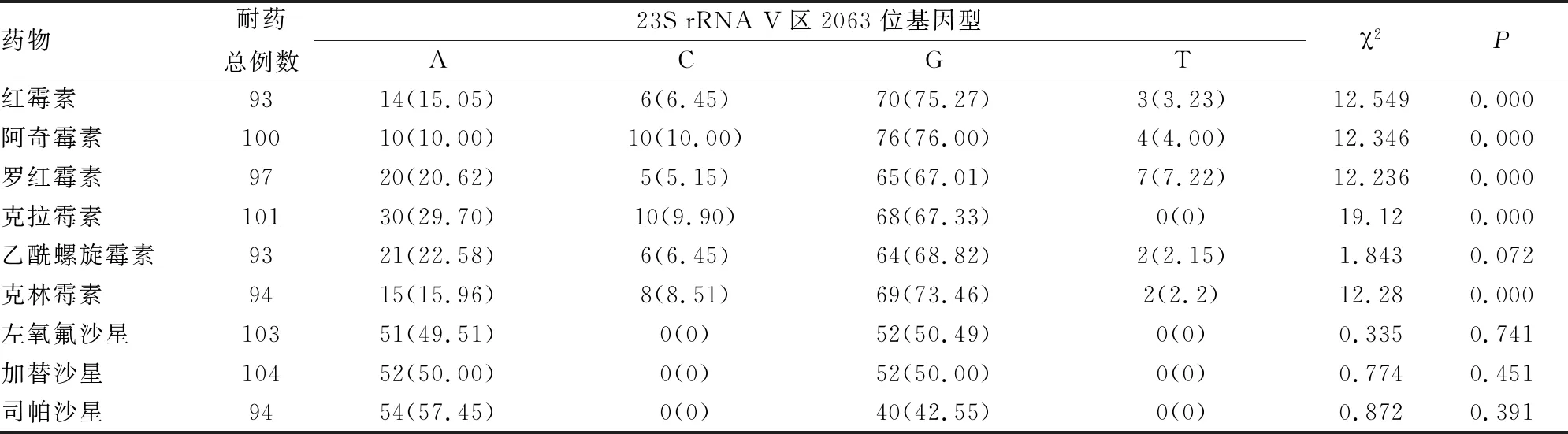
表4 MP23S rRNA V区2063位基因型与抗生素耐药性的关系[n(%)]
四、比较两组患儿临床及实验室特点
难治组患儿高热、肺外并发症、CRP增高、大环内酯类药物应用时间、血沉增高例数及乳酸脱氢酶显著高于普通组(P<0.05)(见表5)。
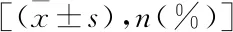
表5 比较两组患儿临床及实验室特点
五、比较两组MPP影像学以及并发症。
两组病变发生在双侧、右上侧的分布有显著差异(P<0.05);两组肺内合并症、肺不张及胸腔积液的发生率比较有显著差异(P<0.05)(见表5)。
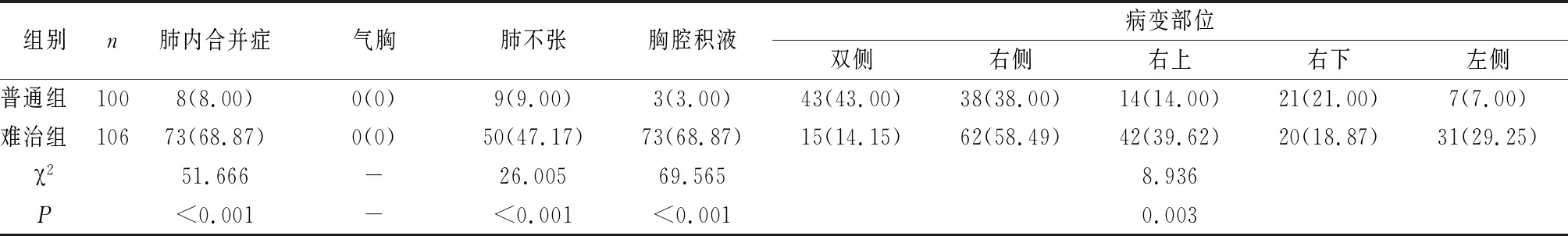
表6 比较两组MPP影像学以及并发症[n(%)]
讨 论
近几年随着医疗水平的提升及各种实验室检测手段的改进,MPP的发病率具有明显的上升趋势,并且儿童RMPP的发病率也是逐年递增。目前国内外对于儿童RMPP没有统一的标准,认为其发病机制主要是抗生素耐药、过度或者异常的炎症反应、合并细菌及病毒感染等[11-12]。临床上大多主要采用大环内酯类药物进行治疗,目前主要认为儿童RMPP由于大环内脂类药物治疗效果不敏感,发热时间长,病程一般大于4周,临床症状加重,病情进展变化快,常在短时间内就会表现为肺部大面积的受累,易合并肺外并发症、肺不张、闭塞性支气管炎等后遗症,更有文献研究表明[13],儿童RMPP的C反应不断增高,可能会引起严重的炎症发应,治疗难度相当大。严重危害儿童的健康,目前已成为临床关注的热点。
目前临床上用于MP感染的诊断主要是血清学,通过双份血清IgG抗体滴度的增高或是急性期检测出IgM抗体进行确诊,但是经过大量的研究显示,在发病初期的前2周可能检测不出抗体,不适于进行早期诊断,且婴幼儿或免疫力低的患儿,其抗原刺激力差,容易产生假阴性的结果,其灵敏度较低,同时特异度低。越来越多的研究发现证明,MP的分离培养其操作繁琐,支原体的培养生长缓慢,不适于临床,可以通过对呼吸道分泌物进行PCR检测,灵敏度高、不受病程的限制,可以用于MP感染的早期诊断[14]。难治性与普通性的MPP进行MP-DNA检测的结果显示,难治组检测出的阳性率显著高于普通组,阴性率显著低于普通组,P<0.05,可见难治性MPP中阳性率更高。此外,有研究报道[13]MP的DNA载量会随着病程进展,平均存在下降的趋势,全部转为阴性,其中低载量在感染中可能提示MP仍存在,因此MP-DNA载量对诊断意义更大。
β-内酰胺类是主要作用于细胞壁[15]的一类天然耐药抗生素,由于MP没有细胞壁结构,且儿童正处于生长发育阶段,所以临床上在对儿童MP感染中使用四环素以及喹诺酮类药物很少。因此,大环内酯类药物经常作为MP治疗的首选药物。本次研究中,难治性与普通性的药敏结局情况结果显示,难治组患儿耐药性显著高于普通组患儿的耐药性。此外,有临床数据显示[16],我国儿童分离出的MP临床菌株对大环内脂类抗生素具有较高的耐药性,且难治性MPP中的耐药性例数普通高于普通性MPP的耐药性例数,这与本研究结果相符合。大环内酯类抗生素结合于核糖体50S亚基的转肽酶中心与肽输出通道狭窄之间的部分,通过机械性阻塞通道而抑制肽的延伸,从而阻碍蛋白质的合成。基因点突变导致的靶点改变是肺炎支原体对大环内酯类耐药的最重要原因。耐药主要机制为药物作用靶位23SrRNA基因突变导致结合位点突变,大多数为A2063G的点突变和A2064G点突变。既往文献报道[2]的基因突变集中在23S rRNA V区2063或2064位点基因颠换或转换,主要表现为A2063G、A2063C和A2064G发生点突变,以A2063G最为常见。A2063G 要引起14、15元环的高度耐药, 2064 点突变引起16元环的高度耐药。研究中我们在患儿对不同抗生素产生耐药性的基础上,进一步对此类所有产生耐药的患儿进行抗生素耐药突变位点结果分析,发现2063位A→G突变对大环内脂类抗生素耐药影响更大,60%以上产生大环内脂类药物耐药的病例均检测出2063位点G突变。2064位点基因型产生喹诺酮类药物耐药的例数占较少部分。而MP对大环内酯类抗生素的耐药机制主要为核糖体50S亚单位23S rRNA结构域V区和Ⅱ区核苷酸序列改变,最终导致抗生素与核糖体的亲和力下降,从而患儿产生耐药,也有研究表明[17],药物的主动排外系统也可能导致MP产生耐药,还有研究发现,核糖体蛋白L4、L22基因位点突变也会影响大环内脂类抗生素耐药性的产生。
MP感染患儿的白细胞大多正常或者少数轻微增高,而CRP常有不同程度的增高[18],利于与一般细菌性肺炎相鉴别。比较两组患儿临床及实验室特点,结果显示,难治组患儿高热、肺外并发症、CRP增高、大环内酯类药物应用时间、血沉增高例数及乳酸脱氢酶显著高于普通组,其中难治组患儿高热的例数显著增多,可以推测发热为难治性MPP的一个危险因素,难治性CRP增高更显著,提示难治性MPP引起严重的炎症反应;且难治性与普通性MPP肺外并发症均增高,可能的原因是与近年来临床医师对肺外并发症的逐渐认识以及早期进行相关检查有关,提示其可能成为难治性MPP的一个危险因素,而大环内酯类药物应用时间长、血沉增高及乳酸脱氢酶升高均可以作为难治性MPP的预测指标[19]。而在两组MPP影像学以及并发症方面的结果显示,两组病变发生在双侧、右上侧的分布有显著差异;两组肺内合并症、肺不张及胸腔积液的发生率比较有显著差异;主要因为MP感染时,病原体直接损害免疫应答致使肺部发生病变,进而导致影像学的变化多样。本研究结果显示,普通性MPP组主要以双侧病变为主,单侧主要是以右侧为主,下肺多于上肺,且主要以右下肺为主,与翟佳羽[20]等的研究结果一致;而难治组主要以单侧病变为主,右侧多于左侧,上肺多于下肺,且肺内病变严重,很容易合并肺内合并症或肺不张或胸腔积液。因此,合并肺内合并症或肺不张或胸腔积液可能是难治性MPP的高危因素。
综上,应用MP-DNA检测以及耐药基因的检测对于难治性MPP早期诊断具有很大的意义,且有利于病情的转归及临床用药的使用(如药物的使用方案、使用时间及剂量等)。
