贝伐珠单抗联合化疗对Ⅲb/Ⅳ期非鳞非小细胞肺癌患者疾病控制率及血清T细胞亚群水平的影响
2020-08-03王道峰伏俊房三友
王道峰 伏俊 房三友
非鳞非小细胞肺癌(Non-squamous non-small cell lung cancer,NSNSCLC)约占肺癌45%,是一类具有癌细胞生长分裂缓慢生物学特性的肺部恶性肿瘤,超过75%患者确诊时处于Ⅲb/Ⅳ期,肿瘤细胞已发生转移,成为临床治疗难点[1]。常规化疗方案疾病控制率偏低,即使优化化疗组合药物,其有效率亦仅为20%~45%,中位生存期约为4~10个月,整体疗效欠佳,且进入瓶颈期[2-3]。因此探索新治疗手段成为临床研究热点。目前已明确血管形成是NSNSCLC生长与转移形态学基础。贝伐珠单抗是全球首个获准上市抗血管生成单克隆抗体,被广泛用于恶性肿瘤领域。目前贝伐珠单抗联合多西紫杉醇、顺铂尚缺乏可靠循证支持。本研究选取72例Ⅲb/Ⅳ期NSNSCLC患者,从疾病控制率、血清T细胞亚群、血管内皮生长因子(VEGF)信号通路等方面分析贝伐珠单抗联合多西紫杉醇、顺铂的应用价值及可能的作用机制,报道如下。
资料与方法
一、一般资料
选取2015年1月~2017年2月我院收治的72例Ⅲb/Ⅳ期NSNSCLC患者,其中男性47例,女性25例,均根据症状、体征、影像学、病理学检查确诊,自愿签署知情同意书,预估生存期>3个月可完成相关治疗,卡氏评分(KPS)>70分;表皮生长因子受体(epidermal growth factor receptor,EGFR)突变阴性72例;所有病例均为一线化疗患者;入组时停用相关药物时间>4周,排除私自中断治疗、脱落失访者、合并急性感染类疾病者、存在相关药物过敏史者、肾、肺、心等功能严重不全者,随机数字表法分为两组,各36例,两组性别、KPS评分、年龄、体质量、疾病分期、病理学分级、病理分型、合并疾病等资料均衡可比(P>0.05)(见表1)。本研究经我院伦理委员会审核批准。
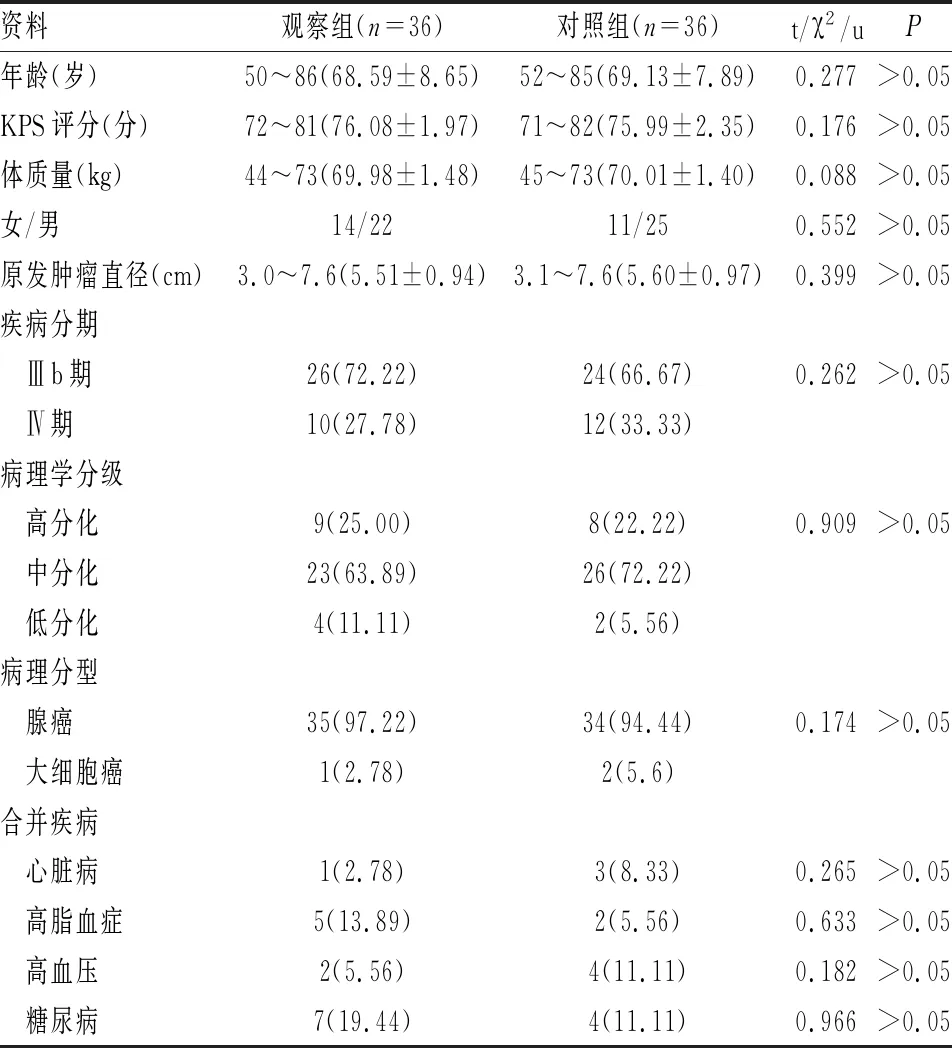
表1 两组临床资料对比
二、 方法
1 观察组:给予贝伐珠单抗(Roche Pharma(Switzerland)Ltd,批准文号S20120069)联合多西紫杉醇(江苏恒瑞医药股份有限公司,国药准字H20020543)、顺铂(江苏豪森药业集团有限公司,国药准字H20040813)治疗。(1)多西紫杉醇:75 mg/m2与5%葡萄糖500 mL混合后静滴1 h左右,1次/d,d 1、d 8,3周为1个周期;(2)顺铂:75 mg/m2与0.9%氯化钠注射液250 mL混合后静滴1 h左右,1次/d,d 1~3,3周为1个周期。(3)贝伐珠单抗:15 mg/kg与0.9%氯化钠注射液100 mL混合后静滴,1次/d,d 1,给药时机为化疗后,3周为1个周期。
2 对照组:给予多西紫杉醇联合顺铂化疗,两种药物给药剂量与方法同观察组。两组疗效观察周期均为3个周期。
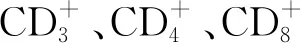
三、疗效评价
治疗3个周期后根据实体瘤疗效评价标准划分疗效为完全缓解(CR,病灶完全消失且时间≥1月)、部分缓解(PR,病灶缩小>30%且时间≥1月)、稳定(SD,病灶缩小≤30%或增大<20%)、进展(PD,病灶增大≥20%)[4]。客观有效率(ORR)=(PR+CR)/总例数×100%。疾病控制率(DCR)=(PR+CR+SD)/总例数×100%。
四、观察指标
五、统计学方法
结 果
一、临床疗效
观察组ORR、DCR(58.33%、86.11%)高于对照组(27.78%、61.11%)(P<0.05)(见表2)。

表2 比较两组RR、PCR[ n(%)]
二、肿瘤标志物水平
观察组治疗3个周期后CK-19、TSGF、CA50、CEA低于治疗前,且低于对照组(P<0.05)(见表3)。

表3 比较两组肿瘤标志物水平
三、免疫功能指标

表4 两组免疫功能指标比较
四、VEGF信号通路 观察组治疗3个周期后PKC、MAPK、NF-kB mRNA低于治疗前,且低于对照组(P<0.05)(见表5)。

表5 比较两组
五、mOS、mPFS
两组均随访13~24个月,观察组mPFS为12.9个月,mOS为16.1个月;对照组mPFS为9.7个月,mOS为13.3个月,观察组mPFS、mOS长于对照组(χ2=6.39P<0.05)(见图1)。

图1 总生存期函数
六、毒副反应
两组毒副反应以Ⅰ、Ⅱ级为主,均可耐受至疗程完成。两组胃肠道反应、粒细胞降低、血小板减少、贫血、白细胞下降毒副反应发生率比较无显著差异(P>0.05)(见表6)。
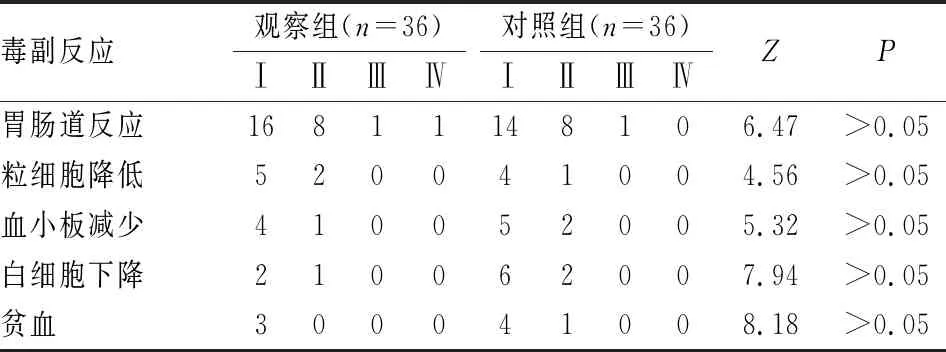
表6 两组毒副反应比较[n(%)]
讨 论
化疗是治疗肺癌重要手段,>90%患者需接受化疗治疗,约1%早期小细胞肺癌患者能通过化疗获得治愈,但化疗常不能治愈NSNSCLC,尤其是Ⅲb/Ⅳ期NSNSCLC,仅能改善生存期内生存质量及不同程度延长生存期[5]。郭卫东等[6]研究指出,单一化疗疾病缓解率仅为46.67%。一直以来人们对NSNSCLC发病机制进行了大量研究,发现肿瘤细胞增殖与转移依赖于形成的新生血管为其提供养分,这为疾病治疗提供了新靶点[7]。贝伐珠单抗是基于该理论研发一种分子靶向药物,主要作用于VEGF,通过抑制VEGF结合特定受体阻碍肿瘤组织血管形成,切断癌细胞给养,促使其发生缺血缺氧而凋亡[8-10]。动物学试验表明,贝伐珠单抗可缩小肿瘤组织体积[11]。但国外相关学者报道显示,单一应用贝伐珠单抗进行分子靶向治疗能不同程度延长Ⅲb/Ⅳ期NSNSCLC患者无疾病进展生存期,但不能延长中位生存期,因此需联合化疗治疗[12-13]。Zhou C等[14]研究观察了贝伐珠单抗联合化疗对276例中Ⅲ期NSCLC患者效果,发现中位生存期、总生存时间、无进展生存期均明显延长。本研究结果显示观察组ORR、DCR(58.33%、86.11%)高于对照组(27.78%、61.11%),mPFS、mOS长于对照组(P<0.05),与以上研究相符,佐证了贝伐珠单抗联合化疗应用于Ⅲb/Ⅳ期NSNSCLC患者可提高疾病客观缓解率与控制率,延长患者mPFS、mOS,疗效显著。同时与以上学者研究不同的是,本研究还观察了两者联合对肿瘤标志物影响,结果显示观察组治疗3个周期后CK-19、TSGF、CA50、CEA低于对照组(P<0.05),说明贝伐珠单抗联合化疗能降低患者血清肿瘤标志物水平,从侧面证实了两者联合应用疗效显著。

既往研究指出,VEGF形成依赖于PKC、MAPK、NF-kB通路,三者可通过一系列级联反应增加VEGF合成与分泌,促进肿瘤新生血管形成[19-20]。且国外学者报道指出,PKC、NF-kB通路可通过抑制细胞外调节蛋白激酶1(ERK1)、ERK2表达,调控肿瘤细胞迁移与侵袭[21-22]。本研究在以上研究基础上创新性发现,观察组治疗3个周期后PKC、MAPK、NF-kB mRNA低于对照组(P<0.05),提示贝伐珠单抗联合化疗可通过PKC、MAPK、NF-kB通路机制发挥良好效果。值得注意的是,NSNSCLC是一个存在多环节、多步骤基因异常的异质性疾病,信号传导通道抑制剂应用前景广阔,但生理学效应较为复杂,其更多的、深层次机制仍有待后续大量本进一步探讨。另两组胃肠道反应、粒细胞降低、血小板减少、贫血、白细胞下降毒副反应发生率比较无显著差异(P>0.05),说明贝伐珠单抗联合化疗不会增加毒副反应,安全性较高。
综上所述,贝伐珠单抗联合化疗应用于Ⅲb/Ⅳ期NSNSCLC,可有效控制患者病情,延长患者mPFS、mOS,疗效显著,且能减小化疗对机体免疫功能影响,安全性较高,其机制可能与抑制PKC、MAPK、NF-kB通路有关。
