幽门螺杆菌感染与慢性阻塞性肺疾病的关系及其对肺功能的影响
2020-08-03刘敏李承红刘双王小江石奕
刘敏 李承红 刘双 王小江 石奕
慢性阻塞性肺疾病(简称慢阻肺)是以气流受限为特征的慢性气道炎症性疾病,具有病程长、反复发作、进行性恶化的特点。幽门螺杆菌(helicobacter pylori, Hp)是消化道常见的致病菌,Hp 不仅是胃炎、消化性溃疡、胃癌和胃黏膜相关淋巴组织淋巴瘤等消化系统疾病的致病因素,还与血液系统、呼吸系统、神经系统、心血管疾病以及自身免疫性疾病等多种胃肠外疾病密切相关[1]。目前Hp 感染与慢阻肺的相关性及其对肺功能的影响尚存在争议。本研究旨在观察慢阻肺患者Hp的感染情况,了解Hp感染对慢阻肺患者肺功能的影响,以期为慢阻肺的治疗提供新的理论依据。
资料与方法
一、研究对象
2018年1月~2019 年1月在本院门诊就诊的慢阻肺 稳定期患者200例为研究对象,男124例,女76例,平均(64.37±6.47)岁。纳入标准:(1)符合 2013 年中华医学会定的《慢性阻塞性肺疾病诊治指南(2013年修订版)》诊断标准[2];(2)患者能配合完成肺功能检查。 排除标准:(1)合并支气管哮喘;(2)合并其他肺部疾病如支气管扩张症、肺纤维化、肺结核、肺恶性肿瘤、胸腔积液等;(3)合并心力衰竭。以同期在本院行健康体检的健康志愿者120例作为对照组:男72例,女48例,平均年龄(61.62±5.06)岁。各组间性别、年龄、体重指数、吸烟率等一般临床资料差异均无统计学意义(P>0.05)(见表1)。所有研究对象4周内均未服用过抗生素、铋剂及质子泵抑制剂等药物。本临床研究的各项程序已通过医院伦理委员会审查批准(见表1)。

表1 慢阻肺患者和健康对照组的一般临床资料比较
二、研究方法
1 肺功能检查 纳入的慢阻肺患者均采用最新组合式、模块化的Master Screen Diffusion肺功能仪(德国耶格公司)检测肺功能,测试前输入被调查者的身高、体重、年龄等生理参数,先做基础流速容量环检查,吸入沙丁胺醇 400 μg,15 min 后检测肺功能,由仪器自动生成各项检查数据,记录第1秒用力呼气量(FEV1)、FEV1占预计值比值(FEV1/pre)、第一秒用力呼气量占用力肺活量的比值(FEV1/FVC),肺功能评估采用GOLD分级[2]。 FEV1/ FVC<70%确定有气流阻塞,以 FEV1%pred对慢阻肺患者进行分级,FEV1% pred ≥80%为GOLD 1级(轻度) ; 50%≤FEV1%pred<80%为Ⅱ级 (中度); 30%≤FEV1%pred<50%为Ⅲ级(重度) ; FEV1%pred<30%预计值为Ⅳ级(极重度) 。
2 血清抗 Hp-IgG、抗CagA-IgG水平测定
所有研究对象于空腹用 EDTA-K2 抗凝管抽取肘静脉血2mL,离心(3000 r /min,15 min) ,分离血清保存于-80℃冰箱。采用酶联免疫吸附法(ELISA)检测血清抗 Hp-IgG及抗CagA-IgG水平,抗 Hp-IgG≥18U/mL即判断为阳性,抗CagA-IgG≥7.5U/mL即判断为阳性。抗 Hp-IgG及抗CagA-IgG试剂盒购自德国DRG公司,测定步骤按照说明书进行。
三、统计学分析

结 果
一、 慢阻肺组与对照组Hp感染的比较
与健康对照组相比,慢阻肺患者抗Hp-IgG及Hp-CagAIgG阳性率及表达水平明显升高(P均<0.05)(见表2)。

表2 慢阻肺组与对照组Hp感染情况的比较
二、 Hp感染对慢阻肺患者肺功能的影响
与未感染Hp的慢阻肺患者相比,感染Hp的慢阻肺患者FEV1、FEV1/pre 、FEV1/FVC明显降低,差异有统计学意义,(P均<0.05)(见表3)。

表3 Hp感染对慢阻肺患者肺功能的影响
三、不同严重程度慢阻肺患者Hp感染的比较
Ⅱ、Ⅲ、Ⅳ级不同严重程度慢阻肺患者抗Hp-IgG、抗Hp-CagAIgG阳性率不同,差异有统计学意义(χ2=12.164,P=0.003 ;χ2=19.371 ,P<0.001),Ⅱ、Ⅲ、Ⅳ级不同严重程度慢阻肺患者抗Hp-IgG、抗Hp-CagAIgG表达水平不同,差异有统计学意义(F=6.032,P=0.007;F=5.974 ,P=0.006),进一步两两比较发现,慢阻肺Ⅲ级和Ⅳ级患者抗Hp-IgG、抗Hp-CagAIgG阳性率及表达水平明显高于慢阻肺Ⅱ级患者(P均<0.01),与Ⅲ级慢阻肺患者相比,Ⅳ级慢阻肺患者抗Hp-IgG、抗Hp-CagAIgG阳性率及表达水平明显升高(P均<0.01)(见表4)。
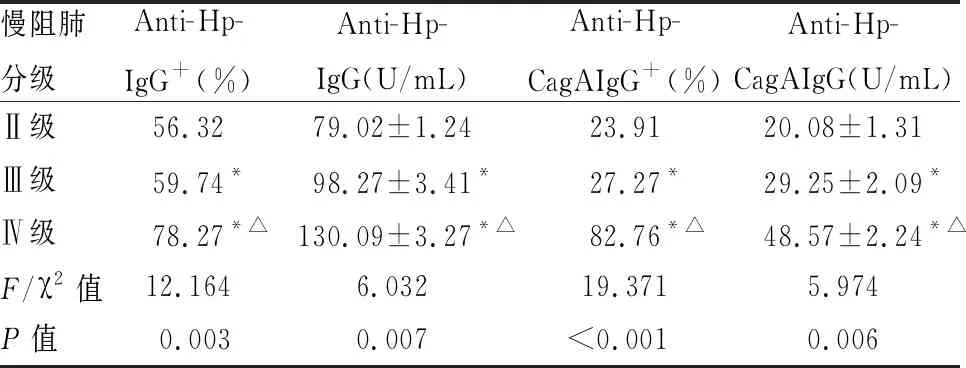
表4 不同严重程度慢阻肺患者Hp感染的比较
四、 慢阻肺患者血清抗Hp-IgG、抗Hp-CagAIgG水平与与患者FEV1/FVC和FEV1的相关性分析
慢阻肺患者血清抗Hp-IgG水平与患者 FEV1/FVC无明显相关性(r=-0.113,P=0.428)。与FEV1呈显著负相关(r=-0.308,P=0.031)。慢阻肺患者血清抗Hp-CagAIgG水平与患者 FEV1/FVC无明显相关性(r=-0.173,P=0.232)。与FEV1呈显著负相关(r=-0.306,P=0.026)。
讨 论
慢阻肺 是一种以不完全可逆性气流受限为特征的常见病,对人类健康构成严重威胁,已成为全球重大公共卫生问题。 Hp(幽门螺杆菌)是螺杆菌属的代表菌种,1983 年Marshell 与Warren 在慢性胃炎患者的胃黏膜中首次分离发现。该菌是一种缓慢生长的微需氧的革兰阴性菌,凭借其产生的尿素酶(urease)、空泡毒素 (VacA) 、高致病力毒性相关基因 A (CagA)、中性粒细胞激活蛋白 (NAP) 等介导宿主对细菌的免疫反应。Hp在引起局部胃黏膜损伤的同时,可通过血液循环诱导机体发生全身非特异性炎症反应。其中 CagA是Hp最重要的毒力因子之一,与疾病的严重程度及预后相关。Hp 不仅是消化道常见的致病因素,还与胃肠外多个系统疾病相关。在呼吸系统疾病中,Hp 感染与慢性支气管炎、支气管扩张、支气管哮喘、肺结核、肺癌、间质性肺病等关系密切,尤其与慢阻肺的关系备受关注[3]。
Siva等发现在正常、慢性支气管炎、轻度、中度和重度慢阻肺人群中,消化性溃疡发病率分别为3.2%、16.2%、21.4%、42.4%和56.2%,且与 FEV1和 FEV1/FVC 之间存在强大而独立的相关性[4]。与上述研究结果一致,本研究表明慢阻肺组Hp的感染率明显高于正常组,与Hp阴性的慢阻肺组相比,Hp阳性的慢阻肺患者肺功能明显降低。Hp与慢阻肺存在流行病学联系,可能与下列因素有关:①Hp感染与慢阻肺有共同的危险因素或遗传易感性,罹患人群存在相似的社会经济和环境因素。②早期的肺发育在整体肺功能中发挥关键作用,儿童时期Hp的慢性感染可能导致肺的生长受损,影响肺组织的早期发育,导致成年后慢阻肺及并发心血管疾病的死亡风险增加。生命早期的暴露会抑制生长发育,表现为成人身高较低,进而导致FEV1较低,Sze等观察发现Hp阳性的慢阻肺患者较Hp阴性的慢阻肺患者平均身高低0.012 m[5]。③慢阻肺 患者长期处于慢性缺氧可导致胃黏膜缺血、缺氧,当慢阻肺进展到一定程度出现肺心病及心功能不全时,将进一步导致胃黏膜充血、水肿,为Hp感染创造条件。慢阻肺患者多有静脉使用或气道吸入糖皮质激素史,可损伤胃黏膜,使Hp 易入侵定植。此外,慢阻肺 患者反复感染,长期使用抗生素,致Hp易产生耐药性,使其难以根除。④炎症机制:Hp通过激活宿主的免疫反应,产生大量血管活性物质及毒素,诱导IL-6、IL-8、TNF-α等一系列炎性因子的释放,形成复杂的炎性免疫调节网络,通过血液循环诱导气道产生非特异性炎症反应。Nakashima等将正常人的支气管上皮细胞和肺泡上皮细胞与Hp产生的VacA培养24小时,可诱导细胞分泌IL-8和IL-6[6]。王慧敏等以雄性C57BL/6大鼠建立Hp感染的大鼠模型,与未感染Hp的慢阻肺大鼠相比,感染Hp的慢阻肺大鼠支气管肺泡灌洗液(BALF)中IL-6、IL-8、TNF-α 及中性粒细胞百分数明显升高[7]。⑤误吸:有研究认为Hp感染与慢阻肺的相关性可能与胃食管反流(GERD)引起的误吸密切相关。Hp刺激胃酸分泌,通过上调诱导型一氧化氮合酶(iNOS)促进一氧化氮(NO)的产生,使食管下括约肌(LES)松弛,易出现GERD。慢阻肺患者由于肺气肿,胸内负压增大,同时慢阻肺患者易出现胃十二指肠动力障碍,使食管下段压力梯度增加,易并发GERD。同时消化道和呼吸道毗邻,胃食管反流时Hp可通过误吸的方式直接进入呼吸道,导致气道的慢性炎症和直接损伤。反流物质特别是微量胃酸的吸人可诱发肺部感染和喘息发作,加剧气道炎症、水肿、痉挛和阻塞,诱导慢阻肺的急性加重。研究表明PCR检测慢阻肺患者BALF中Hp的阳性率为10%[8]。
Lee等研究指出与健康对照组相比,慢阻肺组Hp感染率无显著差异,Hp感染与慢阻肺肺功能的下降无显著相关性[9]。Taner等研究结果显示Hp阳性患者血清IL-6、IL-8、TNF-α 等炎性因子与Hp阴性组相比,差异无统计学意义[10]。目前关于Hp与慢阻肺的关系存在争议,研究结果迥异,可能与下列因素有关:①不同地区地理因素、社会经济和环境因素存在差异。②不同研究中纳入的慢阻肺患者严重程度、表型特征存在差异,研究表明良好的FEV1/pre有助于减少Hp与慢阻肺的并存,全身炎症表型慢阻肺 患者 Hp的感染率与普通人群相仿,I型呼吸衰竭及社会支持度低的慢阻肺患者更易合并Hp感染[11]。③研究对象既往药物使用存在差异,既往曾行Hp根除治疗,或使用质子泵抑制剂改善消化不良,反复使用抗生素治疗呼吸系统感染等,这些药物对血清Hp阳性率均存在影响。④Hp毒力的高低、基因的多态性、宿主的免疫遗传等因素存在差异。
本研究的不足和局限性在于:①样本量较少,慢阻肺1级患者缺失。②未统计研究对象的日常药物使用情况,进而观察药物是否影响慢阻肺患者Hp的感染率。③由于Hp感染的复发率高及肺功能下降的缓慢性,本研究未观察根除Hp治疗对合并Hp感染慢阻肺患者的肺功能的影响。
综上所述,Hp感染可能是导致 慢阻肺 患者肺功能恶化的因素之一。关于Hp感染与慢阻肺及肺功能的关系尚需进一步进行大样本的流行病学研究及长期的随访。Hp感染在慢阻肺发病机制的作用以及根除Hp对慢阻肺患者肺功能的影响尚不明确,仍有待于进一步研究。在经抗感染、改善肺功能治疗后肺功能仍恶化的慢阻肺患者,可尝试在常规治疗的基础上行Hp根除治疗,可能使患者受益。
