基于FRET效应的碳量子点/银纳米粒子荧光探针测定西咪替丁的研究
2020-08-03张越诚李承佳马红燕辛程宏李昊阳
张 洁,张越诚,李承佳,马红燕,李 恒,辛程宏,李昊阳
(延安大学 化学与化工学院,延安市分析技术与检测重点实验室,陕西 延安 716000)
西咪替丁(Cimetidine,CMT)是一种抑制胃酸和胃蛋白酶分泌的常用药物[1],但长期服用或剂量增大时会出现腹泻、咽喉肿痛等不良现象,有关CMT含量的精准、高效测定一直是研究热点。目前,已报道的测定CMT的方法主要有高效液相色谱法[2]、化学发光法[3]、分光光度法[4-5]、质谱法[6]、毛细管电泳法[7]和荧光法[8]等。荧光法凭借样品用量少、灵敏度高、使用简便等优点而受到青睐。荧光共振能量转移(FRET)[9]是指当两个荧光基团(分别为能量供体和能量受体)距离很近(<10 nm)且能量给体的荧光光谱与能量受体的激发光谱存在大部分交叉时,供体的能量转移至受体而产生荧光信号变化的现象。FRET技术具有高灵敏、方法简便等优点,已成功用于生化样品[10]、食品[11]和金属离子[12]的分析检测。
碳量子点(CQDs)是一种激发和发射波长连续可调、光学稳定性好、毒性低、水溶性好的新型碳纳米材料,被广泛用于环境监测、医学成像和生化分析等领域。目前CQDs的合成大多以富碳物质为碳源,其制备过程复杂且对反应仪器要求较高。近年来,一些利用天然生物质,如蘑菇[13]、红枣[14]、青柿子[15]制备CQDs的方法相继出现,这些方法制备过程简单、成本低且原料绿色环保无毒性。目前基于CQDs的FRET研究已有相关报道[16-18],其以CQDs作为FRET体系的能量供体,另一物质作为能量受体,如MnO2[16]、溴化乙锭(EtBr)[17]、玫棕酸钠(Sodium rhodizonate)[18]等。而以CQDs为荧光供体,AgNPs为荧光受体,采用FRET技术测定CMT的研究尚未见文献报道。
本文以杨桃(Carambola,CB)为碳源,通过一步水热法合成了强荧光的CB-CQDs。实验发现,CB-CQDs的荧光发射峰位置λem为397 nm,与AgNPs在399 nm处的共振吸收峰之间存在较大程度的重叠,CB-CQDs与AgNPs之间可以发生FRET使CB-CQDs荧光猝灭,荧光信号“关闭”,而向CB-CQDs/AgNPs体系中加入CMT后,CB-CQDs的荧光强度得以恢复,荧光信号重新“打开”。因此基于CB-CQDs /AgNPs之间的FRET效应及荧光信号的“关-开”,提出了以CB-CQDs /AgNPs为探针荧光分析测定CMT的新方法,并对反应机理进行了初步探究。
1 实验部分
1.1 仪器与试剂
F-2700型荧光分光光度计、HT7700型透射电镜(日本日立);IR Prestige-21型傅立叶变换红外光谱仪、XRD-7000型X-射线粉末衍射仪(日本岛津);FLSP920瞬态稳态荧光光谱仪(英国爱丁堡);8453型紫外可见分光光度计(美国安捷伦)。
准确称取CMT标准品(中国药品生物制品检定所)0.025 3 g,加入到20 mL乙醇中搅拌溶解,并超声5 min,待充分溶解后将溶液定容至100 mL容量瓶中,配制成浓度为1.0×10-3mol/L的 CMT标准溶液,置于4 ℃备用。伯瑞坦-罗宾森(BR)缓冲溶液( pH 6.0)。
AgNPs按照参考文献[19]进行制备:分别量取250 μL 0.1 mol/L AgNO3溶液、0.1 mol/L Na3C6H5O7·2H2O溶液及6 mL 5 mmol/L NaBH4溶液,依次滴入90 mL水中并磁力搅拌,滴加完成后再搅拌30 min。将所得产物避光静置8 h后定容至100 mL棕色容量瓶中,置于4 ℃暗室,待用。根据紫外-可见吸收峰强度和对应粒径的摩尔吸光系数[20]计算得到AgNPs浓度为2.5×10-10mol/L。
实验中所用试剂均为分析纯,水为超纯水。杨桃购于当地超市。
1.2 实验方法
1.2.1 CB-CQDs的制备称取33.0 g去皮杨桃,用玻璃棒充分捣碎,置于50 mL 聚四氟乙烯(PTFE)水热反应釜中,加入1.50 mL水,搅拌均匀后置于180 ℃真空干燥箱内反应18 h,待温度降至常温后,依次用滤纸、微滤膜(0.22 μm)过滤,将滤液定容至100 mL容量瓶中,即得到棕黄色CB-CQDs溶液。稀释100倍得到工作液,4 ℃保存备用。
1.2.2 CMT的测定在10 mL比色管中逐一加入上述CB-CQDs工作液2.00 mL、pH 6.0的BR缓冲液2.50 mL、AgNPs溶液2.00 mL以及不同浓度的CMT溶液,以水定容。于室温下反应20 min后,测定λex/λem=319 nm/397 nm下体系的荧光强度IF和未添加CMT溶液的CB-CQDs/AgNPs体系的荧光强度IF0,计算体系荧光恢复值ΔIF(ΔIF=IF-IF0)与CMT浓度之间的关系,λex和λem狭缝宽度均为5 nm。
2 结果与讨论
2.1 CB-CQDs的表征
2.1.1 CB-CQDs的形貌表征采用透射电镜(TEM)对CB-CQDs进行表征,如图1所示,CB-CQDs分散度较好,分布较为均匀,平均粒径为5.8 nm左右。

图1 CB-CQDs的TEM图(A)和粒径分布图(B)Fig.1 TEM image(A) and size distribution(B) of CB-CQDs
2.1.2 CB-CQDs的光谱特性图2A为CB-CQDs在不同激发波长λex下的荧光光谱,由图可知CB-CQDs发射峰的位置λem和强度受激发波长λex的影响,当λex由289 nm递增到349 nm时,发射波长λem由388 nm向长波方向移动至426 nm,荧光强度先增大后减小。实验发现,当λex为319 nm时,λem为397 nm,此时CB-CQDs的荧光强度达到峰值。
使用XRD对CB-CQDs进行晶体结构表征,如图2B所示。2θ=28.64°处为无定形碳的衍射峰,由此判定CB-CQDs的晶型为无定型碳。
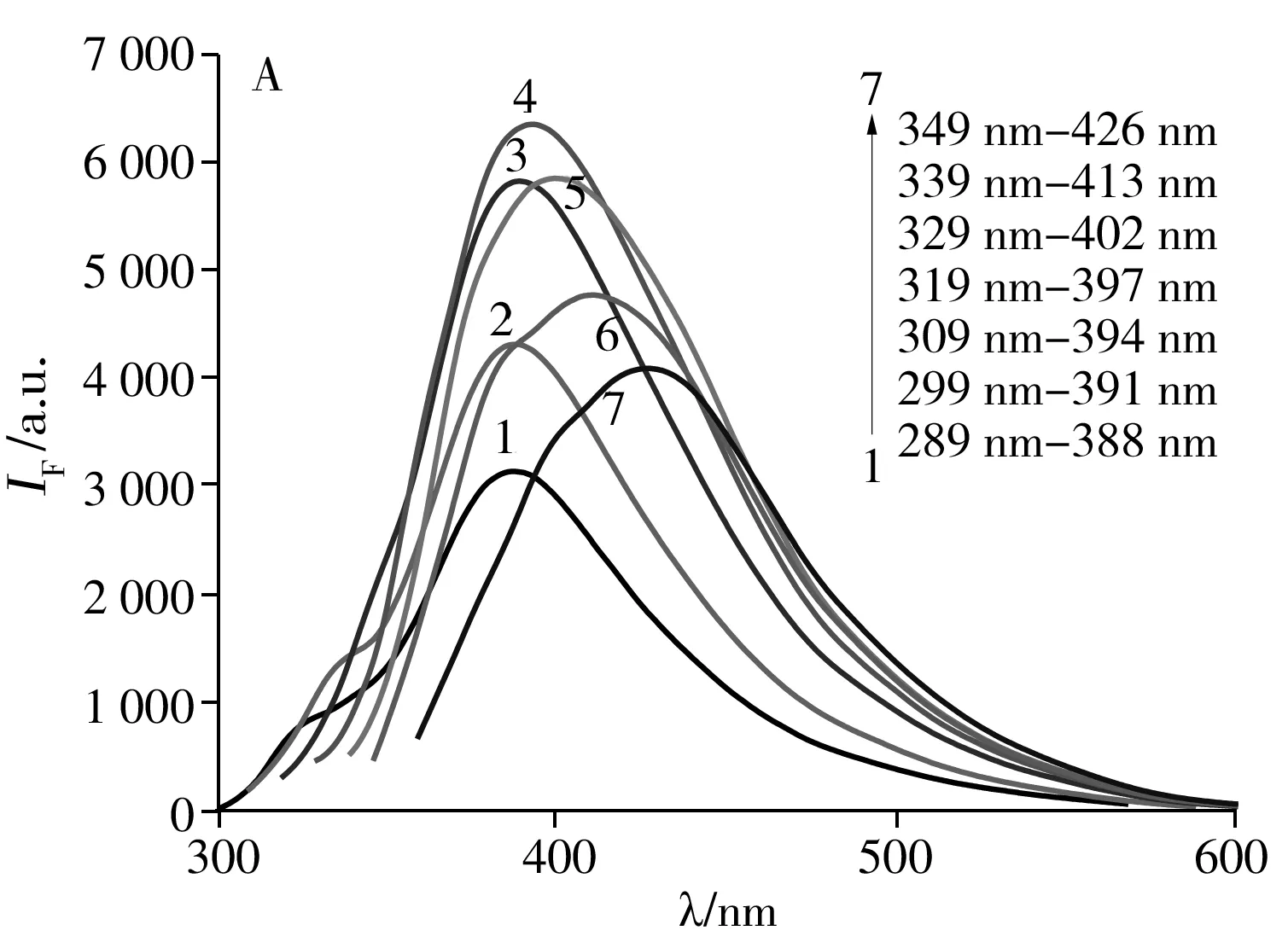
图2 CB-CQDs于不同λex下的荧光光谱(A)、XRD图(B)、FTIR图(C)和UV-Vis图(D)Fig.2 Fluorescence spectra of CB-CQDs with different excitation wavelengths(A),XRD spectrum(B),FTIR(C) and UV-Vis absorption spectrum(D) of CB-CQDs


2.2 CB-CQDs/AgNPs体系对CMT的测定
图3A为激发波长λex=319 nm下不同体系的荧光光谱图。由图可知,在该激发波长下,AgNPs、CMT以及二者反应产物均无明显荧光,故实验没有背景影响。向CB-CQDs中加入AgNPs后,前者在λex=319 nm处的荧光强度明显降低,荧光信号“关闭”;向该体系中继续加入CMT,可使猝灭后的CB-CQDs荧光部分恢复,荧光信号重新“打开”。由图3B分析可得,CB-CQDs的荧光恢复值随着CMT浓度的增加而增大,据此可基于该CB-CQDs /AgNPs荧光探针的“关-开”实现对CMT的测定。

图3 不同体系的荧光光谱(A)及随CMT浓度增加CB-CQDs/AgNPs的荧光信号恢复图(B)Fig.3 Fluorescence spectra of different systems(A) and fluorescence signal recovery of CB-CQDs/AgNPs with increasing cimetidine concentrations(B)
2.3 CMT测定条件优化
2.3.1 pH值及缓冲溶液的优化不同pH值的缓冲溶液对CB-CQDs/AgNPs的荧光强度会产生不同程度的影响。考察了pH值(2.0~8.0)对体系荧光强度的影响,实验表明,随着pH值的增加,体系ΔIF逐渐增大,pH 6.0时,体系ΔIF最大,此后随着pH值的增加ΔIF减小,因此实验选择pH 6.0的缓冲溶液。考察了BR、Na2HPO4-NaH2PO4、Na2HPO4-Na3C6H5O7·2H2O、C6H8O7-Na3C6H5O7·2H2O等不同种类的缓冲溶液(pH 6.0)及其用量(0.5~3.0 mL)对体系荧光强度的影响。结果表明,使用2.50 mL的BR缓冲溶液时,体系的ΔIF最大。
2.3.2 CB-CQDs的用量对CB-CQDs的用量(0.5~2.5 mL)进行了优化。在0.5~2.0 mL范围内,随着CB-CQDs用量的增加体系ΔIF增大,当用量为2.0 mL时,体系的ΔIF达到最大值,但用量大于2.0 mL时,体系的ΔIF随着CB-CQDs用量的增加而减小,故实验选择2.0 mL作为CB-CQDs的最佳用量。
2.3.3 AgNPs的用量实验考察了AgNPs溶液用量(0.5~3.0 mL)对体系荧光恢复值ΔIF的影响。随着AgNPs用量的增加,ΔIF增大。加入量为2.0 mL时,体系ΔIF达最大,继续增加AgNPs用量时,体系的ΔIF反而降低。其原因是AgNPs溶液用量过大时,CMT的含量相对降低,从而无法有效抑制FRET效应,故实验选择2.0 mL作为AgNPs溶液的最佳用量。
2.3.4 体系的稳定性向CB-CQDs/AgNPs体系中加入CMT溶液后,测定放置不同时间后体系的荧光恢复值ΔIF。实验结果表明,随着放置时间增加ΔIF增加,并在20 min时达最大,且在8 h内基本保持不变。

2.3.6 检出限及线性范围在选定的反应条件下,体系的ΔIF与CMT浓度在9.0×10-8~1.0×10-6mol/L范围内具有较好的线性关系,其线性方程为ΔIF=9.0×108c(mol/L)+32.713,相关系数(r)为0.998 6,检出限(3σ/k)为1.9×10-8mol/L。
2.4 样品测定
任意选取5片同批号的CMT片,研磨成粉,称取适量(相当于0.025 3 g CMT)药品粉末,超声使其于20 mL无水乙醇中充分溶解后定容至100 mL容量瓶,过滤,取适量滤液按照“1.2.2”方法测定,计算CMT片剂含量。
另于样品溶液中分别加入3个浓度(0.2、0.5、0.8 μmol/L)水平的标准样品,反应20 min后,依次对各个样品的3组混合液进行荧光强度测定,每组测定5次,计算ΔIF。根据标准曲线代入线性方程计算,回收率结果见表1。其加标回收率为97.5%~102%,相对标准偏差(RSD)小于3.0%,表明CB-CQDs/AgNPs荧光探针可用于实际CMT样品的检测。

表1 CMT样品测定及回收率实验(n=5)Table 1 Determination results of cimetidine in sample and recovery of the method(n=5)
2.5 反应机理初探
为探讨AgNPs对CB-CQDs的荧光猝灭机理,首先对CB-CQDs和CB-CQDs/AgNPs体系的荧光寿命进行了测定,前者的加权平均荧光寿命[22]为3.32 ns,后者为1.58 ns,加入AgNPs后荧光寿命减小,表明AgNPs对CB-CQDs的猝灭为动态猝灭。
其次,扫描了CB-CQDs的荧光光谱和AgNPs的UV-Vis光谱,如图4A所示。CB-CQDs荧光发射峰λem位置为397 nm(图4A左侧纵坐标);AgNPs 在399 nm处有一共振吸收峰(图4A右侧纵坐标),将CB-CQDs和AgNPs分别作为体系的能量供体与受体,二者峰之间存在较大程度的重叠,且该体系的分子间距小于10 nm,符合发生FRET的要求。据此可以推断,AgNPs对CB-CQDs的荧光猝灭作用是FRET效应。

图4 CB-CQDs的荧光光谱和AgNPs的UV-Vis图(A)以及不同浓度CMT加入AgNPs中的UV-Vis图(B)Fig.4 Fluorescence spectrum of CB-CQDs and UV-Vis absorption spectrum of AgNPs(A),and UV-Vis absorption spectra of different concentrations of cimetidine added to AgNPs(B)
图4B为AgNPs溶液中加入不同浓度CMT溶液时的吸收光谱。由图可知,在波长为399 nm处,CMT溶液的浓度越大,AgNPs的吸收峰越低。原因可能是AgNPs溶液中含有的柠檬酸盐使得AgNPs较为分散,此时AgNPs吸收峰较高;而CMT的加入使AgNPs产生团聚[23],从而导致AgNPs吸收峰强度下降,并使得AgNPs与CB-CQDs间的FRET效应被阻隔,导致CB-CQDs荧光恢复。反应的可能机理见图5。
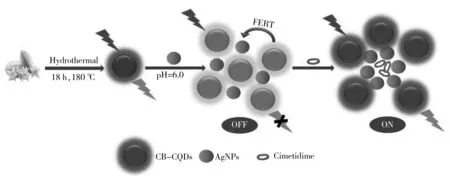
图5 CMT检测机理图Fig.5 Principle diagram for detection of cimetidine by the established system
3 结 论
通过一步水热法制备了荧光性能好、水溶性好的绿色CB-CQDs。基于AgNPs与CB-CQDs间的FRET作用使CB-CQDs荧光猝灭及CMT与AgNPs间的团聚作用使荧光重新恢复的现象,实现了荧光的“关-开”响应,并建立了以CB-CQDs /AgNPs为荧光探针的CMT检测新方法。该研究拓宽了CQDs在药物分析领域的应用范围。
