他唑巴坦合成中环合反应中间体的异构体分离与二维核磁解析
2020-07-31陈斌张小金郭靖宁刘英张祥明谢永居
陈斌 张小金 郭靖宁 刘英 张祥明 谢永居
摘 要 他唑巴坦是日本大鹏药业公司开发的一种重要的β-内酰胺酶抑制剂。利用柱层析对其合成中环合反应的六元环异构体杂质进行分离,并用核磁氢谱1H-NMR、碳谱13C-NMR、二维核磁相关谱1H-1HCOSY、HSQC、HMBC以及DEPT135对分离的六元环异构体杂质进行了结构归属解析。
关键词 他唑巴坦中间体 异构体 分离 核磁共振二维谱解析
中图分类号:O657.61 文献标志码:A 文章编号:1006-1533(2020)13-0073-04
Isolation and 2D-NMR analysis of intermediate isomer in the synthesis of tazobactam
CHEN Bin*, ZHANG Xiaojin, GUO Jingning, LIU Ying, ZHANG Xiangming, XIE Yongju**(Jiangxi Fushine Pharmaceutical Co., Ltd., Jiangxi Jingdezhen 333000, China)
ABSTRACT Tazobactam is an important β-lactamase inhibitor developed by Japan Taiho pharmaceutical company. The impurity of six-membered ring isomer in the cyclization reaction of tazobactam synthesis was isolated by column chromatography and analyzed by 1H-NMR, 13C-NMR, 1H-1HCOSY, HSQC, HMBC and DEPT135.
KEy WORDS tazobactam intermediate; isomer; isolation; 2D-NMR analysis
他唑巴坦為β-内酰胺酶抑制剂,由日本大鹏制药公司开发并于1992年上市,常与哌拉西林或头孢哌酮合用,与哌拉西林钠联合使用时,产生明显的协同作用,广泛用于治疗严重全身性和局部感染、腹腔感染、下呼吸道感染、软组织感染、败血症等,比已使用的其它抗菌复合剂具有更广泛的抗菌谱及适应证,在克服耐药性方面显示出巨大优势[1-3]。他唑巴坦有很多合成路线[4-8],目前大部分的工业合成路线是以Tazo-A为起始原料,经开环形成二硫化物Tazo-B, 再经环化反应形成中间体 Tazo-C(图1),同时会形成六元环异构体[9-10]。对此六元环异构体的结构确证对于产品质量方面的控制具有重要的意义。截止目前,未见该化合物的核磁结构解析文献报道。本文利用柱层析对合成Tazo-C的环合反应产生的六元环异构体杂质进行分离,并用核磁氢谱1H-NMR、碳谱13C-NMR、二维核磁相关谱1H-1HCOSY、HSQC、HMBC以及DEPT135对分离的六元环异构体杂质进行了归属解析。
1 仪器与试剂
1.1 仪器
400 MHz NMR核磁共振仪(Bruker公司);UTP-313电子天平(上海花潮电器有限公司);Xevo G2-XS Tof质谱仪、E2695液相色谱(Waters公司)。
1.2 试剂
化合物Tazo-A(99%,江西富祥药业股份有限公司);2-巯基苯丙噻唑、亚硝酸钠、碳酸氢钠(分析纯,上海阿拉丁生化科技股份有限公司);甲苯、盐酸、二氯甲烷、乙酸乙酯、正己烷(均为分析纯)和 粒径50~74 mm 硅胶(国药集团化学试剂有限公司)。
1.3 实验方法
1H-NMR、13C-NMR、DEPT 135、1H-1HCOSY、HSQC、HMBC均在Bruker公司400 MHz核磁共振波谱仪上测定。1H-NMR的观测频率为400 MHz,13C-NMR的观测频率为100 MHz。核磁共振实验采用5 mm直径核磁管,一维、二维核磁实验均在控温下进行。
2 六元环异构体的分离
参考文献合成Tazo-C[11],反应料液旋转蒸发干燥,得约40 g Tazo-C,加乙酸乙酯30~40 ml溶解,摇匀,加硅胶60~80 g,搅拌均匀,旋转蒸发干燥,使呈粉末态,备用。
取玻璃柱(直径8.5 cm,柱长80 cm),加入硅胶至约3/5柱体积。加入洗脱液,(正己烷-乙酸乙酯20∶1),至柱子中硅胶呈均一状。然后,缓慢加入上述粉末,加入洗脱液开始过柱,常压过柱,收集洗脱液,在过柱约8~9 L时,目标产物开始出现,收集过柱液,液相检测。收集含有六元环异构体料液,自然蒸发,析晶可得纯度较好的固体0.5 g。经HPLC检测其纯度为100%(图2,左为六元环异构体特征峰,右为他唑巴坦特征峰);质谱检测其分子量为401([M+Na]+以及[2M+Na]+)(图3)。
3 六元环异构体杂质的核磁共振解析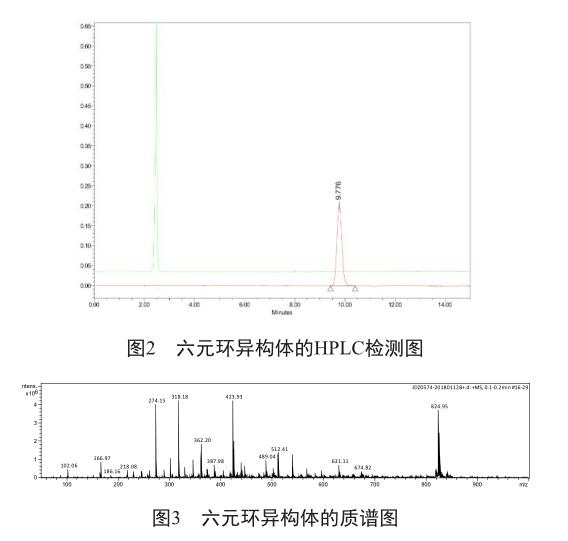
1H-NMR谱(图4)中显示分子中共有多组质子信号,共20个质子。δ 7.26的质子为溶剂质子信号。13C-NMR(图5)示出样品分子有多组C信号,分子中共含21个碳。DEPT135谱图(图6)显示有2组仲碳、9组叔碳或伯碳,其余为季碳。依据HSQC谱图(图7)可以确认各组碳与氢的连接关系。1H-NMR谱图中,δ 1.50(s, 3H)为单峰,且为3个质子,根据甲基的出峰规律,归属为H26, 对应的HSQC谱图(图7)中δ 28.97归属为C26。

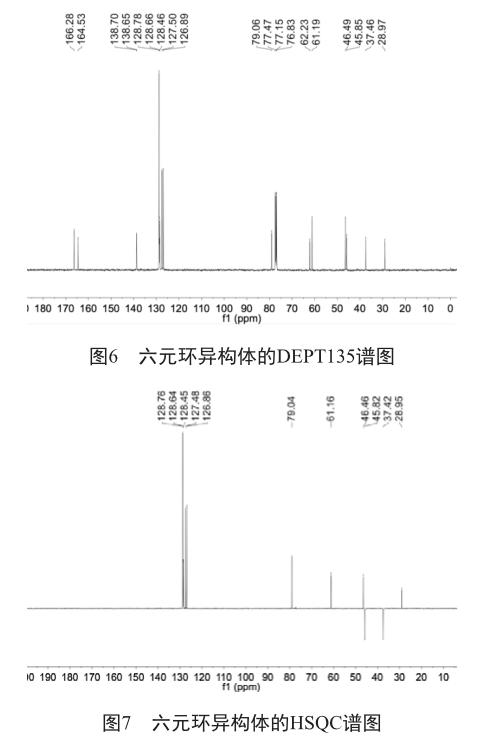
根据DEPT135谱图,可知δ 62.23为季碳,因此可归属为C19。
1H-NMR谱图中,δ 7.35为10个质子,根据芳香族质子的出峰规律,可以归属为H1/H2/H3/H4/ H6和H7/H9/H10/ H11/H12,HSQC中对应的碳为δ 126.89,δ 127.50,δ 128.46,δ 128.66,δ 128.78,δ 138.65和138.70。
1H-NMR谱图中,δ H 6.89为单峰,且为1个质子,结合HSQC以及DEPT135, 所對应的δ 79.06为叔碳,HMBC(图8)中,δ 6.89与芳环碳有相关,因此δ 6.89(s, 1H)归属为H13, δ 79.06归属为C13。
结合13C-NMR以及DEPT135, δ 164.53和δ 166.28为季碳,又根据HMBC图,δ 166.28与H13有相关,因此,δ 166.28归属为C15,δ 164.53归属为C24。
结合HSQC以及1H-NMR谱,质子δ 2.62(d, 2H, J=16 Hz)与质子δ 3.61(d, 2H, J =16 Hz)为同碳质子,且为仲碳质子;质子δ 2.99(d, 2H, J=16 Hz)与质子δ3.36(d, 2H, J=16 Hz)为同碳质子,且为仲碳质子。又根据HMBC图,C24与质子δ 2.99(d, 2H, J=16Hz)与质子δ 3.36(d, 2H, J=16 Hz)有相关,因此,质子δ 2.99(d, 2H, J=16 Hz)与质子δ 3.36(d, 2H, J =16 Hz)归属为H23,HSQC中对应的δ 45.85为C23; 质子δ 2.62(d, 2H, J =16 Hz)与质子δ 3.61(d, 2H, J=16 Hz)归属为H18, HSQC中对应的δ 37.46为C18。
1H-1HCOSY图(图9)中,H23与δ 4.97有相关,因此δ 4.97归属为H21, HSQC中对应的δ 46.49为C21。

根据HMBC图,C15与δ 4.85有相关,且对应的DEPT135中δ 61.19为叔碳,因此δ 4.85归属为H17, δ61.19归属为C17。
由上述分析知,δ 126.89,δ 127.50,δ 128.46,δ128.66,δ 128.78,δ 138.65和138.70为芳香族碳,根据HSQC, δ 138.65和138.70为季碳,因此δ 138.65和138.70归属为C5/C8。HMBC图中,δ 126.89,δ 127.50与H13相关,因此δ 126.89,δ 127.50归属为C7/C9和C4/C6。根据苯环的对称以及丰度规律,δ 128.46和δ128.66归属为C2/C11, 丰度最高的δ 128.78归属为C1/ C3/C10/C12。至此,六元环异构体的结构见图1、氢谱和碳谱归属结果见表1和表2。
4 讨论
本文采用柱层析制备分离了他唑巴坦中间体六元环异构体并用一维核磁和二维核磁1H-NMR、13C-NMR、DEPT135、1H-1HCOSY、HSQC、HMBC技术解析了六元环异构体杂质的分子结构,实现了对此杂质的氢谱和碳谱的全归属,后续可以对此杂质的衍生化反应以及反应过程中出现的Tazo-C产品和六元环异构体杂质比例等方面进行研究。
参考文献
[1] 张建民, 钟超平. 泰唑巴坦合成路线图解[J]. 中国医药工业杂志, 1995, 26(9): 428-429.
[2] Arakawa S, Kawahara K, Kawahara M, et al. The efficacy and safety of tazobactam/ceftolozane in Japanese patients with uncomplicated pyelonephritis and complicated urinary tract infection[J]. J Infect Chemother, 2019, 25(2): 104-110.
[3] Pilmis B, Petitjean G, Lesprit P, et al. Continuous infusion of ceftolozane/tazobactam is associated with a higher probability of target attainment in patients infected with Pseudomonas aeruginosa[J]. Eur J Clin Microbiol Infect Dis, 2019, 38(8): 1457-1461.
[4] 郝东亮, 李保勇, 张志腾. 一种他唑巴坦的制备方法:CN201910094506.6[P]. 2019-01-30.
[5] 李保勇, 郝春波, 宿乾贞, 等. 一种他唑巴坦的制备方法:CN201910089679.9[P]. 2019-01-30.
[6] Hao Hu, Aya Ohno, Takuma Sato, et al. Self-assembled polymeric pyridine copper catalysts for huisgen cycloaddition with alkynes and acetylene gas: application in synthesis of tazobactam[J]. Org Process Res Dev, 2019, 23(4): 493-498.
[7] Xu WL,Li YZ,Zhang QS, et al. A new approach to the synthesis of tazobactam using an organosilver compound[J]. Synthesis, 2005(3): 442-446.
[8] 李寶才, 潘光荣, 周强. 一种他唑巴坦酸的合成方法:CN201710308857.3[P]. 2017-05-04.
[9] Kamiya T, Teraji T, Saito Y, et al. Studies on β-lactam antibiotics. I. A novel conversion of penicillins into cephalosporins[J]. Tetrahedron Lett, 1973, 14(32): 3001-3004.
[10] Tanaka H, Tanaka M, Yamada S, et al. A facile halogenative cyclization of 4-(2-benzothiazolyldithio)azetidinones(Kamiyas disulfide) into 2β-(halomethyl)penams in a two layer system[J]. Bull Chem Soc Jpn, 1989, 62(9): 3046-3048.
[11] Micetich RG, Maiti, SN, Spevak P, et al. Synthesis of 2b-azidomethylpenicillin-1,1-dioxides and 3β-azido-3α-methylcepham-1,1-dioxides[J]. Synthesis, 1986(4): 292-296.
