阿帕替尼在二线以上小细胞肺癌中的临床应用
2020-07-25高宏祥杨拴盈杜建飞
畅 婕 高宏祥 杨拴盈 杜建飞
小细胞肺癌(small cell lung cancer, SCLC)占肺癌总数的15%~20%,与非小细胞肺癌(non small cell lung cancer, NSCLC)相比,其细胞的倍增时间更快,恶性程度更高,70%以上的患者确诊时已存在外周转移,SCLC对放化疗敏感,但更容易发生获得性耐药[1-3]。目前美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南及中国肺癌诊疗专家共识等尚无标准二线以上方案,且推荐的方案毒性反应大,疗效低。多数患者在经历一线及二线化疗后导致体力状况下降无法耐受更多治疗。因此选择合适的二线以上方案对延长患者总生存、提高其生活质量至关重要。
甲磺酸阿帕替尼片是一种小分子血管内皮生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR-2)酪氨酸激酶抑制剂,可通过抑制肿瘤血管生成,实现抑制恶性肿瘤生长的作用,现临床应用于胃癌、NSCLC、乳腺癌等实体瘤,并显示出一定的客观缓解率和生存获益,是否对SCLC存在疗效,目前无足够的临床证据[4-6]。本文探讨甲磺酸阿帕替尼片应用于SCLC的临床疗效、不良反应、影响因素及生存分析。
资料与方法
一、一般资料
选择2017年3月至2018年6月30日长安医院诊治的经组织病理检查明确的SCLC二线以上化疗失败的患者30例,均存在可测量的病灶,其中,男21例,女9例;≤65岁18例,>65岁12例;吸烟史22例,低钠血症14例,ECOG评分0~1分13例,2分17例,Ⅲ期9例,Ⅳ期21例。纳入标准:患者年龄在18岁以上;有明确的病理证实;既往接受二线以上化疗治疗失败的SCLC,出现疾病进展或复发者;肝、肾功能正常;美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)活动状态(performance status, PS)评分0~2分;评估总生存期>3个月。患者及家属均签署知情同意书。排除标准:患者有高血压、心脏病、肝肾功能异常;无法口服药物;有胃肠出血风险者,凝血功能异常(INR>1.5UNL、APTT>1.5UNL)。
二、研究方法
1.治疗方案:给予甲磺酸阿帕替尼片(江苏恒瑞医药股份有限公司,国药准字H20140105,250 mg/片)500 mg/次/d,餐后半小时口服,28 d为一疗程;若出现Ⅲ-Ⅳ级不良反应可减量至250 mg/次/d,直至疾病进展或不能耐受药物不良反应而停药。开始服用甲磺酸阿帕替尼片28 d后,开始观察服药效果,之后每周期观察一次,观察方法为每周复查血常规;28 d复查血压、肝肾功能、电解质、尿常规以评估不良反应,复查肿瘤标记物(包括神经元特异性烯醇化酶、癌胚抗原、胃泌素释放肽前体、细胞角蛋白19片段)、心电图、腹部彩超、胸部CT、头颅增强MRI观察疾病发展情况。
2.疗效判读:采用实体瘤疗效判读标准(RECIST)。完全缓解(complete response, CR):全部病灶消失且维持4周;部分缓解(partial response, PR):病灶直径总和缩小≥30%且维持4周;稳定(stable disease, SD):病灶直径总和有所缩小但未达到PR,或有所增加但未达到PD;进展(progressive disease, PD):病灶直径总和增加≥20%或出现新的病灶。客观缓解率(overall response rate, ORR)=(CR+PR)/总例数×100%,疾病控制率(disease control rate, DCR)=(CR+PR+SD)/总例数×100%。无疾病进展期(progression free survival, PFS)指从开始服用阿帕替尼至PD、失访或死亡时间。总生存期(overall survival time, OS)指从开始服用阿帕替尼至失访或死亡的时间。
3.不良反应判定:甲磺酸阿帕替尼片常见的不良反应为高血压、蛋白尿、血小板减少、白细胞减少、转氨酶升高、胃肠道反应、疲劳、手足综合征。将出现不良反应的患者根据NCI CTC3.0版评分,分为0-Ⅳ级。
4.随访:所有患者采用电话随访及住院病例资料统计,每月随访一次,PFS随访终点为疾病进展,OS的随访终点为死亡。随访截止时间为2018年6月30日。
三、统计学方法
应用SPSS17.0软件进行统计分析,先通过Kaplan-Meier法计算中位PFS和中位OS,再采用Log-rank检验分别分析变量(性别、年龄、吸烟情况、低钠血症情况、ECOG PS评分、分期、高血压、蛋白尿、手足综合征、疲劳、胃肠道反应)对PFS和OS的影响,将P值<0.1的变量应用向前引入法进行多因素Cox比例风险回归模型分析。以P值<0.05为差异有统计学意义。
结 果
一、治疗结果
30例患者服药2周期评估结果:CR 0例,PR 11例,SD 9例,PD 10例,ORR为36.6%,DCR为66.6%。中位无疾病进展期(progression free survival, PFS)4.0个月(95%CI2.864~5.136个月),中位总生存期(overall survival time, OS)6.0个月(95%CI4.555~7.445个月)。
二、生存情况及影响因素结果
1.PFS情况:应用Kaplan-Meier法分析性别男女差异(P=0.999)、年龄≤65岁对比>65岁(P=0.346)、吸烟对比不吸烟(P=0.767)、ECOG PS评分0~1分对比2分(P=0.307)、蛋白尿有无(P=0.423)、胃肠道反应有无(P=0.889)、手足综合征有无(P=0.678)对PFS无统计学差异。低钠血症(P=0.016)、分期(P=0.040)、高血压(P=0.009)、疲劳(P=0.042)是PFS的独立影响因素。再通过多因素Cox比例风险回归模型分析以上四种因素导致疾病进展的风险比例。其中有低钠血症(95%CI为1.043~13.082月)是无低钠血症患者发生疾病进展风险的3.693倍。不良反应存在高血压是应用阿帕替尼疗效较好的标志,有高血压(95%CI为0.090~0.869)发生是无高血压发生疾病进展风险的0.279倍,见表1,图1、2。
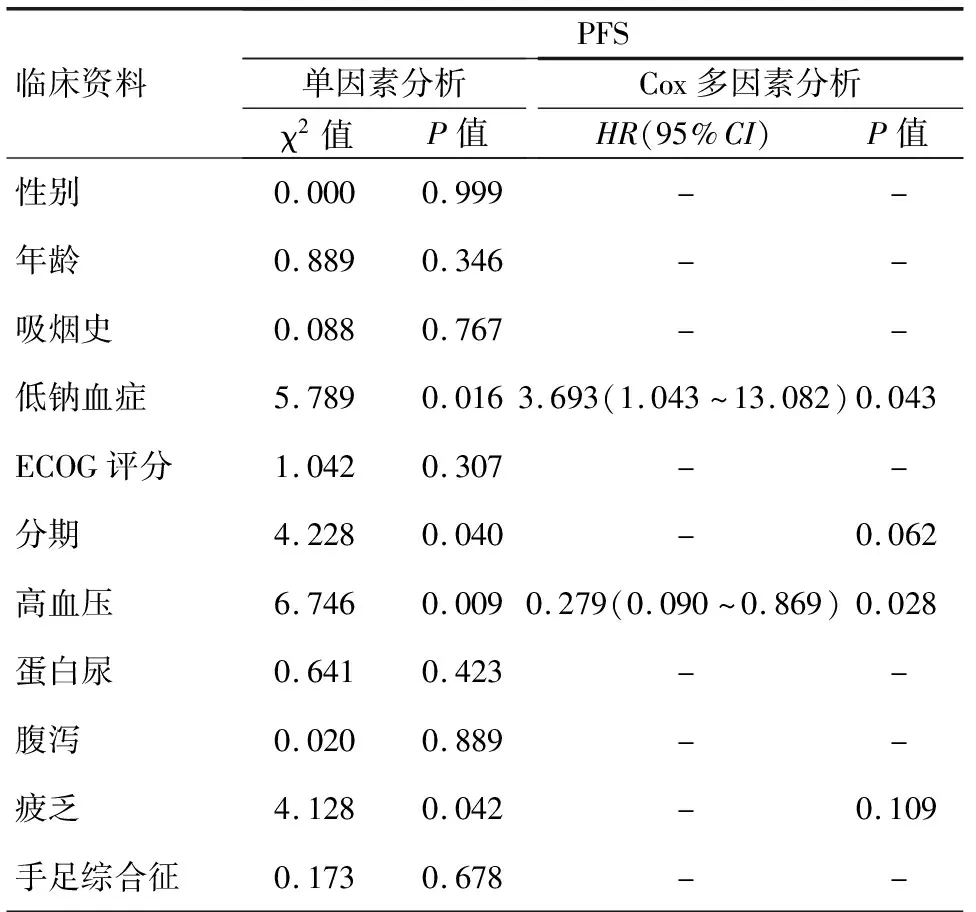
表1 30例患者Kaplan-Meier单因素和Cox多因素分析对PFS的影响
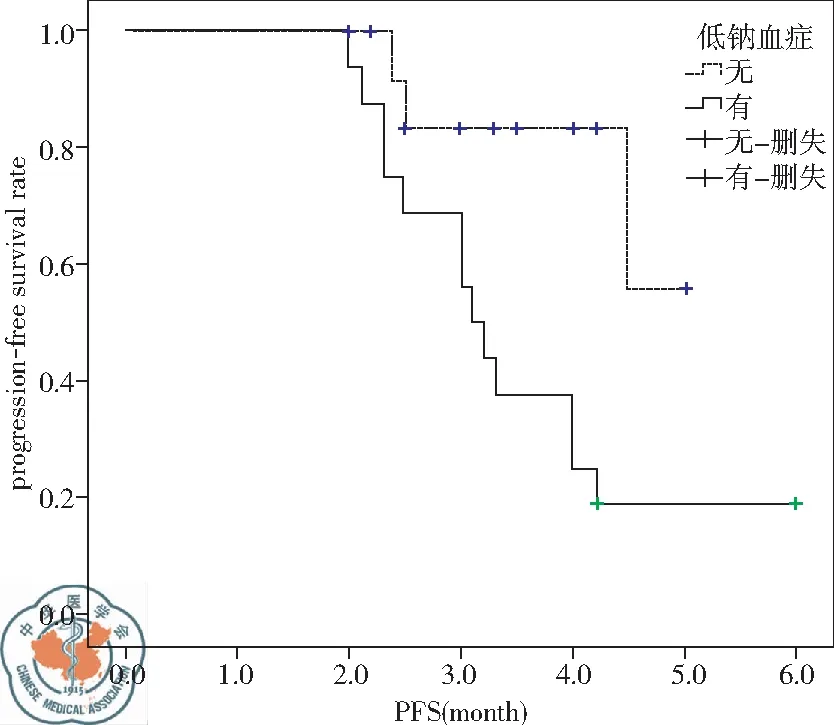
图1 低钠血症对PFS的影响

图2 高血压对PFS的影响
2.OS情况:应用Kaplan-Meier法分析性别男女差异(P=0.718)、年龄≤65岁对比>65岁人群(P=0.459)、吸烟对比不吸烟(P=0.997)、ECOG 0~1分对比2分(P=0.621)、蛋白尿有无(P=0.910)、胃肠道反应有无(P=0.799)、手足综合征有无(P=0.219)对OS无统计学差异。低钠血症(P=0.003)、分期(P=0.029)、高血压(P=0.003)、疲劳(P=0.043)是OS的独立影响因素。再通过多因素Cox比例风险回归模型分析以上四种因素导致死亡的风险比例。其中有低钠血症(95%CI为2.284~32.947)是无低钠血症患者发生死亡风险的8.675倍。Ⅳ期(95%CI为1.151~20.978)患者是Ⅲ期患者发生死亡风险的4.915倍。不良反应存在高血压是应用阿帕替尼疗效较好的标志,有高血压(95%CI为0.031~0.537)发生是无高血压发生死亡风险的0.128倍,见表2、图3~5。

图3 低钠血症对OS的影响
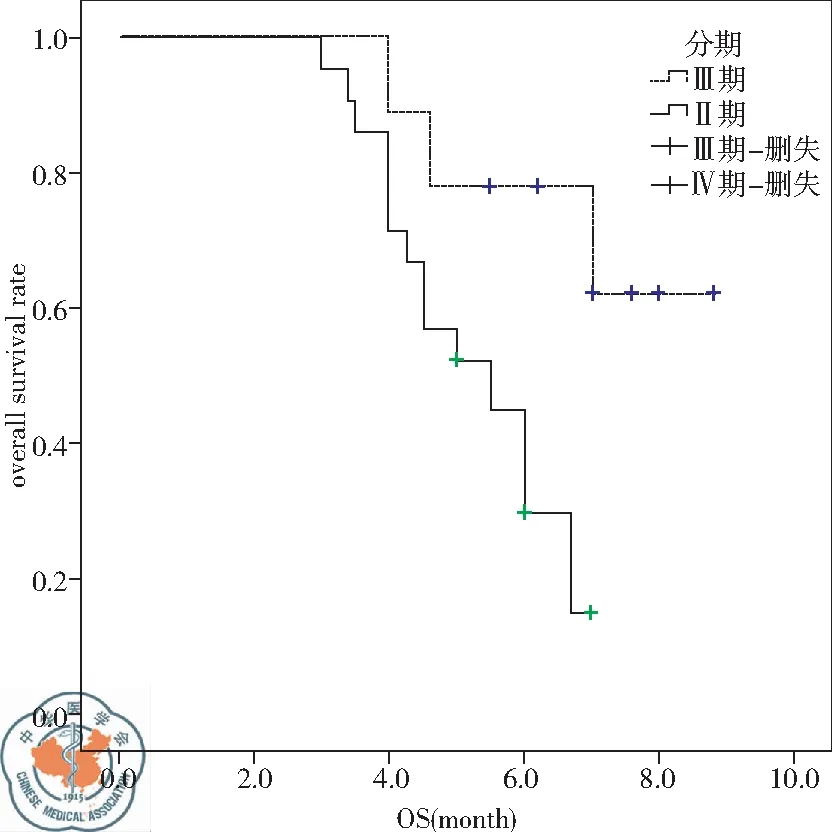
图4 分期对OS的影响
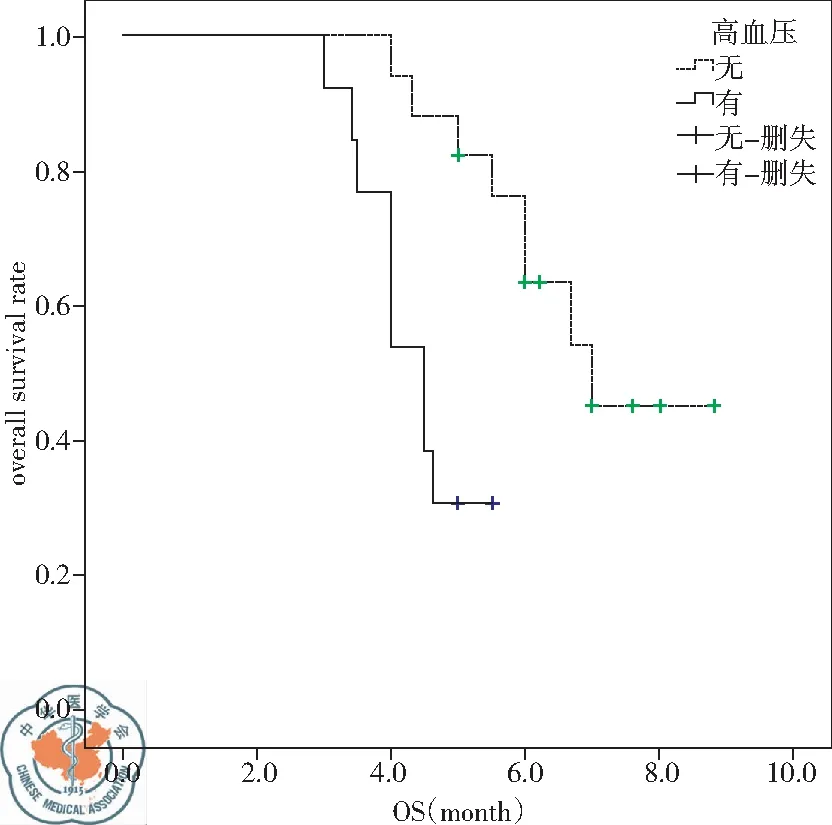
图5 高血压对OS的影响

表2 30例患者Kaplan-Meier单因素和Cox多因素分析对OS的影响
三、不良反应结果
治疗期间高血压发生率56.6%,蛋白尿发生率33.3%,血小板减少率56.6%,白细胞减少86.6%,转氨酶升高16.6%,胃肠道反应10.0%,疲劳33.3%,手足综合征23.3%,无Ⅳ级以上不良反应,见表3。
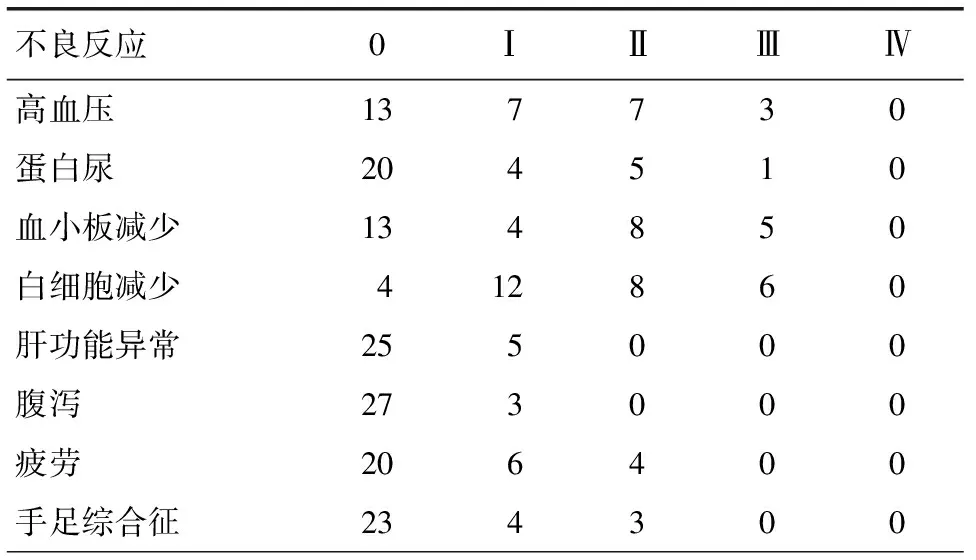
表3 阿帕替尼治疗二线以上进展的小细胞肺癌的不良反应
讨 论
SCLC占肺癌总数的10%~15%,属于分化差的神经内分泌癌,此型肺癌的生物学特性是细胞增殖快,恶性程度高,容易发生转移,当SCLC被确诊时,70%~90%患者已有临床或亚临床的淋巴结转移和/或远处转移,中位生存时间不超过11个月,5年生存率几近于零[7]。EP(依托泊苷+顺铂)方案一线化疗后大部分SCLC患者出现疾病进展,进展后根据疾病复发的时间更换二线用药。目前各指南推荐二线以上选择药物极少[8]。并且患者经过长期的化疗患者体质下降,联合用药毒性增加,促使研究者寻找一种高效低毒的药物控制疾病进展,那么单药抗血管生成治疗二线以上SCLC是否可行值得探索。
血管生成是肿瘤形成的重要途径,血管内皮生长因子(vascular endothelial growth factor, VEGF)及其受体在促进肿瘤血管生成和发生发展中起到关键性作用[9]。研究显示,VEGF在SCLC发病机制中可能是重要的媒介[10]。VEGFA和VEGFR蛋白表达阳性随肺癌的恶性程度及病程进展和淋巴结转移而增强。所以阿帕替尼应用于SCLC考虑与VEGFR的高表达有关[11]。现有的抗肿瘤血管生成药物包括贝伐珠单抗、重组人血管内皮抑素、舒尼替尼等。贝伐珠单抗是针对VEGFA的重组人源化单克隆IgG1抗体。目前现有的实验包括E3501研究、SALUTE研究、CALGB30306研究、IFCT-0802研究、FARM6PMFJM,以上研究的结果均显示贝伐珠单抗单药或联合化疗对广泛期SCLC的PFS有所延长,但OS无明显改善[12-17]。凡德他尼、舒尼替尼、尼达尼布、阿帕替尼是作用于VEGFR的抑制剂,阿帕替尼是2014年10月国家食品药品管理监督总局(CFDA)首次批准的小分子酪氨酸激酶抑制剂,用于晚期胃癌或胃食管结合部腺癌的三线治疗[18]。后期的临床研究逐渐将阿帕替尼推广到乳腺癌、非小细胞肺癌、甲状腺癌等多种实体瘤中,但应用于SCLC的临床试验较少[19]。洪卫等[20]开展的单中心回顾性研究,将阿帕替尼应用于广泛期SCLC的二、三线化疗失败后的患者,实验显示ORR18.2%(2/11),DCR81.8%(9/11),中位治疗时间为2.8个月。同时包括一些个案报道,均无大数据的临床效果展示[21]。
阿帕替尼用于胃癌的三线及三线以上的治疗,Ⅱ期临床试验应用阿帕替尼剂量为850 mg/d[22]。本文针对30例二线以上进展的SCLC应用阿帕替尼,在选择阿帕替尼的最佳给药剂量时,综合考虑此药应用于非小细胞肺癌、胃癌、乳腺癌、大肠癌的剂量,结合临床二线以上进展的SCLC患者大多已属于广泛期,既往接受最少4~6个周期以上的一线及二线全身化疗,同时近半数患者一般状况差、体质弱、ECOG评分2分,所以建议推荐的药物剂量为500 mg/d[23-26]。对于无法耐受的不良反应可进一步下调阿帕替尼至250 mg/d,临床观察到低剂量的阿帕替尼应用于此类患者中2疗程后评估ORR为36.6%,DCR为63.3%。说明阿帕替尼对于二线以上进展的SCLC存在一定临床疗效,实验结果基本与洪卫的结果一致。
临床特征方面,本文先通过Kaplan-Meier法进行单因素分析,再将有统计学意义的变量进行多因素Cox比例风险分析,可以有效将无统计学意义的因素规避。结果显示低钠血症、高血压的P值均小于0.05,是PFS和OS的独立影响因素。分期(P=0.032)是OS的独立影响因素。低钠血症主要见于肺癌中的SCLC,占肺癌总数的25%,临床表现为头晕、震颤、烦躁等神经系统症状[27]。SCLC伴低钠血症患者多分期较晚,且低钠血症较严重,严重影响患者生存时间。95%以上的低钠血症是由于抗利尿激素异常分泌综合征引起,所以临床上无低钠血症的患者,临床症状轻,体力状态尚可,口服阿帕替尼后副反应较轻,从这30例小细胞肺癌的患者观察有低钠血症是疾病预后的危险因素[28]。高血压为口服阿帕替尼2周左右常见的不良反应,已知阿帕替尼在胃癌的Ⅱ、Ⅲ期临床实验中,高血压发生率达到36.3%,其中3级高血压占比达到5.3%,无4级高血压。此次研究显示30例SCLC中3例Ⅲ级高血压,高血压发生率56.6%,较胃癌统计数据偏高。2018年最新研究数据显示阿帕替尼相关性高血压可能是预测阿帕替尼疗效的因素之一[29]。其主要原因为血管内皮细胞分泌血管舒张剂一氧化氮和血小板分泌前列环素下降、小血管及毛细血管稀疏、血管僵硬、内皮素功能紊乱、肾脏钠离子排泄异常[30-31]。次要原因为晚期肿瘤患者承担的心理压力较大,导致交感神经活性亢进,血浆儿茶酚胺浓度升高及小动脉收缩。此次临床试验显示高血压在多因素Cox比例风险模型中HR为0.279和0.128,说明高血压是PFS和OS的疗效预测因素。此外研究还显示30例入组患者中Ⅳ期是Ⅲ期发生疾病进展风险的3.693倍,死亡风险的4.915倍。主要考虑阿帕替尼抑制肿瘤新生血管,对已形成的肿瘤血管无显著逆转作用,此次收集的病例中Ⅳ期患者占比2/3,均存在不同程度的远处转移,分期较高的患者瘤负荷大,体质状况差,所以分期是PFS和OS的独立影响因素。其他文献报道阿帕替尼疗效预测的标记还有蛋白尿、手足综合征[32]。但此次研究结果未发现。后期仍需要扩大样本量进行多因素分析,观察能否得到更多有效的预测指标。
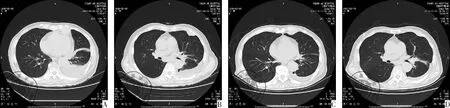
图6 典型病例胸部CT变化;注:A和B是基线,C和D是使用阿帕替尼4周后的CT表现
不良反应方面,本文显示30例SCLC中主要的不良反应为高血压、蛋白尿、血小板减少、白细胞减少、疲劳、手足综合征。经过2个疗程评估有12例出现Ⅲ级不良反应,其中3例为血小板减少合并白细胞减少,2例为单纯血小板减少,3例为单纯白细胞减少,3例为3级高血压,1例为3级蛋白尿。以上12例患者均因无法耐受阿帕替尼的不良反应减量至250 mg/d。
综上所述,单药低剂量阿帕替尼治疗二线以上化疗失败的SCLC疗效值得期待,不良反应可耐受。同时阿帕替尼治疗二线以上进展期SCLC的优势人群为分期Ⅲ期、未存在低钠血症的患者,同时服药后不良反应出现高血压可作为疗效预测指标。
