检测不同菌群发酵产生有机酸种类与含量
2020-07-24龚云霞齐小保
龚云霞,齐小保
湖北省武汉市华中农业大学食品科技学院(武汉 430070)
作为中国饮食文化的象征,传统的老面馒头有着悠久的历史,深受人们喜爱[1],究其原因是独特的发酵风味,同时特有的微生物菌系造成发酸面团特有的风味[2-3]。为了厘清中国的老面中微生物构成,系统研究来自湖北、河南、山东等地17份老面中的微生物菌群,发现主要的微生物菌群为酿酒酵母菌、植物乳杆菌、肠膜明串珠菌和戊糖乳杆菌。酿酒酵母菌在有氧条件下分解葡萄糖,生成CO2,在无氧条件下将葡萄糖分解为酒精和CO2[4],大量CO2气体截留于面团中网状结构的面筋中,使面团蓬松、体积膨大,经蒸或烤之后形成疏松多孔的结构[5]。植物乳杆菌、肠膜明串珠菌和戊糖乳杆菌在发酵过程中,可以产生乳酸、乙酸和丙酸等有机酸,具有改善面团质构的作用,提高面团的营养价值,有助于形成馒头特有风味[6]。
有机酸是影响馒头风味的重要物质,已有的老面发酵研究显示有机酸的检测方法主要有总酸测定法[7]和气质联用法[8],前者只能定性,后者难以同时分离多种有机酸,样品处理过于繁琐,适用范围较窄,也有报道用离子色谱法进行有机酸[9]的分析,但影响因素多、灵敏度低。
运用HS-SPME-GC-MS检测发酵风味物质已经有大量文献方法报道[10-11],但是该方法不适用于沸点较高的有机酸,难以定量分析,大大限制了发酵面团中有机酸的分析[12]。近几年反相高效液相色谱(RPHPLC)被广泛地应用于有机酸的分析,具有高效、快速的分离和定量多种有机酸的优点[13],然而报道以检测液体发酵酸奶或果酒中有机酸含量为主[14-15],对于面团发酵的研究报道较少。为了厘清发酵面团中微生物菌群对于有机酸形成的种类和含量的作用,联合使用HS-SPME-GC-MS和RP-HPLC方法检测面团发酵物中有机酸的方法,通过对比不同微生物菌群发酵组,检测发酵面团中有机酸的种类及其含量,揭示老面中菌株对有机酸形成的重要贡献,筛选最佳发酵组,产生最佳的发酵酸味风味,有利于开发适应市场需求、安全和高效的复合发酵剂。
1 材料与方法
1.1 仪器与试剂
SPME装置及萃取纤维头(美国Supelco公司);6890N-5975 GC-MS仪、微量进样器(10 μL,美国安捷伦公司);高效液相色谱仪e2695(美国沃特世);四元梯度输液泵(Alliance 2695型);进样器(Alliance 2695型);紫外可见检测器(2489型);色谱软件(2011年版Empower 3型);可降温柱温箱。
L-乳酸(98%(T))、丙酮酸(98%(T))、琥珀酸(GCS)、磷酸(GR)、冰乙酸(HPLC)、草酸二水合物(MSDS)、丙酸(GC)、正丁酸(GC)、甲醇(HPLC)(阿拉丁);磷酸二氢钾(AR)、氯化钠(AR)(国药集团);超纯水(Milli Q);面粉(市售,香满园小麦粉);YPD、MRS培养基(Solarbio公司)。
1.2 样品前处理
1.2.1 菌悬液的制备
酿酒酵母菌(HBCZ J4)、植物乳杆菌(WHQS 8)、肠膜明串珠菌(GSJQ 9)和戊糖片球菌(HBJZ4)均来源研究室分离保藏。通过YPD和MRS液体培养基将酿酒酵母、植物乳杆菌、肠膜明串珠菌和戊糖乳杆菌培养至对数生长中期,离心收集细胞,用生理盐水洗涤2次,重悬于生理盐水中,并通过分光光度法调整至OD600nm=0.40,备用。
1.2.2 无菌面粉液的制备
为了模拟老面发酵规则,使用无菌面粉溶液(SFS)代替面团。10 g/100 mL SFS制剂为:100.00 g面粉,补充蒸馏水至1 000 mL,搅拌均匀,调至pH 7.00,121 ℃灭菌20 min。
1.2.3 进样前处理
气相色谱样品前处理:将表1中的各组分均匀混合后37 ℃发酵至体积涨大1倍,发酵样品用生理盐水2倍稀释,存放于20 mL顶空小瓶中备用。
液相色谱样品前处理:各菌群组合发酵SFS方法同上,发酵样品用磷酸盐溶液2倍稀释,4 ℃静置提取2 h,超声处理10 min,离心(12 000 r/min,30 min),取上清液,经0.45 μm滤膜过滤,保存于液相色谱进样瓶备用。
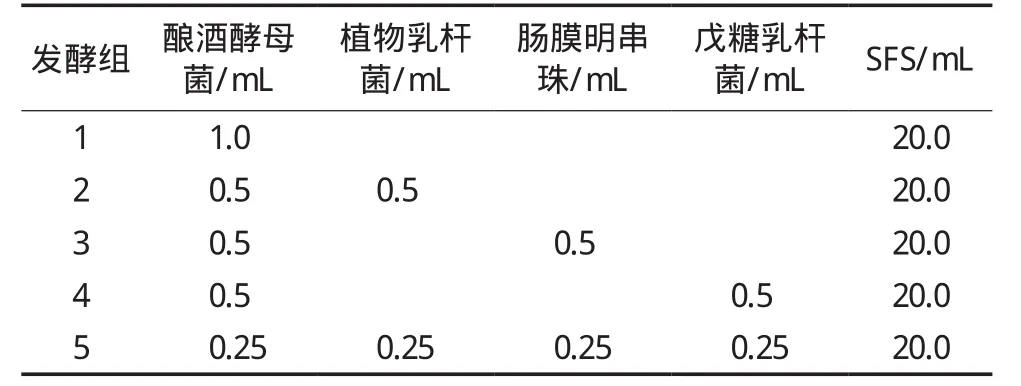
表1 不同发酵组菌株组合发酵配方
1.3 气相色谱试验方法
Supelco纤维支架与2 cm-50/30 μm DVB/Carboxen/PDMS(Sigma)纤维共同使用。纤维在270 ℃下老化1 h,平衡20 min后,纤维暴露于气相色谱样品组中,纤维头插入液体表面上1.5 cm处40 min,将纤维解吸到气相色谱(GC)进样器,250 ℃下进行5 min,于Innowax(Agilent)毛细管柱(30 m,0.32 mm,0.25 μm)上进行分析[16]。GC分析条件:炉温设定为40℃,保持3 min,以3 ℃/min加热至160 ℃,以8 ℃/min加热至220 ℃,并保持3 min;纯度99.999%氦气,流速1.0 mL/min,进样器温度250 ℃;喷油器以不分流模式运行;火焰离子化检测器检测器操作。质谱检测器条件:70 eV电子能量,35 μA灯丝发射电流,230 ℃离子源温度,150 ℃四极棒温度,280 ℃界面温度,30~550 AMU/s质量扫描范围[17]。方法独立重复3次。
通过GC-MS分析仪进行定性分析,并使用C6~C25正烷烃的保留时间计算每个色谱峰的保留。运用计算机光谱(NIST05/WILE7.0)进行初步搜索和数据分析,结合文献保留指数进行比较和手动光谱仪分析以确认挥发性物质的组成,筛选发酵样品中的有机酸种类及相对百分含量。
1.4 液相色谱试验方法
1.4.1 液相色谱条件
液相色谱柱:Onlysci GS-120-5-C18-AQ(4.6 mm ID×250 mm);参照相关文献,流动相为5%CH3OH-0.02 mol/L KH2PO4(pH 2.5)溶液,进样量20 μL,柱温设置25±5 ℃;流速0.5 mL/min;检测波长215 nm。
1.4.2 标准品的选择与制备
根据已有的报道,酿酒酵母菌单独发酵面粉产生的有机酸有乙酸、乳酸[18]、丙酸和丁酸[19],与乳酸菌混合发酵能够产生丙酮酸[20]和琥珀酸[21],在前期研究中也发现有草酸产生。因此选定乳酸、草酸、琥珀酸、丙酮酸、乙酸、丙酸和丁酸7种有机酸用于检测方法的建立。
标准溶液的配制:精确称取0.8 g乳酸、草酸、琥珀酸,用磷酸盐溶液定容至10 mL;丙酮酸、乙酸、丙酸和丁酸均为液体,移取适量样品用磷酸盐溶液定容至10 mL。由于丙酮酸、乙酸、丙酸、丁酸均为液体,均须使用NaOH溶液标定储备液浓度,采用国标法计算浓度。通过矫正,确定混合标准液中草酸浓度0.34 mg/mL,丙酮酸浓度1.48 mg/mL,乳酸浓度13.14 mg/mL,乙酸浓度10.67 mg/mL,丙酸浓度15.29 mg/mL,丁酸浓度18.36 mg/mL,琥珀酸浓度12 mg/mL。将混合标准液分别用磷酸盐溶液稀释5,10,20,50,100,200,500和1 000倍,经0.45 μm滤膜过滤,存于液相色谱进样瓶。
1.4.3 检测方法
将不同菌株组合发酵样品与混合有机酸标准品采用相同洗脱程序,通过保留时间、样品加标和各有机酸紫外吸收光谱来定性,将各有机酸标准溶液及峰面积外标法定量,得到7种有机酸标准曲线方程。精密度的测定采用标准液重复测定法,回收率的测定采用加样回收率测定法[13],检测独立重复3次。
1.5 统计学分析
使用完全随机化的设计来计划研究,并且使用SPSS 22.0对试验数据进行方差分析。
2 结果与讨论
2.1 HS-SPME-GC-MS检测有机酸
图1为发酵组5的HS-SPME-GC-MS检测结果图,表2展示不同发酵组中有机酸种类。HS-SPME-GCMS结果显示发酵液能检测到4种有机酸,分别是丙酸、丙烯酸、草酸和2-乙基己酸,前3种所有的发酵组均可检测到,只有2-乙基己酸在4种菌种发酵组5中检测到,说明混合发酵会产生更多的发酵酸味。在同类型的研究中检测到的有机酸种类有乳酸、乙酸[22]、丁酸、己酸、辛酸[23]、戊酸[24]和一些短链酸[25],通过研究发现酿酒酵母与乳酸菌发酵面粉代谢产生有机酸主要可分为两类:非挥发性有机酸和挥发性有机酸,但是其相对含量很低。此检测方法并未检测到乳酸菌发酵的特征有机酸——乳酸[26],一方面是因为试验仪器检出限高;另一方面是由于没有根据样品中有机酸的不同类型构建样品前处理和检测方法[27],因此如果采用HS-SPME-GC-MS方法精确地检测发酵液中有机酸种类及含量需要复杂的样品处理方法,以及根据有机酸的类型调试不同的气相检测程序,这样的检测方法既不快速也不便捷。
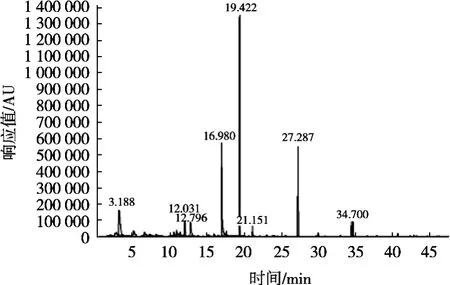
图1 发酵组5样品GC-MS检测结果
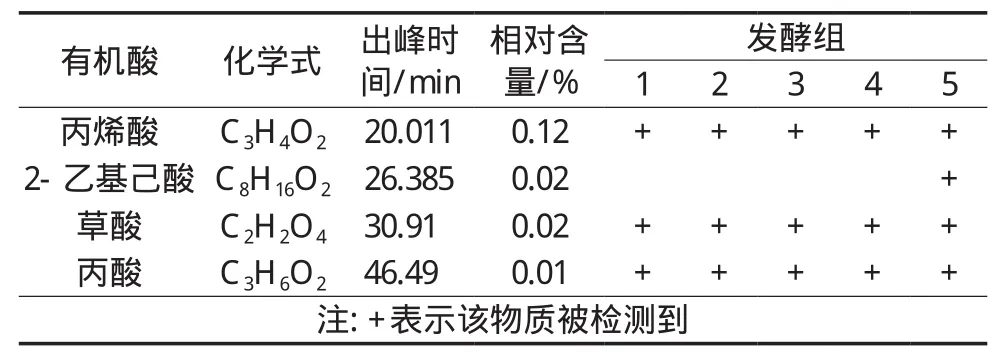
表2 HS-SPME-GC-MS检测不同发酵组液中有机酸
2.2 RP-HPLC方法检测有机酸
2.2.1 标准酸工作曲线
图2显示草酸、丙酮酸、乳酸、乙酸、琥珀酸、丙酸和丁酸的保留时间分别是5.806,7.785,9.773,10.42,14.08,19.713和37.75 min,7种目标有机酸单个标准液或混合标准液都得到很好的分离,表3表明7种标准品有机酸的浓度与峰面积有极好的线性关系,相关系数R2均大于0.999 0。
2.2.2 精密度试验与加样回收率试验
精密度试验中测定7种有机酸组分色谱图的保留时间和峰面积,计算相对标准偏差(RSD),7种有机酸的保留时间的RSD值在0.02%~0.64%之间,7种有机酸的峰面积的RSD值在0.048%~0.15%之间,表明仪器精密度良好;从7种有机酸组分的回收率和RSD可以看出,7种有机酸组分回收率在94.85%~99.51%之间,7种有机酸组分的RSD在0.23%~1.94%之间,说明方法准确可靠。
2.2.3 不同发酵组中有机酸含量的测定
从整体分析,对不同发酵组进行HPLC检测,结果如表4所示,不同菌株发酵SFS中均含有7种目标有机酸。乳酸和乙酸含量占据整体有机酸含量的绝对多数,存在极显著性差异(p<0.01),为发酵液有机酸的主要组分,其中在各组发酵样品中乳酸含量始终最高,并且产生有机酸含量由大到小依次是:乳酸、乙酸、丁酸、草酸和丙酮酸。在各组发酵组中,草酸与丙酮酸含量较为接近,由于发酵菌株的区别,乳酸含量的变化最为明显,乙酸含量也有比较明显的变化。
从各个发酵组分析,酿酒酵母利用Ehrlich途径通过氨基转移、脱羧和氧化还原反应将氨基酸转化为相应的醇和酸[28],从表4结果可以判断,只有酿酒酵母菌发酵时,产生的乳酸与乙酸含量相差不大,表明酿酒酵母菌发酵时产乳酸与乙酸的能力相当;对比发酵组2、3和4的有机酸结果发现植物乳杆菌与戊糖片球菌的参与极显著地提升乳酸含量(p<0.01),可能的原因是戊糖片球菌为同型发酵乳酸菌,肠膜明串珠菌属于异型发酵乳酸菌,而植物乳杆菌则为兼性发酵乳酸菌[29]。同型发酵仅通过EMP途径产生乳酸;而异型发酵除了产生乳酸外,还通过PK途径和HK途径产生乙醇和二氧化碳。试验结果可以说明乳酸含量是与EMP途径密切相关的,对比混合发酵组2、3、4和5,4种菌混合发酵组5产生的乳酸和乙酸含量最大,尤其乙酸含量相比其他3组有明显增加,同时丙酸与丁酸含量处于适中,表明酿酒酵母菌与不同发酵类型的3种乳酸菌发酵面粉可以达到更好发酵效果。
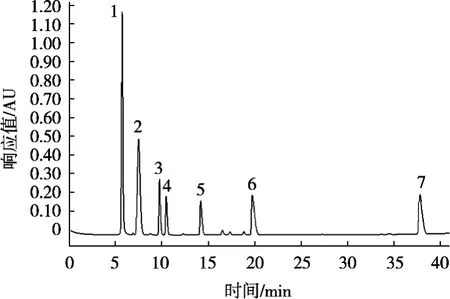
图2 7种有机酸混合标准HPLC图谱

表3 7种标准有机酸的回归方程
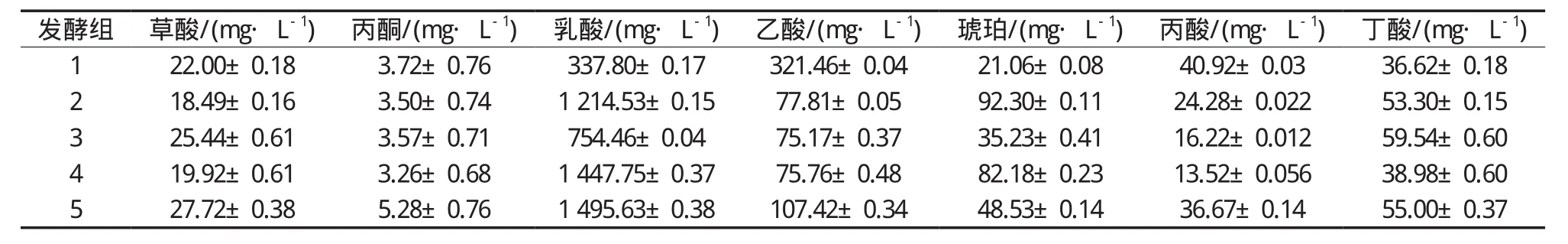
表4 各发酵组中7种有机酸浓度
3 结论
RP-HPLC检测不同菌株发酵面粉中有机酸的方法:采用Onlysci GS-120-5-C18-AQ(4.6 mm ID×250 mm)色谱柱,流动相为5% CH3OH-0.02 mol/L KH2PO4(pH 2.5)溶液,流速0.5 mL/min,波长215 nm,对比分析HS-SPME-GC-MS与RP-HPLC检测发酵面粉中常见有机酸。采用HS-SPME-GC-MS仅检测到丙酸、丙烯酸、草酸和2-乙基己酸,有研究显示乳酸和乙酸等低沸点的有机酸难以检测到或极微弱地检测到[30]。然而,RP-HPLC方法可同时准确分离和定量测定发酵面粉中常见的草酸、丙酮酸、乳酸、乙酸、琥珀酸、丙酸和丁酸7种有机酸,方法具有较高的准确度和较快的速度。通过对不同菌株组合发酵面粉产生有机酸检测结果比较分析,酿酒酵母菌、植物乳杆菌、肠膜明串珠菌和戊糖片球菌混合发酵,特征性风味乳酸和乙酸含量显著增加,可用于制作复合发酵剂并予以推广。
