氟康唑、酮康唑、伊曲康唑和伏立康唑上市后不良反应信号的挖掘与分析
2020-07-23刘海林袁红梅王虎刁俊林周春巧丁晓莉张雪林董志王松
刘海林 袁红梅 王虎 刁俊林 周春巧 丁晓莉 张雪林 董志 王松

中圖分类号 R978.5 文献标志码 A 文章编号 1001-0408(2020)09-1118-06
DOI 10.6039/j.issn.1001-0408.2020.09.18
摘 要 目的:挖掘唑类抗真菌药物氟康唑、酮康唑、伊曲康唑和伏立康唑上市后的安全警戒信号,为临床合理用药提供参考。方法:调取美国FDA不良事件报告系统(FAERS)数据库2004年1月1日-2019年3月30日接收的氟康唑、酮康唑、伊曲康唑和伏立康唑药品不良事件(ADE)报告,采用报告比值比(ROR)数据挖掘方法对这4种唑类药物进行不良反应(ADR)信号挖掘,重点分析该类药品说明书安全性信息所涉及的主要ADR。结果:提取FAERS数据库信息得到氟康唑ADE报告27 831例、酮康唑ADE报告5 712例、伊曲康唑ADE报告5 381例、伏立康唑ADE报告11 333例。经ROR法检测,上述4种唑类药物在医学检查、血液和淋巴系统疾病、肾脏和泌尿系统疾病、内分泌疾病与肝胆疾病中均出现ADR强信号。其中,氟康唑、伏立康唑肝毒性ADR信号较强(氟康唑ROR=6.51,伏立康唑ROR=14.65);伊曲康唑类库欣综合征(ROR=24.86)和肾上腺抑制(ROR=44.06)ADR检测结果显示为强信号;酮康唑、伊曲康唑在肾上腺皮质功能不全中ADR信号较强(酮康唑ROR=15.64,伊曲康唑ROR=23.26),而酮康唑在皮肤及皮下组织疾病中ADR信号强度(ROR=2.81)明显强于其他药物。此外,氟康唑、伊曲康唑、伏立康唑引起出血性膀胱炎在其说明书中尚未收录(氟康唑ROR=17.73,伊曲康唑ROR=31.43,伏立康唑ROR=17.06);氟康唑引起网状青斑(ROR=10.50)在其说明书中尚未收录。结论:临床医务人员应加强对氟康唑、酮康唑、伊曲康唑和伏立康唑相关主要ADR差异性的认识,在临床使用过程中,对氟康唑、伊曲康唑、伏立康唑引起出血性膀胱炎,氟康唑引起网状青斑等说明书中未提及、但真实世界发生率又较高的ADR,以及伊曲康唑导致的类库欣综合征和肾上腺抑制等虽然说明书中有提及、但检测结果呈异常强信号的ADR应重点关注。
关键词 氟康唑;酮康唑;伊曲康唑;伏立康唑;不良反应;信号挖掘;报告比值比
Excavation and Analysis of ADR Signals of Fluconazole, Ketoconazole, Itraconazole and Voriconazole after Marketing
LIU Hailin1,YUAN Hongmei2,WANG Hu1,DIAO Junlin1,ZHOU Chunqiao1,DING Xiaoli1,ZHANG Xuelin1,DONG Zhi3,WANG Song1(1. Dept. of Pharmacy, the First People s Hospital of Chongqing Liangjiang New District, Chongqing 401121, China;2. Dept. of Pharmacy, Yunyang County Peoples Hospital, Chongqing 404506, China;3. College of Pharmacy, Chongqing Medical University, Chongqing 400046, China)
ABSTRACT OBJECTIVE: To excavate the safety warning signals induced by azole antifungal agents, including fluconazole, ketoconazole, itraconazole and voriconazole after marketing, and to provide references for rational drug use in the clinic. METHODS: Reporting odds ratio (ROR) data mining algorithm was used to investigate signals of adverse drug event (ADE) for fluconazole, ketoconazole, itraconazole and voriconazole from FDA Adverse Event Reporting System (FAERS) during January 1st, 2004 to March 30th, 2019. ROR data mining method was used to excavate the ADR signals of the drugs, and main ADR involved in the safety information of azole antifungal agents instructions were analyzed. RESULTS: A total of 27 831, 5 712, 5 381 and 11 333 reports were picked out for fluconazole, ketoconazole, itraconazole and voriconazole, respectively. All of these drugs had exhibited high-risk signals detection by ROR, including medical examination, blood and lymphatic system disorders, renal and urinary disorders, endocrine diseases, hepatobiliary disorders. The hepatotoxic-related ADR signals were mainly concentrated in fluconazole and voriconazole (fluconazole ROR=6.51, voriconazole ROR=14.65); ADR detection results of Cushings-like syndrome (ROR=24.86) and adrenal suppression (ROR=44.06) by itraconazole showed high-risk signals; ketoconazole and itraconazole had showed a strong ADR signal in adrenocortical dysfunction (ketoconazole ROR=15.64, itraconazole ROR=23.26), and the signal intensity of ketoconazole (ROR=2.81) in skin and subcutaneous tissue disorders was significantly higher than that of other drugs. In addition, hemorrhagic cystitis caused by fluconazole, itraconazole and voriconazole were not included in the drug instructions (fluconazole ROR=17.73, itraconazole ROR=31.43, voriconazole ROR=17.06); netted green spot caused by fluconazole (ROR=10.50) were not included in the drug instructions. CONCLUSIONS: Clinical staff should pay more attention to the differences in serious ADR related to fluconazole, ketoconazole, itraconazole and voriconazole; particularly some ADRs not mentioned in the drug instructions but have high incidence such as hemorrhagic cystitis caused by fluconazole, itraconazole, voriconazole and netted green spot caused by fluconazole, as well as ADRs mentioned in the drug instructions but have abnormally high signal, such as Cushings-like syndrome and adrenal suppression caused by itraconazole .
KEYWORDS Fluconazole; Ketoconazole; Itraconazole; Voriconazole; ADR; Signal mining; Reporting odds ratio
近年來,随着器官移植、恶性肿瘤以及免疫缺陷患者的增多,真菌感染在临床中也愈发常见[1-2]。随着抗真菌药物的广泛应用,该类药品不良反应(ADR)越来越受到临床的关注,而临床上以唑类抗真菌药物的应用最为广泛,其上市后的ADR发生率亦最高[3]。唑类抗真菌药物主要包括咪唑类和三唑类,咪唑类药物在临床常用的为酮康唑,而三唑类药物主要包括氟康唑、伊曲康唑和伏立康唑,均为广谱抗真菌药。其中,酮康唑为首个用于治疗真菌感染的口服唑类药物,但因其肝毒性,现主要作为浅表部真菌感染的首选治疗药物;而氟康唑、伊曲康唑和伏立康唑为治疗深部真菌感染的一线用药。唑类药物在抗真菌治疗中占有重要地位,但关于其用药安全性尚未有文献系统阐明。
基于自发呈报系统进行ADR的信号检测和分析,是目前主要的ADR监测手段和信号来源,常用于发现新的、潜在的ADR及评估药物风险,可为用药决策提供数据参考[4]。本研究拟通过对美国FDA药品不良事件(ADE)报告系统(FDA Adverse Events Reporting System,FAERS)的相关数据进行挖掘分析,并结合中美两国氟康唑、酮康唑、伊曲康唑和伏立康唑药品说明书中的ADR及更新信息,运用信号挖掘技术对上述4种唑类抗真菌药品涉及的主要ADR进行信号分析,以期为临床合理用药提供参考。
1 资料与方法
1.1 数据来源
本研究以美国FDA公众健康项目(open FDA)数据库作为数据来源,其ADE原始数据由FAERS导入。FAERS收集了发生在美国境内外用药相关的自发性安全报告及上市后临床研究报告,且所有ADE数据以《国际医学用语词典》(Medical Dictionary for Drug Regulatory Activities,MedDRA)的首选语(Preferred terms)进行编码[5]。本研究提取FAERS数据库2004年1月1日-2019年3月30日期间接收的氟康唑、酮康唑、伊曲康唑和伏立康唑的ADE报告进行信号挖掘分析。
1.2 数据处理
本研究数据提取采用open FDA分析工具,通过对接应用程序接口直接提取FAERS数据库中结构化的ADE报告信息。选择“药品不良事件(Drug adverse events,ADE)”模块,为了保证数据提取的完整性,限定目标药物通用名(Generic name)为“Fluconazole”“Ketoconazole”“Itraconazole”“Voriconazole”,进一步排除重复和信息不完整的报告,最终得到目标药物为首要怀疑药物的ADE报告。
1.3 信号检测方法
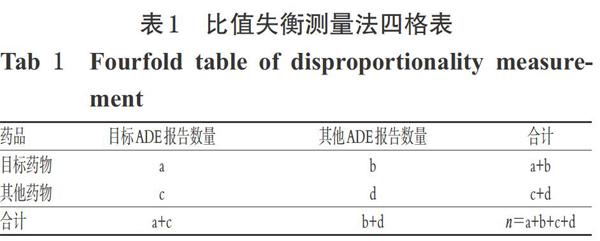
比值失衡测量法是ADR信号挖掘常用的一种方法,本研究采用其中的报告比值比(ROR)信号挖掘法,该方法灵敏度较高,且能消除大量偏倚[6]。信号检测标准为:(1)报告数a≥3;(2)当ROR值的95%置信区间(CI)下限>1时,即提示一个可疑信号生成,ADR信号越强则提示药物与ADE之间的关联性越强[7][注:ROR的计算公式为ROR=(a/c)/(b/d);ROR的95%CI= [eln(ROR)±1.96√(1/a+1/b+1/c+1/d)]]。其具体算法基于四格表,详见表1。
2 结果
2.1 ADE报告的基本情况
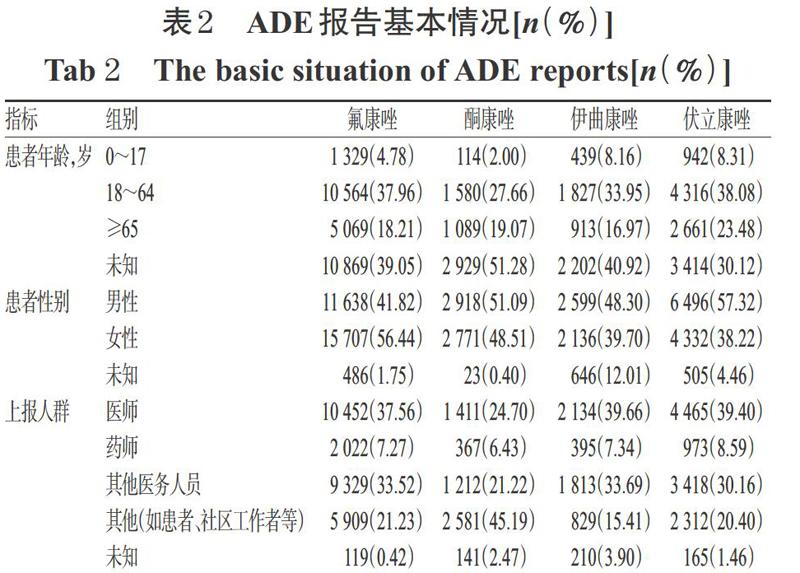
在排除重复和信息不完整的报告后,共提取50 257例ADE报告进行分析,其中包含氟康唑ADE报告 27 831份,酮康唑ADE报告5 712份,伊曲康唑ADE报告5 381份,伏立康唑ADE报告11 333份。上报结果显示,排除信息未知的报告,ADE的患者年龄范围主要在18~64岁之间,其次为65岁及以上老年患者,18岁以下未成年患者ADE报告比例最低;氟康唑ADE中女性报告例数明显多于男性,而伊曲康唑和伏立康唑ADE的男性报告例数明显多于女性,酮康唑ADE的报告例数未见明显性别差异。上述ADE上报人群差异较小,大部分ADE上报人群主要为医师和其他医务人员,药师上报数量相对较少。酮康唑ADE上报人群主要为其他,所占比例为45.19%,提示酮康唑的ADE引起了患者或其他相关人员的重视。ADE报告基本情况详见表2。
2.2 ADR信号及其强度
4种唑类药物作为同一个类别,其总体ADR信号强度在各组织/器官/系统中存在差异,详见图1。由图1可见,4种唑类药物涉及的医学检查、血液和淋巴系统疾病、肾脏和泌尿系统疾病、内分泌疾病、肝胆疾病等ADR信号强度最为显著(ROR>2)。在组织/器官/系统中4种唑类药物的ADR信号检测结果见表3。重点组织/器官/系统中4种唑类药物的ADR信号检测结果见表4。
3 讨论
酮康唑具有严重的肝毒性,口服使用风险大于效益,我国国家食品药品监督管理总局也于2015年6月发布公告停止酮康唑口服制剂在我国的生产、销售和使用[8],因此,酮康唑现主要用于浅表部真菌感染的治疗。三唑类是目前治疗深部真菌感染的一线药物,其代表药物氟康唑、伊曲康唑和伏立康唑目前均有口服药及注射剂。三唑类药物通过抑制真菌中由细胞色素P450(CYP)介导的甾醇14α-去甲基化酶活性,干扰真菌细胞中麦角固醇的生物合成,增加细胞膜的通透性,进而抑制真菌生长或诱发真菌死亡[9]。唑类药物虽然具备较强的抗真菌作用,但同时也会导致各种ADR而影响患者的治疗。因此,本研究针对氟康唑、酮康唑、伏立康唑和伊曲康唑上市后的ADE报告进行分析,重点探讨了该类药品说明书及文献所涉及的严重和常见的ADR在真实世界中的安全警戒信号状况。
肝胆系统的损害是唑类抗真菌药物最常见的ADR。本研究中,氟康唑ADR强信号主要表现在胆道运动功能障碍及慢性胆囊炎,酮康唑ADR强信号主要表现在肝囊肿及胆管结石,伊曲康唑ADR强信号主要表现在肝胆管疾病及高胆红素血症,伏立康唑ADR强信号主要表现在脂肪淤积性肝炎及静脉闭塞性肝病。抗真菌药物引起肝损伤的主要机制与其对真菌CYP酶系产生抑制作用的同时也抑制了肝脏内部的CYP酶系及在肝脏的代谢密切相关[10-11]。在肝胆系统ADR中,肝毒性较严重,近年来有多例严重肝毒性甚至死亡的报道[12-13]。本研究结果显示,氟康唑和伏立康唑检测出较强的肝毒性ADR信号,与文献报道的酮康唑具有最严重肝毒性[12]不一致。这种不一致的可能原因为对于深部真菌感染,酮康唑的使用相对其他品种较少。伏立康唑作为治疗侵袭性曲霉等真菌感染的首选治疗药物广泛应用于临床,近年来有不少研究报道了其肝毒性ADR。Tasleem SH等[14]报道了1例肝功能异常患者使用伏立康唑后诱发肝性脑病,并在其肝组织中发现了菱形晶体,证实伏立康唑具有肝毒性。一项纳入了69 例患者的研究发现,伏立康唑诱发肝毒性与患者的血药浓度水平、肝基础疾病、CYP2C19 基因多态性有关[15]。另一项基于小鼠的代谢组学研究显示,伏立康唑的肝毒性与肝细胞功能障碍、能量代谢、尿素循环的改变等过程相关[16],故临床使用过程中应引起足够重视,特别是对于合并肝脏基础疾病的患者。
在肾和泌尿系统疾病中,除酮康唑外,氟康唑、伊曲康唑和伏立康唑均检测到出血性膀胱炎的ADR强信号,但药品说明书中并未对上述ADR进行详细描述。在Safdar A等[17]的研究中,共纳入204例骨髓移植患者,其中14例患者发生真菌感染,使用低剂量氟康唑(100~200 mg/d)治疗,其中3例发生了严重的出血性膀胱炎。因此,在临床使用过程中需密切关注该类ADR的发生情况。此外,对于肾小管酸中毒、肾小管坏死,4种唑类药物的ADR信号强度相近。这与文献报道伊曲康唑和伏立康唑是导致肾毒性的主要抗真菌药物[18]的结论一致。因伊曲康唑注射液及伏立康唑注射液中均含有辅料环糊精,环糊精是导致肾功能不全的主要原因[18],但亦有其他研究表明,环糊精不会引起肾功能不全[19],因此关于伏立康唑治疗引起肾功能不全的原因还存在争议。
在内分泌系统疾病方面,由表3可知,酮康唑、伊曲康唑較氟康唑、伏立康唑显示出更高的信号强度,证明酮康唑、伊曲康唑对内分泌系统的影响较大。有研究表明,酮康唑已被广泛认为会引起肾上腺皮质功能不全[20],与本研究结果一致。一项研究通过对9人肾上腺皮质组织细胞株进行原代培养,探讨酮康唑可能的作用机制,结果表明,酮康唑可能通过降低皮质酮、17α-羟孕酮和雄烯二酮的水平引起肾上腺皮质功能不全[21],因此临床需重点关注。
在抗真菌药的临床使用过程中,可能出现多种与皮肤及皮下组织相关的ADR,包括剥脱性皮炎、红人综合征和皮脂溢出等。本研究结果显示,氟康唑所致皮肤及皮下组织疾病中的ADR上报例数远远多于其余3种药物,其中检测出的网状青斑及大疱性皮炎在药品说明书中尚未收录,而此类ADR信号强度较高,对患者用药的依从性影响较大,在临床应用中需重点关注。此外,酮康唑在皮肤及皮下组织疾病中的ADR信号强度明显强于其余3种药物,如脂溢性皮炎、头皮屑、体癣、毛发结构异常等,提示该药物引起皮肤及皮下组织ADR的关联性较高。酮康唑是一种中度刺激性药物,外用酮康唑引起的皮肤及皮下组织疾病可能归因于其引起的过敏性接触性皮炎和光敏性接触性皮炎[22]。临床上使用该药物时也应注意原发疾病与ADR的鉴别。
基于FAERS的ADR监测存在一定的局限性,如由于无法确认服用药物的人数,因此不能计算ADR的发生率;缺少临床资料,如疾病的严重程度和持续时间等; 存在一定的漏报和重复报告问题[23]。尽管如此,通过该系统进行大量数据提取,运用比值失衡测量法检测到的ADR信号,仍可能反映药物与ADR 信号的统计学关联性,具有一定的参考价值[22],是目前评估药物安全风险中一种高效、便捷的方式。
综上,本研究通过对FAERS数据库ADE报告进行数据挖掘与分析,探索唑类抗真菌药物氟康唑、酮康唑、伊曲康唑和伏立康唑在真实世界临床应用中的常见及严重的ADR的差异。医务人员在使用上述4种唑类药物时,应注重其ADR的差异性,在临床使用过程中,对氟康唑、伊曲康唑、伏立康唑引起出血性膀胱炎,氟康唑引起网状青斑等说明书中未提及、但真实世界发生率又较高的ADR,以及伊曲康唑导致的类库欣综合征和肾上腺抑制等虽然说明书中有提及、但检测结果呈异常强信号的ADR应重点关注。
参考文献
[ 1 ] PU S,NIU S,ZHANG C,et al. Epidemilogy,antifungal suscepti-bilities,and risk factors for invasive candidiasis from 2011 to 2013 in a teaching hospital in southwest China[J]. J Microbiol Immunol Infect,2017,50(1):97-103.
[ 2 ] OREN I,PAUL M. Up to date epidemiology,diagnosis and management of invasive fungal infections[J]. Clin Microbiol Infect,2014,20(6):1-4.
[ 3 ] 唐卫萍,宋丹妮,李志玲.唑类抗真菌药物临床应用现状[J].中国实用医药,2009,4(29):222-223.
[ 4 ] 侯永芳,王玲,郭秀花,等.信号检测在药品不良反应监测系统中的应用[J].中国药物警戒,2012,9(9):539-541.
[ 5 ] WEISS-SMITH S,DESHPANDE G,CHUNG S,et al. The FDA drug safety surveillance program:adverse event reporting trends[J]. Arch Intern Med,2011,171(6):591-593.
[ 6 ] FUJIMOTO M,HOSOMI K,TAKADA M. Statin-associated lower urinary tract symptoms:data mining of the public version of the FDA adverse event reporting system,FAERS[J]. Int J Clin Pharmacol Ther,2014,52(4):259- 266.
[ 7 ] 汤榕,李林贵,孙维红,等.药品不良反应报告常用信号检测方法应用研究[J].中国药房,2012,23(14):1309-1311.
[ 8 ] 国家食品药品监督管理总局.关于停止生产销售使用酮康唑口服制剂的公告[Z]. 2015-06-02.
[ 9 ] ZHANG XZ,HUANG XE,XU YL,et al. Phase Ⅱ study on voriconazole for treatment of Chinese patients with malignant hematological disorders and invasive aspergillosis[J]. Asian Pac J Cancer Prev,2012,13(5):2415-2418.
[10] 晁娟.吡咯类抗真菌药发生的不良反应情况分析[J].中国医药导刊,2014,16(8):1257-1258.
[11] KRASULOVA K,DVORAK Z,ANZENBACHER P. In vitro analysis of itraconazole cis-diastereoisomers inhibition of nine cytochrome P450 enzymes:stereoselective inhibition of CYP3A [J]. Xenobiotica,2019,49(1):36-42.
[12] 薛阳,李红磊,张薇,等.伏立康唑抗真菌作用研究进展[J].人民军医,2016,59(7):746-748.
[13] SOLIS-MUOZ P,LOPEZ JC,BERNAL W,et al. Voriconazole hepatotoxicity in severe liver dysfunction[J]. J Infect,2013,66(1):80-86.
[14] TASLEEM SH,CAPPELL MS. Voriconazole-induced he- patotoxicity presenting with severe hepatic encephalopathy after liver transplantation[J]. ACG Case Rep J,2019,6(3):1-4.
[15] SAINI L,SEKI JT,KUMAR D,et al. Serum voriconazole level variability in patients with hematological malignancies receiving voriconazole therapy[J]. Can J Infect Dis Med Microbiol,2014,25(5):271-276.
[16] WU SL,WEI TY,LIN SW,et al. Metabolomics investigation of voriconazole-induced hepatotoxicity in mice[J]. Chem Res Toxicol,2019 ,32(9):1840-1849.
[17] SAFDAR A,VAN RHEE F,HENSLEE-DOWNEY JP, et al. Candida glabrata and Candida krusei fungemia after high-risk allogeneic marrow transplantation:no adverse effect of low-dose fluconazole prophylaxis on incidence and outcome[J]. Bone Marrow Transplant,2001,28(9):873- 873.
[18] KRANER MR,AMITAL A,FUKS L,et al. Voriconazole and itraconazole in lung transplant recipients receiving tacrolimus(FK506):efficacy and drug interaction[J]. Clin Transplan,2011,25(2):163-167.
[19] XING Y,CHEN L,FENG Y,et al. Meta-analysis of the safety of voriconazole in definitive,empirical,and prophylactic therapies for invasive fungal infections[J]. BMC Infect Dis,2017,17(1):798-802.
[20] BELLETE B,RABERIN H,MOREL J,et al. Acquired resistance to voriconazole and itraco-nazole in a patient with pulmonary aspergilloma[J]. Med Mycol,2010,48(1):197-200.
[21] VAN DER PAS R,HOFLAND LJ,TAYLOR AE,et al. Fluconazole inhibits human adrenocortical steroidogenesis in vitro[J]. J Endocrinol,2012,215(3):403-412.
[22] CHOI FD,JUHASZ MLW,MESINKIOVSKA NA,et al. Topical ketoconazole:a systematic review of current dermatological applications and future developments[J]. J Dermatolog Treat,2019,30(8):760-771.
[23] KULLDORFF M,DASHEVSKY I,AVERY TR,et al. Drug safety datamining with a tree-based scan statistic[J]. Pharmacoepidemiol Drug Saf,2013,22(5):517-523.
(收稿日期:2019-12-19 修回日期:2020-03-06)
(編辑:刘明伟)
