人脑多形性胶质母细胞瘤的综合基因组分析明确核受体辅激活因子4的预后价值及相关作用机制
2020-07-23张少校李智
张少校 李智
【摘要】 目的:利用生物信息學方法研究核受体辅激活因子4(NCOA4)表达与人脑多形性胶质母细胞瘤(glioblastoma multiforme,GBM)患者总生存时间的关系并探讨其潜在机制。方法:将来源于癌症基因组图谱(TCGA)的152例GBM患者先按三等分法分为NCOA4高、中、低表达组(n=51、50、51),再按最佳界值法分为NCOA4高表达组(n=29)与低表达组(n=123),比较各组生存时间。将来源于人类肿瘤相关基因表达汇编(GEO)数据库的GSE7696数据集的70例GBM患者按三等分法分为NCOA4高、中、低表达组(n=23、24、23)。比较各组生存时间,分析影响GBM患者术后独立预后因素。基于TCGA中GBM患者的level 3 RNASeqV2基因组数据进行基因集富集分析确定NCOA4在GBM中发挥作用的关键机制。结果:TCGA数据库中根据三等分法分组的NCOA4高表达组中位生存时间明显长于NCOA4中、低表达组(P=0.005);根据最佳界值法分组的NCOA4高表达组中位生存时间明显长于低表达组(P<0.001)。GSE7696数据集中NCOA4高表达组中位生存时间明显长于NCOA4中、低表达组(P=0.022)。NCOA4表达水平为影响术后GBM患者的独立预后因素(P=0.041)。在GBM中发挥作用的关键是溶酶体、自然杀伤细胞介导的细胞毒性、趋化因子和Toll样受体相关的信号通路。结论:NCOA4表达增高是预测术后GBM患者预后良好的独立因素,而溶酶体、自然杀伤细胞介导的细胞毒性、趋化因子和Toll样受体作用的增强可能是NCOA4在GBM中影响预后的重要作用机制。
【关键词】 核受体辅激活因子4 生物信息学 多形性胶质母细胞瘤
[Abstract] Objective: To study the relationship between the expression of nuclear receptor coactivator 4 (NCOA4) and the total survival time of patients with human brain glioblastoma multiforme (GBM) by bioinformatics method and to explore its potential mechanism. Method: The 152 GBM patients derived from the cancer genome atlas (TCGA) were firstly divided into NCOA4 high, medium and low expression groups (n=51, 50, 51) according to the trisection method, and then divided into NCOA4 high expression group (n=29) and low expression group (n=123) according to the optimal cutoff method. The survival time of each group was compared. The 70 GBM patients from the GSE7696 dataset of the human tumor related gene expression omnibus (GEO) database were divided into NCOA4 high, medium and low expression groups (n=23, 24, 23). Survival time of each group was compared, and independent prognostic factors affecting postoperative GBM patients were analyzed. Gene set enrichment analysis was performed based on level 3 RNASeqV2 genomic data of GBM patients in TCGA to determine the key mechanism of the role of NCOA4 in GBM. Result: In TCGA database, the median survival time of the NCOA4 high expression group grouped according to the method of trisection were significantly higher than those of the NCOA4 medium and low expression group (P=0.005). The median survival time of the NCOA4 high expression group grouped according to the optimal cutoff method was significantly higher than that of the low expression group (P<0.001). The median survival time of the NCOA4 high expression group in GSE7696 data set were significantly higher than those of the NCOA4 medium and low expression group (P=0.022). The expression level of NCOA4 was an independent prognostic factor for the postoperative GBM patients (P=0.041). The key roles in GBM were lysosomes, natural killer cell-mediated cytotoxicity, chemokines, and Toll-like receptor related signaling pathways. Conclusion: The increased expression of NCOA4 is an independent factor in predicting the favourable prognosis of postoperative GBM patients, and lysosomes, natural killer cell-mediated cytotoxicity, chemokines and Toll-like receptor enhancement may be the important mechanisms of NCOA4 affecting the prognosis in GBM.
[Key words] Nuclear receptor coactivator 4 Bioinformatics Glioblastoma multiforme
First-authors address: Panjin City Centre Hospital, Panjin 124010, China
doi:10.3969/j.issn.1674-4985.2020.17.038
多形性胶质母细胞瘤(glioblastoma multiforme,GBM)作为颅内恶性程度最高的恶性肿瘤,患者多于确诊2年内死亡,除血供丰富、高度浸润以及逃逸攻击等机制外,其独特的发生发展机制备受广大研究者关注[1]。研究表明GBM不但进展迅速,而且异质性显著,因此在大规模数据分析的基础上,深入探讨GBM发生发展的相关因素及分子机制,对于优化GBM的诊治和改善患者的生存,具有重要的临床指导意义[2]。核受體辅激活因子4(nuclear receptor coactivator 4,NCOA4),也被称为雄激素受体相关蛋白70(ARA70),可与雄激素受体AR结合并依赖于配体的结合增强AR及相关基因的转录活性,也可以作为过氧化物酶体增殖物激活受体-γ的共激活因子以配体非依赖性的方式发挥转录辅助功能[3-4]。最初是作为RET融合基因在一系列乳头状甲状腺癌被发现的。后来研究表明NCOA4为多种核受体的共激活因子,是调节铁代谢的重要蛋白,在调节细胞内和系统内铁稳态中发挥重要作用[5]。近年来研究表明,NCOA4被发现表达于多种恶性肿瘤如胰腺癌,膀胱癌等并影响恶性肿瘤的发生、发展,对恶性肿瘤细胞的增殖、凋亡、血管生成、转移等多种生物学行为发挥作用[6]。但关于NCOA4在GBM中的表达及预后,尚无报道。本研究通过整合在线高通量数据,利用单因素和多因素的生存分析结合基因集富集分析(GSEA),明确NCOA4表达对GBM术后患者预后的预测作用以及潜在作用机制,现报道如下。
1 资料与方法
1.1 数据筛选 生物信息学研究数据的主要筛选条件:(1)具有完整的生存资料;(2)基因表达谱数据完整。首先,通过检索人类肿瘤相关基因表达汇编(GEO)数据库(http://www.ncb.nlm.nih.gov/geo),获取GBM样本GSE7696数据集的数据;其次,检索并获取癌症基因组图谱(TCGA)数据库(https://tcga-data.nci.nih.gov/tcga/)中GBM患者的level 3 RNASeqV2基因组数据。
1.2 方法
1.2.1 初步确定NCOA4表达与GBM患者总生存的关系 针对来源于TCGA的患者数据,首先对GBM组织中NCOA4表达量进行排序,通过三等分法,以66.67%和33.33%作为NCOA4表达量分级的界值将GBM患者分为高、中、低表达三组,结合患者的总生存率,分别采用R/survival函数包survfit和plot函数以及survdiff函数先后绘制Kaplan-Meier(K-M)生存曲线并进行log-rank检验计算P值。然后根据R/Maxstat函数包获取该数据集中NCOA4表达量分级的最佳界值,再按最佳界值法将GBM患者分为NCOA4高表达组和低表达组,重复上述K-M log-rank检验,以P<0.05为差异有统计学意义。由此先后通过三等分法和最佳界值法初步确定NCOA4表达与GBM患者总生存的关系。
1.2.2 GEO数据集对TCGA数据生存分析的结果进行外部验证 针对来源于GEO数据库的GSE7696数据集,先对GBM组织中NCOA4表达量进行排序,通过三等分法,以66.67%和33.33%作为界值将GBM患者分为高、中、低表达三组。结合患者总生存时间,先利用K-M log-rank 法绘制生存曲线并计算P值,再进行Cox多因素回归分析,与患者年龄,性别和术后治疗方案等指标进行协同分析,确定NCOA4表达对于术后GBM患者总生存的独立预测价值。以P<0.05作为差异显著的判定标准。
1.2.3 基因集富集分析(GSEA)明确NCOA4在GBM中的关键作用机制 利用TCGA数据集,首先根据GBM组织中NCOA4表达量的中位值(2.97)将患者分为低表达组和高表达组,再利用GSEA 2.2.2版软件,以MsigDB数据库中的h.all.v5.2.symbols.gmt数据集为参照基因集,设置随机组合次数为1 000次,进行加权富集统计分析,找出与NCOA4表达水平显著相关的基因集,即为NCOA4参与的信号通路。P<0.05且错误发现率(false discovery rates,FDR)<0.25作为显著富集基因集的判定标准。
2 结果
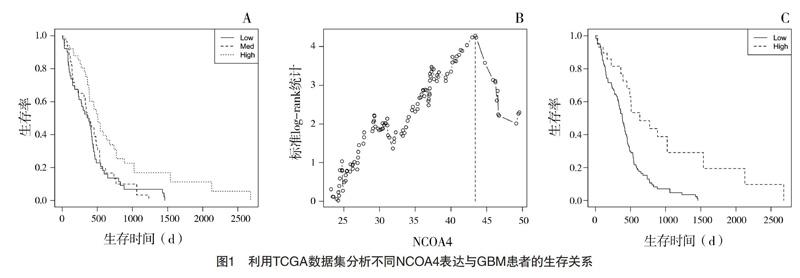
2.1 TCGA数据库中不同NCOA4表达与GBM患者的生存关系 TCGA数据库中共152例GBM患者[男98例,女54例,年龄为60.5(51.8,70.0)岁],根据三等分法分为NCOA4高、中、低表达组(n=51、50、51),进一步K-M生存分析显示NCOA4高表达组生存时间为510(388,737)d明显长于NCOA4中、低表达组的384(329,505)和382(239,442)d,差异均有统计学意义(P=0.005),见图1A。其次,利用最佳界值法,以NCOA4表达量分级的最佳界值4.3(maxstat函数分析,见图1B)作为标准,将GBM患者分为NCOA4高表达组(29例)和低表达组(123例),K-M分析进一步证实NCOA4高表达组的生存时间为632(489,未达到)d明显长于低表达组的384(335,442)d,差异有统计学意义(P<0.001),见图1C。
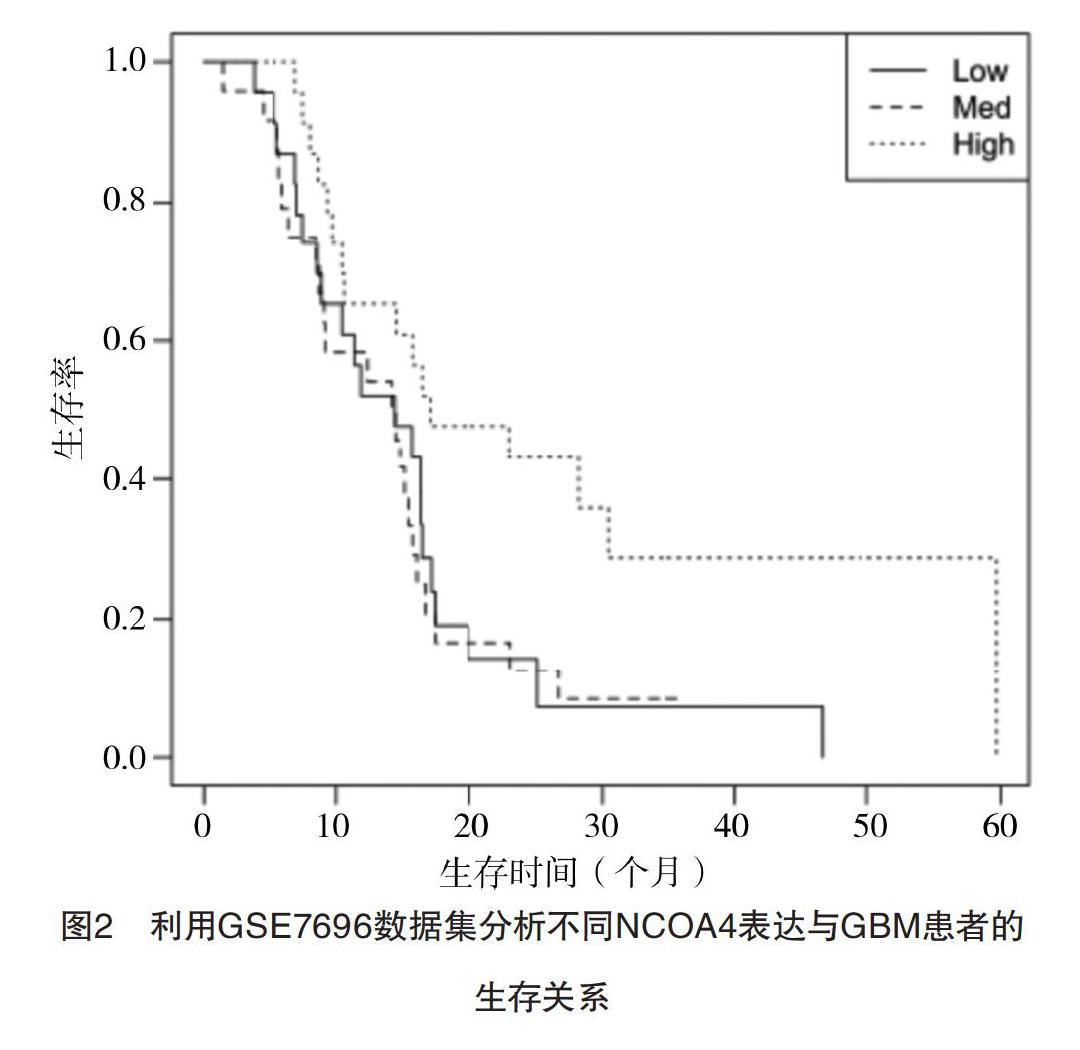
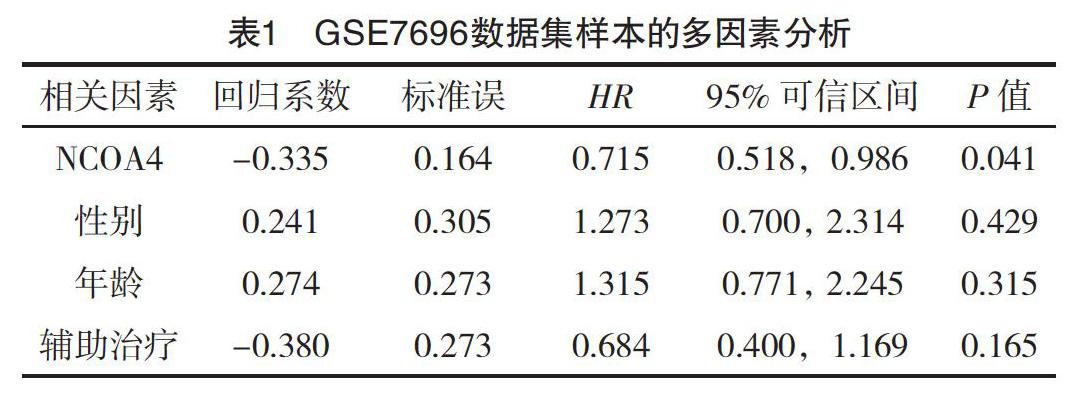
2.2 GSE7696数据集中不同NCOA4表达与GBM患者的生存关系及预后影响因素 根据GSE7696中70例术后GBM患者的series matrix数据和生存信息进行分析,其中男51例,女19例;年龄为52.2(45.6,57.1)岁。NCOA4高表达患者23例,中表达患者24例,低表达患者23例。NCOA4高表达患者生存时间为17.0(10.6,未达到)个月明显长于中、低表达患者的14.3(9.1,16.0)个月、14.3(8.9,17.3)个月(P=0.022),见图2。Cox多因素回归分析显示,NCOA4表达水平为影响术后GBM患者的独立预后因素(P=0.041),NCOA4高表达的患者预后良好,见表1。
2.3 GSEA确定NCOA4在GBM的关键作用机制 NCOA4高表达与KEGG_LYSOSOME,KEGG_NATURAL_KILLER_CELL_MEDIATED_CYTOTOXICITY,KEGG_TOLL_LIKE_RECEPTOR_SINGALING_PATHWAY和KEGG_CHEMOKINE_SINGALING_PATHWAY等基因集显著相关(P<0.01),因此,参与溶酶体、自然杀伤细胞介导的细胞毒性、趋化因子和Toll样受体等信号通路为NCOA4影响术后GBM患者预后的关键机制。见图3。
3 讨论
铁死亡(ferroptosis)是2012年美国Brent R. Stockwell实验室发现的一种新的细胞死亡方式[7]。铁死亡同其他细胞死亡方式一样受信号通路的调节,其发生的关键是铁的累积和脂质过氧化反应。铁蛋白(ferritin)能夠调节铁离子诱导的铁死亡的发生,它能被特异性受体NCOA4识别,从而形成自噬小体参与溶酶体的降解,并导致游离铁离子的释放[8]。近年来对铁死亡的深入研究表明,细胞的铁死亡与癌症、肾衰竭、神经退行性疾病、心脑血管疾病等多种疾病相关[8]。另外目前研究发现恶性胶质瘤细胞比其他肿瘤细胞能够更有效地从微环境中摄取铁,铁死亡的失控可能与胶质瘤的恶性进展存在密切的关系[9]。研究表明在铁死亡中NCOA4是一种选择性的运载受体,可用于铁蛋白的选择性自噬;同样NCOA4的遗传抑制可抑制铁蛋白降解,并抑制铁死亡。Gao等[10]通过RNAi技术,发现一批自噬相关基因参与调解铁死亡过程,敲除自噬相关基因ATG5、ATG7或NCOA4可以抑制铁蛋白自噬性降解过程,从而抑制细胞铁死亡;过度表达NCOA4则可以通过促进铁蛋白降解诱导细胞铁死亡。本文首先利用TCGA和GEO数据集,结合生物信息学分析方法,证实在GBM组织中,NCOA4高表达患者的生存期更长,两个数据集的结果基本一致。结果提示GBM组织中NCOA4低表达者预后较差,故NCOA4表达可作为评价GBM患者预后的指标。
胶质瘤发生发展涉及众多通路相互作用形成信号通路网共同发挥作用,已有研究表明,NK介导的细胞毒性信号通路可调节NK细胞的细胞毒性作用起到抑癌作用,减弱NK细胞对胶质瘤细胞的识别和杀伤,引起胶质瘤细胞的过度增殖并最终影响胶质瘤患者的预后[11]。另外多种趋化因子及其受体在胶质瘤中表达升高,可促进胶质瘤细胞侵袭、增殖、存活、上皮间质转化[12]。研究发现在铁自噬发生过程中需要NCOA4作为货物受体特异性的识别铁蛋白与自噬小体结合,通过自噬-溶酶体途径可调控铁自噬的发生[13]。同时Toll样受体信号通路对胶质瘤的生长、分化、入侵及迁移至关重要,激活Toll样受体信号通路,导致胶质瘤细胞过度增殖、侵袭力增强,最终影响患者预后[14]。为研究NCOA4高表达状态所激活的信号通路对胶质瘤细胞生物学功能的影响,本文采用基因富集分析进行相关研究,发现当NCOA4高表达时可激活上述四条影响胶质瘤细胞生物学功能的重要信号通路。
综上所述,本研究利用TCGA及GEO数据库推测出GBM组织NCOA4高表达提示GBM患者预后更好,NCOA4可能参与调节溶酶体、自然杀伤细胞介导的细胞毒性、趋化因子和Toll样受体四条信号通路,最终影响患者预后。本文通过研究调控网络对胶质瘤细胞生物学功能的影响,探索胶质瘤的发病机制,为寻找胶质瘤综合治疗的新靶点提供帮助。
参考文献
[1] Morgan L L.The epidemiology of glioma in adults:a “state of the science” review[J].Neuro Oncol,2015,17(4):623-624.
[2] Jiang T,Mao Y,Ma W,et al.CGCG clinical practice guidelines for the management of adult diffuse gliomas[J].Cancer Lett,2016,375(2):263-273.
[3] Monaco C,Visconti R,Barone M V,et al.The RFG oligomerization domain mediates kinase activation and re-localization of the RET/PTC3 oncoprotein to the plasma membrane[J].Oncogene,2001,20(5):599-608.
[4] Lanzino M,De Amicis F,McPhaul M J,et al.Endogenous coactivator ARA70 interacts with estrogen receptor alpha(ERalpha)and modulates the functional ERalpha/androgen receptor interplay in MCF-7 cells[J].J Biol Chem,2005,280(21):20421-20430.
[5] Mertens C,Mora J,?ren B,et al.Macrophage-derived lipocalin-2 transports iron in the tumor microenvironment[J].Oncoimmunology,2018,7(3):e1408751.
[6] Bellelli R,Federico G,Matte A,et al.NCOA4 Deficiency Impairs Systemic Iron Homeostasis[J].Cell Rep,2016,14(3):411-421.
[7] Mancias J D,Pontano Vaites L,Nissim S,et al.Ferritinophagy via NCOA4 is required for erythropoiesis and is regulated by iron dependent HERC2-mediated proteolysis[J].Elife,2015,4:10308.
[8] Mancias J D,Wang X,Gygi S P,et al.Quantitative proteomics identifies NCOA4 as the cargo receptor mediating ferritinophagy[J].Nature,2014,509(7498):105-109.
[9] WANG H,AN P,XIE E,et al.Characterization of Ferroptosisin Murine Models of Hemochromatosis[J].Hepatology,2017,66(2):449-465.
[10] Gao M,Monian P,Pan Q,et al.Ferroptosis is an autophagic cell death process[J].Cell Res,2016,26(9):1021-1032.
[11] Haspels H N,Rahman M A,Joseph J V,et al.Glioblastoma Stem-Like Cells Are More Susceptible Than Differentiated Cells to Natural Killer Cell Lysis Mediated Through Killer Immunoglobulin-Like Receptors-Human Leukocyte Antigen Ligand Mismatch and Activation Receptor-Ligand Interactions[J].Front Immunol,2018(9):1345.
[12] Hughes C E,Nibbs R J B.A guide to chemokines and their receptors[J].FEBS J,2018,285(16):2944-2971.
[13] Goodall M,Thorburn A.Identifying specific receptors for cargo-mediated autophagy[J].Cell Res,2014,24(7):783-784.
[14] Sinha S,Koul N,Dixit D,et al.IGF-1 induced HIF-1α-TLR9 cross talk regulates inflammatory responses in glioma[J].Cell Signal,2011,23(11):1869-1875.
(收稿日期:2020-04-10) (本文編辑:田婧)
