仔猪肺、肠组织离体感染模型的建立及应用
2020-07-22黄石磊谢录异余秋寒宋振辉
黄石磊,谢录异,余秋寒,冉 玲,杨 洋,王 凯,宋振辉*
(1.西南大学 动物科学学院,重庆 402460;重庆三峡职业学院,重庆 404000;3.重庆安全技术职业学院, 重庆 404100)
猪流行性腹泻病毒(porcine epidemic diahorrea virus,PEDV)、猪传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV)和猪呼吸道冠状病毒(porcine respiratory coronavirus,PRCoV)同属于冠状病毒科,其中PEDV、TGEV常引起猪的急性肠道传染病,临床症状以呕吐、腹泻、食欲下降、脱水为主,感染20日龄以内的哺乳仔猪死亡率高达95%以上[1];PRCoV主要侵害2~3 周龄阶段正处于哺乳期的仔猪,感染率极高,但发病率和病死率低,感染期间表现轻微的呼吸道炎症,间发性咳嗽和气喘[2]。单纯的呼吸道冠状病毒感染只表现短期咳嗽,并无其他表现。许多研究发现,我国各地发生和流行的猪病毒腹泻疾病多是PEDV、TGEV 、PRCoV等混合感染引起猪死亡[3]。目前在这些病原方面的研究多局限细胞水平上,缺少一个能模拟在体内状态的模型,因此建立病原离体感染的模型,对于研究病原感染的机制具有重要意义。
精密组织切片(precision-cut tissue slices,PCTS)做为一种离体模型于1923年首次发明,用于测量肿瘤组织中细胞代谢和耗氧量,以及研究包括人类在内的各种器官和物种的氨基酸代谢[4]。目前国内少有对精密切割组织切片的研究,仅有的研究也局限于精密肝切片上的代谢、药理、毒理和转运等方面。如,李婧婷等[5]利用精密肝切片(PCLS)技术,创建醋氨酚所致肝切片损伤的体外模型,并探讨CYP2E1活性变化对肝损伤的调节作用;郭喻等[6]用于体外肝脏异物代谢和药物相互作用研究;国外则早已运用此技术,但热点多集中于代谢、药理、毒理、转运,药物评估和免疫反应等方面的研究,少数集中于对病原感染的机制研究,如DARSANIYA等[7]使用精密肠切片作为培养系统,分析禽流感病毒在分化肠上皮细胞的感染;DELGADO等[8]利用精密切割肺片作为离体模型研究了新生猪气管细胞,肺泡巨噬细胞和精密切割肺片对H3N2亚型猪流感病毒的先天免疫反应。然而,国内则未曾将其应用于动物感染模型的研究。
本研究首先建立仔猪肺、肠离体感染模型,通过对TGEV、PEDV和PRCoV 3种病毒的感染试验的初探,可为病毒机制的研究奠定基础,也能为病毒疾病的防控提供理论依据,减少给养猪业带来严重的经济损失。
1 材料与方法
1.1 试验材料Williams培养基、L-谷氨酰胺、1×RPMI1640、DMEM basic (1×)均购自美国 GIBCO生物技术公司;RPMI.1640培养液(2×)购自吉诺生物医药技术有限公司;硫酸庆大霉素、两性霉素B购自北京Solarbio生物技术公司;低熔点琼脂糖购自生工生物工程(上海)股份有限公司;OCT冷冻包埋剂购自日本樱花公司;StayBriteTMHighly Stable ATP Bioluminescence Assay Kit购自美国BioVision公司;HEPES购自北京鼎国昌盛生物技术有限公司;FETAL BOVINE SERUM购自中国CLARK Bioscience公司;Avicel RC 591购自上海富曼实食品科技有限公司;其他化学试剂均为国产分析纯产品。PEDV CV777、TGEV GFP、PRCoV均为实验室保存毒株。
1.2 仔猪小肠及肺精密切片感染模型的制作
1.2.1肠精密切片 安乐死仔猪后迅速剖解,小心去除粘附的脂肪组织并剪取十二指肠(大约在胃远端前10 cm),回肠(回盲连接处近端约10 cm),空肠(十二指肠和回肠之间)肠管。然后将这些小肠切成几段,用塑料移液管通过管腔吸取冰冷的KHB进行轻轻冲洗小肠直至干净,将其转移到冰冷的KHB中;将肠断的一头用夹子夹住,吸取37℃的3%的低熔点琼脂糖从未夹住一头注入肠腔内,使小肠充盈起来,两头结扎后置于冰冷的KHB溶液中等待5~10 min至琼脂糖凝固,随后对肠断包埋固定后置于切片机切片,厚度为150~450 μm最为适宜,切出肠片后迅速转移至37℃含有WME的24孔板中,每孔1~2片在预孵育1~3 h后更换新的培养基以恢复ATP含量并去除细胞碎片;每24 h更换1次新的培养基。
1.2.2肺精密切片 安乐死仔猪后将肺叶迅速取出,找到肺叶的气管口,用不锈钢的平口长针轻缓的顺着主气管的方向插入,注意插入过程一定要小心平缓,防止平口针头戳穿气管。然后用50 mL的注射器吸取预先预热在37℃培养箱中的1.5%的低熔点琼脂糖,连接平口针头,缓缓向肺内注入1.5%的低熔点琼脂糖,边注入边把平口针头缓缓向外移动,直到整个肺叶充盈起来,注意不要过分充盈,防止肺叶充盈过度而破裂;夹住气管口包埋与冰盒中,带琼脂糖充分凝固,随后修剪肺叶,找到单个支气管处进行切割,后续操作参照肠精密切片。
1.3 肠精密切片活力测定(ATP)的测定各取0,3,12,24,48,72 h的肠切片3片放入1.5 mL的EP管中,存于-80℃;取出切片,每管加入100 μL Reaction Buffer.将收集的肠切片置于1.5 mL EP管内,使用 TGrinder第3代变速组织碾磨器碾磨器间歇操作破碎肠切片样本,然后继续在冰上裂解5 min 后,12 000 r/min 离心3 min 后取上清;根据说明书,在避光,无菌条件下测定标准样品和试验样品,最后使用多功能酶标仪测定read luminescence (L),然后计算样品ATP含量,绘制曲线图。
1.4 肺精密切片活力测定EBSEN等[9]对纤毛上皮的搏动进行了定期监测。发现纤毛上皮的搏动是一个可靠的评价PCLS活性的可行性指标。因此,我们在切片制作完成3 h后更换新的培养基,在显微镜下观察纤毛搏动为100%的肺切片,并做好标记,之后每隔24 h于镜下观察做好标记的肺切片的纤毛搏动情况,并记录纤毛搏动情况,绘制肺切片活性图。
1.5 病毒感染经活性检测合格后,肠切片感染PEDV CV777、TGEV GFP,肺切片感染PRCoV。弃去WME维持液,PBS洗2次, 将TGEV GFP病毒液用WME按照1∶2稀释好后,每孔接种200 μL;PEDV CV777病毒液用WME(含25 μg/L的胰酶)按照1∶3稀释,每孔接种200 μL;轻轻晃动使其病毒液均匀,接种于肠切片上,置于二氧化碳培养箱中,37℃静置培养1 h,病毒孵育期间,每隔15 min 晃动1次24孔板;1 h后,弃去病毒液,更换WME维持液(含有工作浓度为1 mg/L克霉唑,10 mg/L 恩诺沙星,2.5 mg/L两性霉素B,50 mg/L硫酸庆大霉素和1%的青链霉素),其中PEDV CV777感染组更换的WME维持液还含有25 μg/L的胰酶,每孔1 mL,采集培养液上清1 mL,并记为0 h的切片上清液样品,之后分别按2,6,24,48 h采取的切片培养上清液,做好标记密封存于-80℃。
PRCoV液与RPMI 1640按照1∶1稀释后置于冰上暂存;选取纤毛搏动为100%单个气管的肺切片,弃去旧的培养液,无菌的PBS洗3次,每孔加入200 μL预先稀释好的PRCoV液,置于37℃,5% CO2培养箱中孵育1 h,期间每隔15 min晃动1次;1 h后,更换新的RPMI 1640,每孔1 mL,继续放入37℃,5% CO2培养箱中培养。
1.6 上清液中病毒PCR检测将采集病毒液反复冻融3次后按说明书进行RNA提取,反转录后经行PCR扩增,引物信息见表1,PCR扩增反应按13 μL 体系进行:7.375 μL RNase Free H2O,2.5 μL 5×PCR Buffer,0.5 μL TaKaRa ExHs,上下游引物各0.125 μL,2 μL RT 产物。充分震荡混匀,瞬时离心,反应参数为:94℃预变性3 min;94℃变性30 s,60℃褪火30 s,72℃延伸1 min,进行30个循环;72℃延伸5 min,PCR产物用1 %琼脂糖凝胶电泳分离,通过凝胶成像系统观察并记录结果。

表1 PCR引物序列
1.7 免疫荧光方法检测病毒是否成功感染切片切片在感染病毒的0,6,24,48 h采集切片组织并用冷冻包埋剂包埋后进行液氮冷冻,待完全冰冻后取出,平衡至室温后按免疫荧光染色方法对切片进行荧光染色,最后通过激光共聚焦观察病毒感染情况。
2 结果
2.1 仔猪小肠精密切片的制作7日龄仔猪小肠的肠腔直径大小存在特殊性,为保证仔猪小肠结构的完整性,因此将洗净的小肠填充3%的低熔点琼脂糖,修饰成需要的组织块之后,包埋在与切片机大小匹配的包埋盒之后再进行切片(图1),能得到具有相同的厚度,颜色均匀和边缘光滑的小肠切片,在普通倒置显微镜下呈现完整的结构(图2)。

图2 仔猪小肠精密切片绒毛微结构图 (×10)
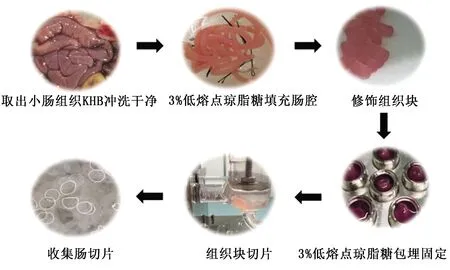
图1 仔猪小肠精密切片制作图
2.2 仔猪肺精密切片的制作结果图将断奶仔猪处死后,用止血钳夹住总支气管立即取出整个肺脏后,在气管里注入37℃的1.5%低熔点琼脂糖之后,置于冰盒凝固,凝固之后取出肺组织进行修饰,然后置于切片机进行切片,将切好的肺切片置于预先加入培养基的24孔板中(图3),最终得到了大小一致,厚度均匀,大多为单个支气管的仔猪肺精密切片,普通倒置显微镜下能看到完整的支气管纤毛,肺纤毛搏动剧烈(图4)。
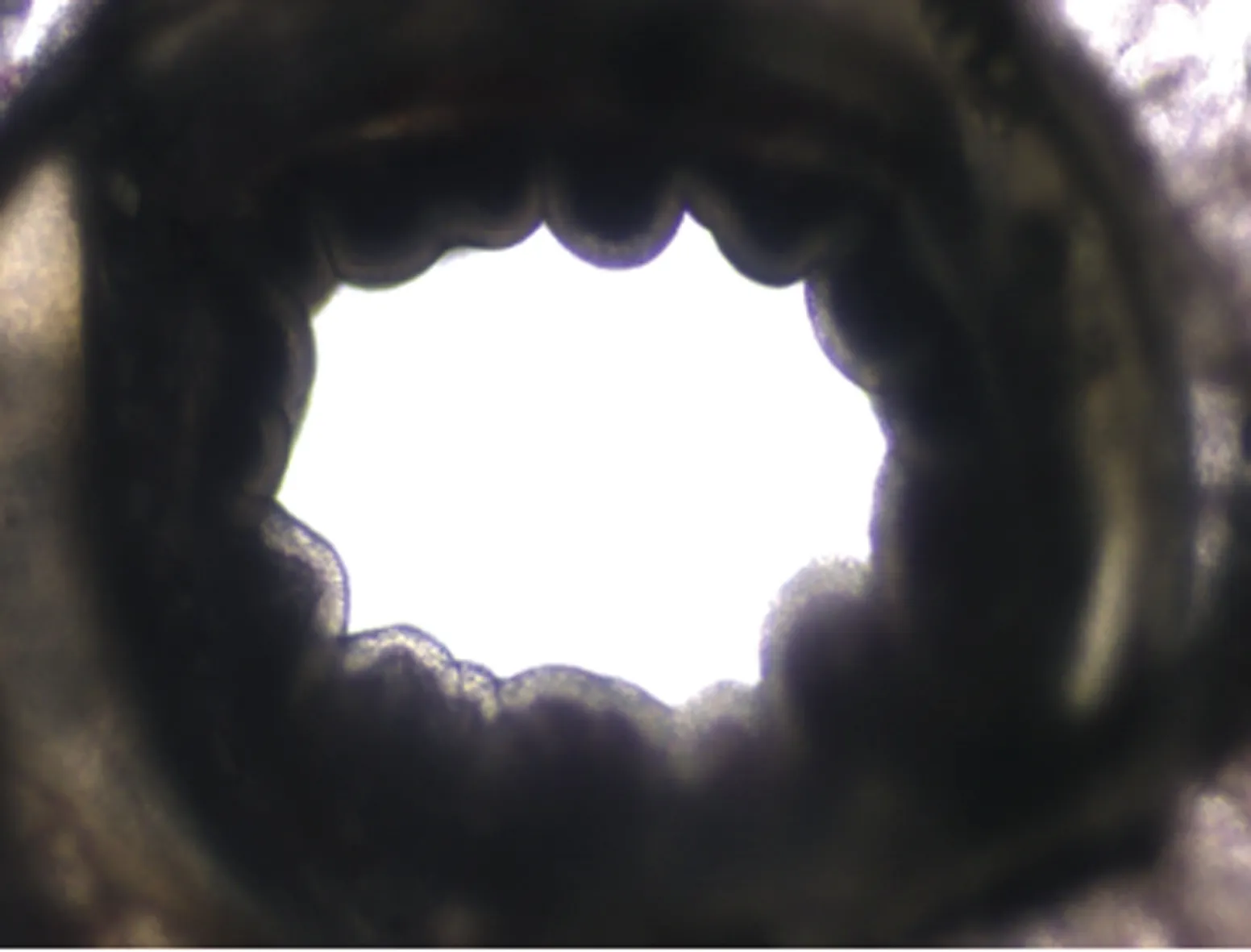
图4 仔猪肺精密切片支气管结构图(×20)
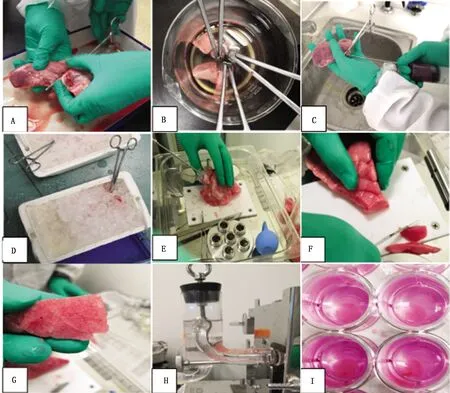
图3 仔猪肺精密切片制作过程 A.取出肺脏用止血钳夹住肺叶;B.手术刀切除止血钳夹住的肺叶后放入冰冷的无菌PBS中;C.1.5%的低熔点琼脂糖注入到肺组织中;D.将低熔点琼脂糖填充的肺脏置于冰盒中凝固;E.从冰盒中取出肺脏,松开止血钳;F.切除肺脏边缘狭窄部分;G.找到大小适宜的单个支气管,用组织取芯刀切割;H.修饰好的肺组织块置于切片机上切片;I.挑选切好的肺切片置于装有培养液的24孔板中
2.3 仔猪肠精密切片的活性测定首先根据ATP检测试剂盒得出ATP检测的标准曲线,随后根据标准曲线计算出小肠切片当中ATP的确切含量,结果如图5所示,在仔猪小肠精密切片刚制作完成时,ATP含量最高,随着时间的延长,仔猪小肠精密切片ATP含量在逐渐下降,在12 h时,ATP含量降低的最快,48 h后,仔猪小肠精密切片含量逐渐下降至零。由于ATP作为最重要的能量分子,在细胞凋亡时ATP水平也下降,所以根据ATP含量,推测出小肠切片的活性在0 h时最大,随着培养时间的延长,小肠切片的活性也随之降低,在48 h后逐渐丧失活性。
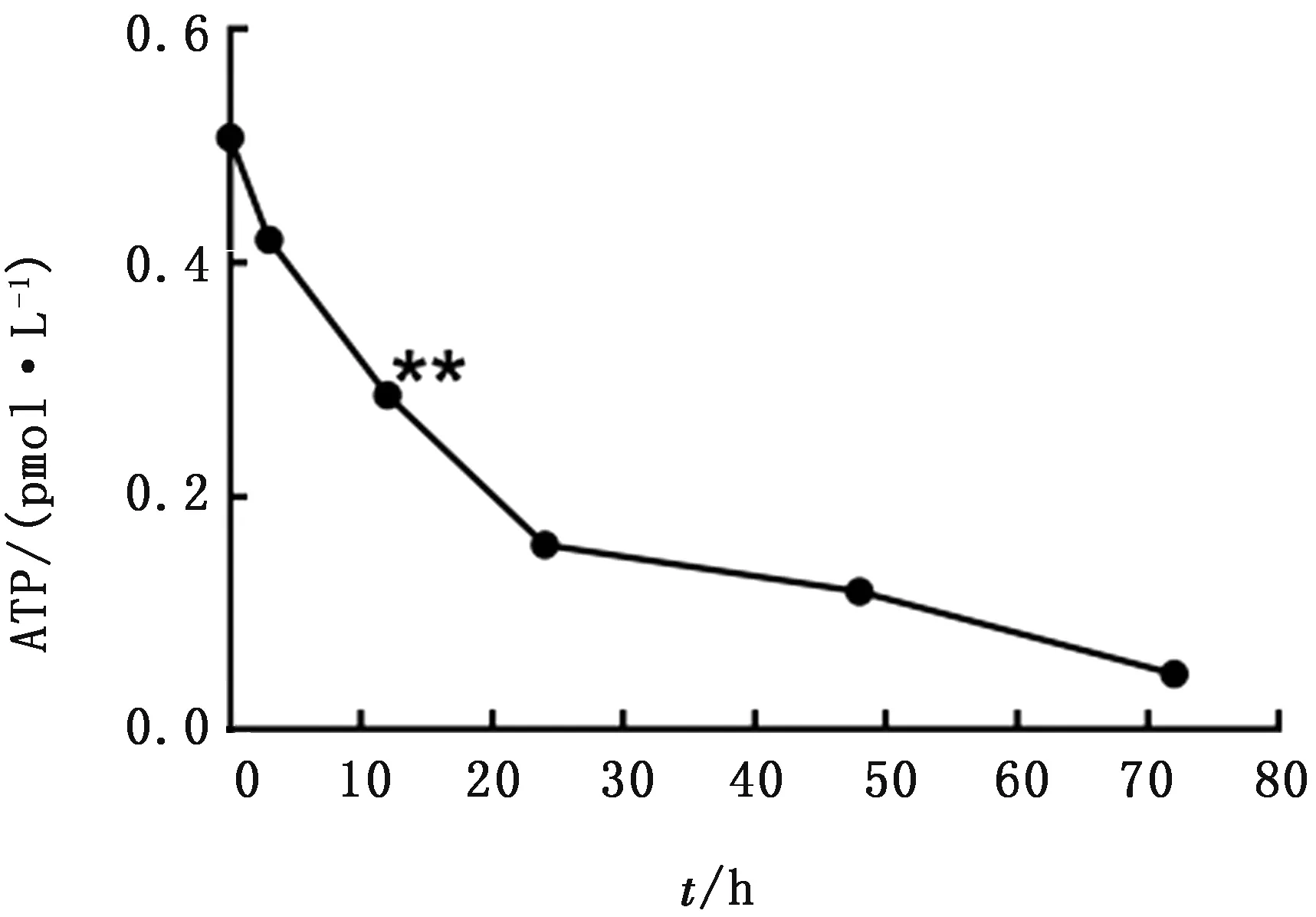
图5 仔猪小肠精密切片ATP含量
2.4 仔猪肺精密切片的活性测定将切割好的仔猪肺精密切片置于5%二氧化碳培养箱中培养,每天观察肺纤毛搏动情况,绘制肺精密切片的活性图(图6),可知,仔猪肺精密切片的在96 h内的纤毛活性都为100%,之后逐渐下降到50%左右。表明仔猪肺精密切片具有很好的活性。

图6 仔猪肺精密切片的活性
2.5 切片病毒感染后上清液的PCR检测为验证病毒已成功感染切片,我们分别在感染病毒后的2,6,24,48 h检测上清液中病毒存活情况,结果如图7所示,PEDV CV777在750~500 bp之间有1条带,TGEV GFP则在750~1 000 bp之间有1条带,PRCoV则在1 300 bp有1条带,均与阳性对照组一致,说明精密切片在感染病毒后这几个时间点间,均能在切片上成功复制,并将病毒粒子释放到培养上清液中。
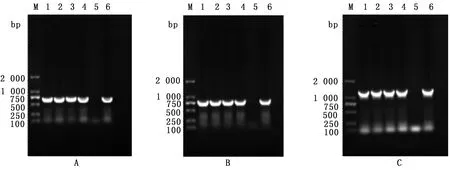
图7 上清液病毒PCR检测 A.仔猪小肠切片上清液PEDV m基因的检测;B.仔猪小肠切片上清液TGEV m基因的检测;C.仔猪肺精密切片上清液PRCoV S基因的检测;M.DL2000 Marker; 1~4.0,24,48,72 h; 5.阴性对照; 6.阳性对照
2.6 免疫荧光检测切片感染后病毒在绒毛上的定殖水平
2.6.1PEDV CV777、TGEV GFP在肠绒毛上的定殖水平 为了进一步验证仔猪小肠精密切片能够作为离体感染模型,将PEDV CV777和TGEV GFP感染感染精密肠切片后,采集阳性对照组和阴性对照组仔猪小肠精密切片,进行免疫荧光染色,其中红色荧光为PEDV N蛋白,绿色荧光为TGEV GFP病毒,蓝色荧光为细胞核。结果显示(图8),在感染后的0,24,48 h都存在红色荧光,说明PEDV CV777成功感染仔猪小肠精密切片,但由于PEDV的感染需要胰蛋白酶,因此随着培养时间的延长小肠切片部分肠段细胞溶解;TGEV GFP感染仔猪小肠精密切片结果显示(图9),在感染后的0,24,48 h 都存在绿色荧光,说明TGEV成功感染上了仔猪小肠精密切片。
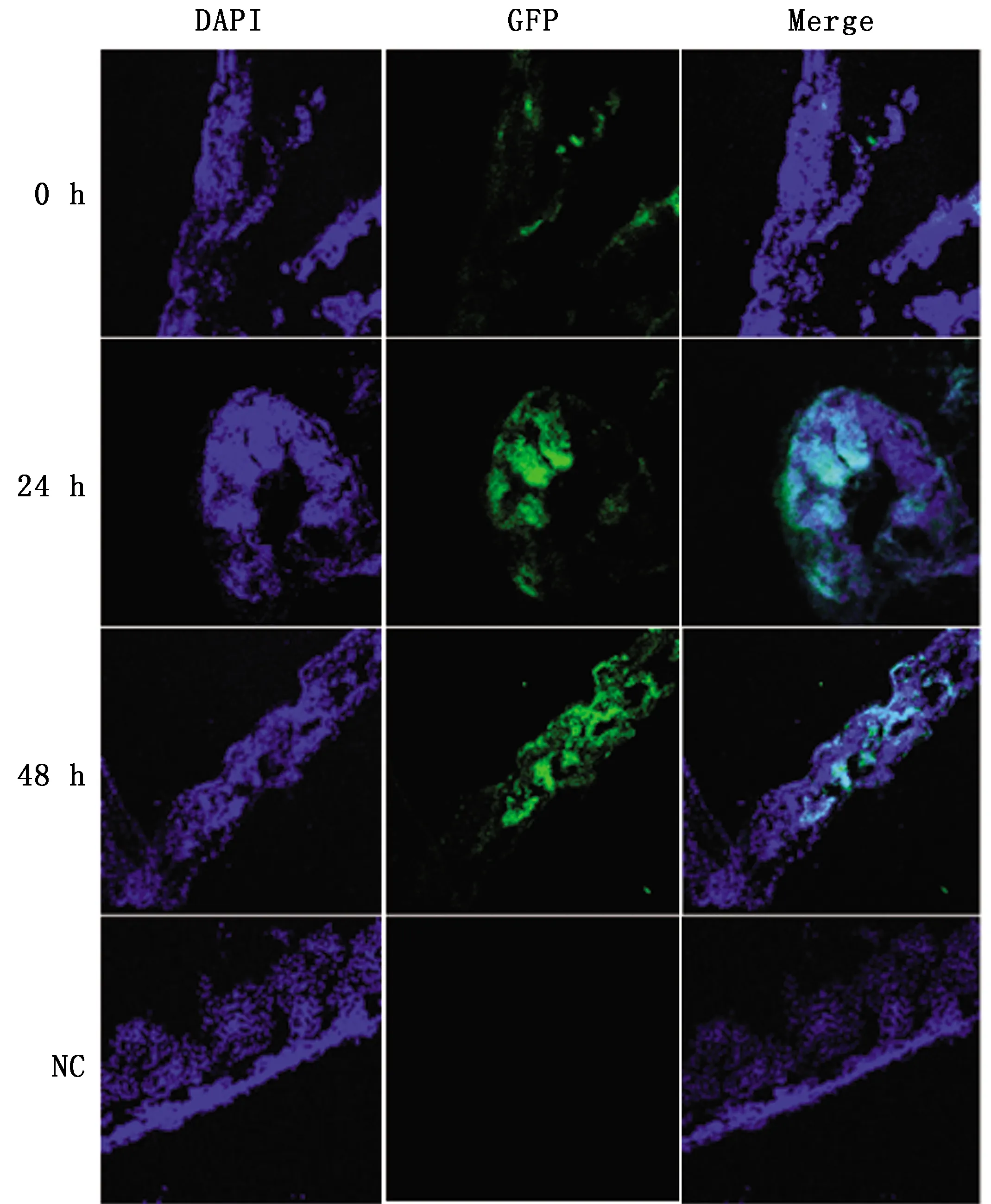
图9 免疫荧光检测TGEV GFP感染PCIS

图8 免疫荧光检测PEDV CV 777感染PCIS
2.6.2PRCoV在肺绒毛上的定殖水平 将PRCoV病毒感染活性为100%的仔猪肺精密切片,采集0,24,48,72 h的肺切片制备冷冻切片进行免疫荧光染色,CY3标记的红色为PRCoV N蛋白,蓝色荧光为DAPI染的细胞核,由图10可知,在0,24,48,72 h的肺切片上都存在PRCoV,随着培养时间的延长,PRCoV的复制增多,表明仔猪肺精密切片作为离体感染模型能成功感染PRCoV。

图10 免疫荧光检测PRCoV感染PCLS
3 讨论
早在20世纪初,精密组织切片就已经被发明,但其研究领域多用于肿瘤以及物质代谢方面的研究,并且切片的活力较差。直到1980年,KRUMDIECK等[10]对切片制作进行了改进,大大延长了组织切片的活力,随后被广泛应用于药理,物质代谢,毒理学等方面的研究。对于精密组织切片的制作,虽然精密切割组织技术在国外已经是非常成熟,且在半自动化的仪器切割使用下,精密组织切片的制作似乎不是什么难点,但是对不同的切片的制作依然存在很多未被解决的问题,尤其是对于一些非实质性器官,比如肠道等等。
本研究在制作仔猪小肠精密切片时,维持小肠切片的活力是非常关键的问题,由于肠道本身就是容纳粪便的容器,存在许多细菌,肠道的清洗是比较关键的一点,既要防止污染,也要维持小肠切片的活力,因此我们使用冷的KHB缓冲液轻柔的冲洗肠道,防止存在冲洗过程中肠道没有营养维持失去活力以及用力过猛将小肠绒毛损坏,通过将肠腔注入3%的37℃低熔点琼脂糖,并嵌入琼脂糖中形成固体状结构,肠道周围的琼脂糖起到保护PCIS免受修饰等处理过程和切割程序的影响,并允许可重复的切割过程,使其具有一致的PCIS厚度。结果表明,小肠精密切片的活力基本能维持在48 h,但是活性不如仔猪肺精密切片的活性,而且小肠绒毛会随着培养时间的延长逐渐脱落,变短。有学者在培养的过程中以及在缓冲液充入合适浓度的氧气,满足切片的最佳可能培养条件,但是,气体流入也可能会导致PCIS的温度问题,如果有条件可以通过使用自动氧合作用的培养箱来改善猪PCIS的培养条件,或者更换培养液的间隔时间以及次数来满足切片活力维持的营养需要[11];但也有研究表明,在鸡的小肠切片制作与培养中,未充入氧气,切片的活力依然能较好的维持[7];
肺是以支气管反复分支形成的支气管树为基础构成的,因此完好无损的取出是决定整个仔猪肺精密切片的制作成功的关键。肺脏虽然作为实质性器官,但是由于肺脏特殊的生理结构,仍然需要灌入37℃低熔点琼脂糖,来充盈肺脏,以便后续切割出均匀一致的肺精密切片,将琼脂糖水平从3%调节至1.5%,这是产生猪PCLS的最佳浓度。如若在肺脏取出过程中损伤了,则无法灌入37℃低熔点琼脂糖来充盈肺脏。
为了验证制作的仔猪精密小肠切片和肺精密切片是否能够作为离体的感染模型,本研究通过使用TGEV、PEDV感染仔猪小肠精密切片和 PRCoV感染仔猪肺精密切片,使用PCR技术和免疫荧光方法验证病毒的感染。研究发现,3种病毒都能成功感染相应的切片,但是在利用冰冻切片进行免疫荧光检测时,发现仔猪小肠精密切片不如肺切片保持完好的形态。研究报道,TGEV、PEDV病毒的感染仔猪会导致小肠上皮细胞脱落[13];也有研究报道,胰蛋白酶可以通过减少细胞膜的功能性整联蛋白的数量来破坏细胞的膜蛋白并降低细胞与吸附的细胞粘附蛋白形成粘附键的能力,使细胞膜受到强烈影响,降低细胞的活性[14]。因此小肠切片的形态受损可能是由于病毒感染导致小肠绒毛脱落,或者是由于病毒孵育时间过长没有按期更换培养液以及培养期间未注入合适浓度的氧气,使仔猪小肠精密切片的活力下降,导致组织细胞死亡脱落,此外,在挑取仔猪小肠精密切片进行包埋时,造成了仔猪小肠精密切片的损坏。通过本试验确定,制作出的精密切片,可作为模拟体内感染试验的离体模型,可为相关疾病的研究带来便利和减少试验动物的使用。
