猪传染性胃肠炎病毒可视化RT-LAMP检测方法的建立
2020-07-22焦韵洁朱海鹏吴小萍贾存瑜周恩民
焦韵洁,张 欣,朱海鹏,吴小萍,贾存瑜,赵 毅,周恩民*,穆 杨*
(1. 西北农林科技大学 动物医学学院,陕西 杨凌 712100;2.农业部兽用药物与诊断技术陕西科学观测实验站,陕西 杨凌 712100;3. 陕西省动物疫病预防控制中心,陕西 西安 710016)
猪传染性胃肠炎(transmissible gastroenteritis of swine,TGE)是冠状病毒科冠状病毒属的猪传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV)引起的以呕吐,水样腹泻,脱水为特征的一种猪急性肠道传染病。不同年龄和品种的猪均可感染,常表现为隐性感染或与其他病毒性腹泻病呈混合感染,暂无有效的治疗药物,严重制约我国养猪业的发展[1-3]。TGE与猪流行性腹泻(porcine epizootic diarrhea,PED)的临床症状表现非常相似,这给该病的快速诊断以及防治都造成了一定困难。因此,建立有效便捷的TGEV快速检测技术对诊断和防治该病均有重要意义。
环介导等温扩增(loop mediated isothermal amplification,LAMP)技术是近年普遍应用于动物疫病病原基因检测的快速等温核酸扩增技术[4-6]。LAMP技术与其他病原核酸检测技术相比,检测仅需普通水浴锅即可进行,并且减少了升温降温环节,具有高效性和基层适用优点。LAMP反应产物是一系列长度大小不一的DNA片段[7],可以采用多种多样的方式对其进行检测,其中直观目测法在口岸,临床动物疫病快速检测领域越来越受到青睐。本研究针对TGEV M基因高度保守区设计引物,建立了TGEV的LAMP检测方法,并以羟基萘酚蓝(hydroxynaphthol blue,HNB)为指示剂,使检测结果可以可视化,操作中不需进行开盖,进一步提高其准确性,并应用建立的方法对42份临床仔猪腹泻小肠及粪便样品进行检测,为快速诊断和防控净化TGE提供有力的技术支撑。
1 材料与方法
1.1 病毒与细胞TGEV,猪流行性腹泻病毒(PEDV),猪轮状病毒(PoRV),猪细小病毒(PPV),猪繁殖与呼吸综合征病毒(PRRSV),猪圆环病毒II型(PCV2)以及ST细胞均由西北农林科技大学动物医学院兽医免疫生物学实验室(以下简称本实验室)保存;pET-21b-M重组质粒菌由本实验室构建,鉴定并保存;感受态细胞DH5α购自TaKaRa公司。
1.2 主要试剂质粒提取试剂盒,EasyPure®Viral DNA/RNA Kit试剂盒为北京全式金生物技术有限公司产品;RNAiso plus,反转录试剂盒,dNTPs,Taq DNA polymerase,DL2000 DNA Marker均为TaKaRa公司产品;DMEM,胰酶,犊牛血清为Gibco公司产品;琼脂糖为Invitrogen公司产品;MgSO4和Bst DNA Polymerase购自New England Biolabs公司;甜菜碱(Betaine)为Sigma公司产品;羟基萘酚蓝(HNB)购自上海麦克林生化科技公司;其他试剂均为国产分析纯或优级纯。
1.3 质粒模板制备取本实验室保存的pET-21b-M重组菌,按1∶100比例接种于氨苄抗性的液体LB培养基中,37℃摇床中过夜活化。次日按1∶50转入大试管,大量摇菌后使用试剂盒提取质粒,测定浓度和纯度后存于-20℃。将测定的质粒浓度代入公式[(6.02×1023)×(mg/L×10-9)/(DNA length×660)=copies/μL]计算质粒拷贝数。
1.4 引物设计与合成在NCBI的Nucleotide数据库中下载Purdue P115(DQ811788.1),Miller M6(DQ811785.1),TH-98(KU729220.1),JS2012(KT 696544),SC-Y(DQ517438.1),WH-1(HQ462571.1)等TGEV毒株[8-9]的M基因序列。利用软件DNAMAN v6.0进行序列比对,筛选6个序列高度保守的区域并M基因全长导入Primer Explorer V4(http://primerexplorer.jp/e)在线设计引物。根据和M基因序列比对结果,挑选引物序列均处于M基因高度保守区域的F3,B3,FIP,BIP,并以pET-21b-M质粒为模板,进行LAMP反应,选取最佳引物对。同时采用 Prime Premier 6.0软件分别根据TGEV M和N基因设计进行PCR检测的引物,引物全部由苏州金维智生物科技有限公司合成(表1),括号中的数字为引物在目标序列上对应的位置,将合成的引物配制成10 μmol/L,分装后置于-20℃ 保存备用。

表1 引物信息
1.5 病毒增殖与核酸提取复苏并用T25细胞瓶培养ST细胞,待细胞达80%融合度时,弃去培养液,用无血清DMEM培养液洗细胞1次,取保存的病毒液500 μL接种于单层细胞,37℃吸附1 h后,加入含2%犊牛血清的DMEM维持液4 mL,5% CO2,37℃条件下培养48~72 h,每日观察细胞病变情况。待70%~80%的细胞出现明显CPE时收获病毒液,参照EasyPure®Viral DNA/RNA Kit说明书提取病毒总RNA。使用PrimeScriptTMRT Reagent Kit,以提取的病毒RNA为模板进行反转录,10 μL反转录体系包括5×PrimeScript Buffer 2.0 μL,PrimeScript RT Enzyme Mix I 0.5 μL,Random 6 mers(100 μmol/L)0.5 μL,Oligo dT Primer (50 μmol/L) 0.5 μL,Total RNA 1 000 ng,用DEPC水补足10 μL。37℃反应15 min;85℃ 5 s 终止反应,4℃保存。得到的cDNA直接用于后续研究或置于-80℃保存备用。
1.6 TGEV LAMP检测方法的建立
1.6.1反应条件优化 采用LAMP方法通用的25 μL 反应体系分别加入:模板DNA 1~4 μL,引物F3,B3,FIP,BIP,10×BstDNA Polymerase Buffer,dNTPs(10 mmol/L),Betaine(5 mol/L),MgSO4(250 mmol/L),BstDNA Polymerase(8 U/μL),ddH2O补足至25 μL。反应温度分别设置为60,61,62,63,64和65℃,反应时间分别设置为15,30,45,60 min,并以ddH2O为阴性对照,进行LAMP反应。反应结束后对产物进行1.5%琼脂糖凝胶电泳,根据产物电泳条带确定最佳反应温度和时间。
1.6.2反应体系优化 分别对内、外引物浓度比,dNTP,Mg2+,甜菜碱浓度进行筛选。分别设定内、外引物(F3/B3与FIP/BIP)浓度比为1∶4,1∶6,1∶8,1∶10;dNTPs 终浓度为0.2,0.4,0.6,0.8,1.0,1.2 mmol/L;Mg2+终浓度为2,4,6,8,10,12 mmol/L;Betaine终浓度分别为0.2,0.4,0.6,0.8,1.0,1.2 mol/L,按确定的最佳反应条件依次进行LAMP反应,根据产物琼脂糖凝胶电泳结果确定最佳反应体系。
1.7 LAMP可视化检测条件优化根据确定的最佳反应条件和最佳反应体系,在反应前向反应体系中加入羟基萘酚蓝指示液(5 mmol/L),设置加入量分别为0,0.5,1.0,1.5,2.0 μL的5个阳性管进行LAMP反应。在阴性对照成立的情况下,通过反应前后颜色变化选择最佳的显色条件,并同步用琼脂糖凝胶电泳验证可视结果的可靠性。
1.8 LAMP方法特异性试验分别以提取的TGEV,PEDV,PoRV,PPV,PRRSV,PCV2的核酸为模板,按照已建立的LAMP体系,加入合适浓度的HNB指示剂对进行可视化检测,反应结束后观察颜色变化,同时取适量反应产物进行琼脂糖凝胶电泳,验证已建立LAMP方法的特异性。
1.9 LAMP方法敏感性试验将1.3步骤获得的pET-21b-M质粒进行10倍梯度稀释,从3.7×1010个拷贝/μL稀释到3.7×100个拷贝/μL,以不同浓度质粒作为模板,进行LAMP反应,并添加HNB指示剂显色判断其灵敏度。同时以不同稀释度的质粒为模板,用引物F-TGEV-M和R-TGEV-M进行PCR扩增,对两种方法检测的灵敏度进行对比。
1.10 临床样本检测采用建立的可视化RT-LAMP方法,对从陕西,宁夏及山东等地猪场收集的42份小猪腹泻样品进行TGEV检测,观察反应前后颜色变化,确定样品的检测结果。同时以样品cDNA为模板,用F-TGEV-Nt和R-TGEV-Nt与F-PEDV-Mt和R-PEDV-Mt进行PCR扩增,产物经琼脂糖凝胶电泳后,对两种方法检测TGEV的结果进行对比,并对样品的检测结果进行统计分析。
2 结果
2.1 TGEV检测RT-LAMP最佳引物筛选结果按照LAMP引物设计要求和TGEV M基因序列比对结果,共挑选了5组引物,以pET-21b-M质粒为模板,在63℃反应60 min进行LAMP反应。结果采用引物对1,2,3,5都可以扩增到梯度条带,采用引物对4没有扩到目的条带,阴性对照成立。根据条带的整齐度和清晰度选择引物对3建立检测方法(图1),其序列见表1所示。

图1 5对引物LAMP扩增结果 M.DL2000 DNA Marker;1~5.引物对1~5;6.阴性对照
2.2 RT-LAMP最佳反应条件和反应体系的确定以选定的引物对,分别设置反应温度为60,61,62,63,64和65℃,反应时间为15,30,45,60 min,并以ddH2O为阴性对照,进行LAMP反应。结果显示,在60~65℃反应,均能扩增到梯状条带,以在63℃扩增的梯状条带最清楚(图2A);63℃扩增30 min即出现梯状条带,但扩增45,60 min出现的梯状条带亮度与清晰度更好(图2B),为节省时间,选择扩增时间为45 min。

图2 RT-LAMP方法反应条件优化结果 A.反应温度;B.反应时间; M.DL2000 DNA Marker;NC.阴性对照
根据确定的在63℃反应45 min,分别对内外引物(F3/B3与FIP/BIP)浓度比,dNTP,Mg2+,甜菜碱浓度进行优化筛选。最终确定内外引物比为1∶6,Mg2+终浓度在4 mmol/L时扩增的梯状条带最清楚(图3A,C),dNTPs终浓度为从0.4 mmol/L开始差别不明显(图3B),Betaine(5 mol/L)的添加量在1,2,3,4,5和6 μL,即终浓度为0.2,0.4,0.6,0.8,1.0和1.2 mol/L时,梯状条带的亮度与清晰度差别不明显(图3D),考虑加样的准确性和节省原则,选择dNTPs和Betaine终浓度均为0.4 mol/L。

图3 RT-LAMP方法反应体系优化结果 A.内、外引物浓度比例;B.dNTPs浓度;C.Mg2+浓度;D.Betaine浓度;M.DL2000 DNA Marker;NC.阴性对照
2.3 可视化显色条件筛选确定了RT-LAMP的反应条件和反应体系后,反应前向反应体系中加入HNB显色剂,反应管中显示紫罗兰色,若阳性模板存在,反应后即变为天蓝色。从图4A和图4B可以看出,相比于HNB终浓度为300,400 μmol/L的反应管,100,200 μmol/L的反应管反应前后颜色变化更明显,但HNB终浓度为100 μmol/L时,显色结果易受自然光影响,因此选择HNB使用量为终浓度200 μmol/L。同时,随机取几个可视化阳性反应产物与阴性对照产物进行琼脂糖凝胶电泳(图4C),证实可视化检测方法成立且结果可信。
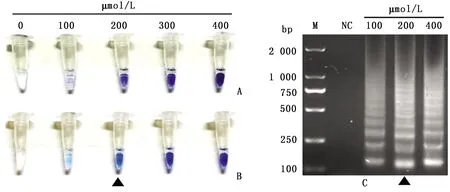
图4 RT-LAMP方法反应体系中HNB使用量优化结果 A.反应前颜色;B.反应后颜色;C.琼脂糖凝胶电泳;M.DL2000 DNA Marker;NC.阴性对照
2.4 LAMP特异性试验结果分别以TGEV,PEDV,PoRV,PPV,PRRSV,PCV2的RNA或DNA为模板,采用建立的RT-LAMP方法进行扩增,同时在反应前向反应管加入HNB,反应结束观察颜色变化,并取反应产物进行琼脂糖凝胶电泳。结果仅以TGEV RNA为模板的反应管和阳性对照一致,由紫罗兰色变为天蓝色,其他反应管都与阴性对照反应管一样没有颜色变化(图5A)。电泳结果显示仅阳性对照和以TGEV RNA为模板的反应产物出现特异性梯状条带,其他均无扩增产物(图5B),表明建立的检测TGEV的RT-LAMP方法特异性良好。
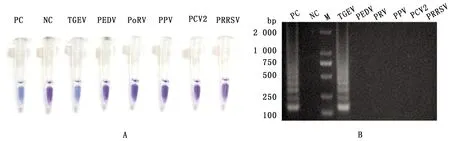
图5 RT-LAMP方法特异性试验结果 A.HNB显色;B.琼脂糖凝胶电泳;M.DL2000 DNA Marker;PC.阳性对照;NC.阴性对照
2.5 LAMP灵敏度试验结果将pET-21b-M质粒从3.7×1010个拷贝/μL稀释到3.7×100个拷贝/μL作为模板,进行LAMP反应,并添加HNB显色以判断其灵敏度。同时以不同稀释度的质粒为模板,用引物F-TGEV-M和R-TGEV-M进行PCR扩增,对扩增产物进行电泳,对比LAMP方法和PCR方法的灵敏度。结果显示,使用LAMP方法最低检测限为3.7×103个拷贝(图6A,6B),而常规PCR方法的最低检出限为3.7×105个拷贝(图6C),LAMP方法的灵敏度比常规PCR方法高100倍。在反应体系中加入HNB对结果进行可视化,其结果与琼脂糖凝胶电泳表现一致(图6A)。说明建立的LAMP方法灵敏度比常规PCR高。
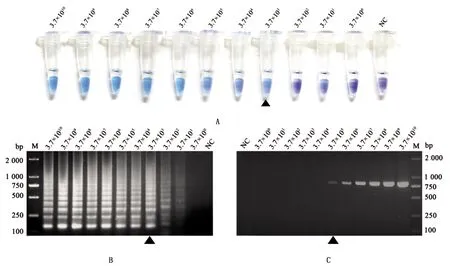
图6 RT-LAMP方法敏感性试验结果 A.HNB显色;B.琼脂糖凝胶电泳;C.常规PCR扩增产物琼脂糖凝胶电泳;M.DL2000 DNA Marker;NC.阴性对照
2.6 临床样品检测采用建立的可视化RT-LAMP方法对42份仔猪腹泻小肠及粪便拭子样品进行检测,并与RT-PCR检测结果进行比较。部分样品检测结果如图7所示,采用可视化RT-LAMP方法检测TGEV的结果与琼脂糖凝胶电泳结果一致,两者符合率100%。

图7 部分临床样品RT-LAMP检测结果 A.HNB显色;B.琼脂糖凝胶电泳;NC.阴性对照;PC.阳性对照;1~8.临床样品1~8号
表2显示了42份临床腹泻仔猪样品检测结果的统计情况,采用可视化RT-LAMP方法共检出TGEV阳性样品21份,采用RT-PCR方法共检出TGEV阳性样品4份,这4份样品有3份存在于RT-LAMP检测的21份阳性样品中(样品编号2,28,33),3号样品RT-LAMP检测为阴性,而RT-PCR检测为阳性,表明建立的可视化RT-LAMP方法敏感性高于RT-PCR方法。同时对这些样品进行了PEDV检测,共检出PEDV阳性22份,28和33号样品3种方法检测结果均为阳性,有10份样品(16,17,18,19,22,25,30,32,35,39号)TGEV RT-LAMP和PEDV RT-PCR检测均为阳性,说明这些腹泻仔猪中存在TGEV和PEDV混合感染情况,有10份样品(4,7,8,12,14,15,26,36,38,42号)3种方法检测结果均为阴性,这些仔猪的腹泻可能是其他原因造成,需要进行其他病原的检测。
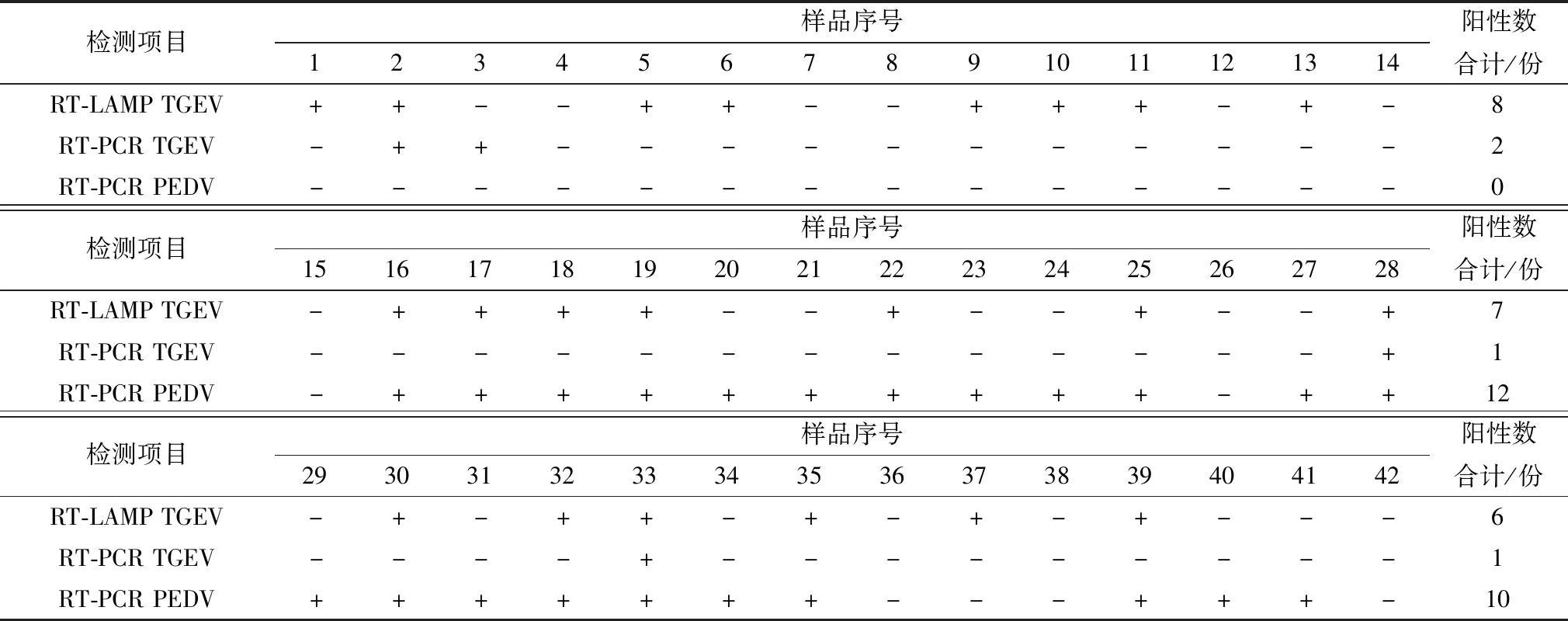
表2 临床样品检测结果统计
3 讨论
目前在全国范围内,虽然猪传染性胃肠炎大区域流行十分少见,但常与猪流行性腹泻,轮状病毒病等混合感染,对养猪业潜在危害严重[10]。常用的检测TGEV的方法主要有传统的实验室检测以及新型的分子生物学检测技术,每种方法优缺点并存[11-12]。传统的实验室检测方法,结果精确率高,检测需要时间过长;分子生物学检测方法常常需要配备一定的仪器设备,基层使用受到限制。环介导等温扩增技术的出现与发展,大大节省了送测时间,也无需购买过于昂贵的仪器与试剂,操作方法简单易懂,对基层检测十分适用。CHEN等[13-15]先后建立的TGEV LAMP检测方法,都是根据病毒的N基因保守区域来设计特异性引物的,目前未见报道以TGEV M基因为靶基因建立TGEV的LAMP检测方法的研究。M蛋白在病毒粒子装配环节发挥重要作用,其羧基端作为病毒免疫显性区,可诱导机体产生补体依赖性中和抗体引发细胞补体溶解反应[16]。张小波等[17]对TGEV HB06株与TS株,Purdue-115株,TFI株和H16株的M基因序列进行比对发现,M基因具有很好的保守性。本研究对NCBI数据库中TGEV Purdue P115(DQ811788.1),Miller M6(DQ811785.1),TH-98(KU729220.1),JS2012(KT 696544),SC-Y(DQ517438.1),WH-1(HQ462571.1)等常见毒株的M基因进行比对的基础上,选择其高度保守的区域设计引物,建立了检测TGEV的RT-LAMP方法,并且对LAMP检测体系中各组分的使用浓度进行了细化筛选,不仅能够在1 h内完成LAMP检测反应,而且灵敏度比普通PCR方法高100倍。
目前,LAMP检测方法可通过3种方式来判定结果:核酸电泳,副产物焦磷酸镁浊度观察或曲线测定,核酸染料或化学试剂可视化检测。通过核酸电泳检测扩增产物时需要开盖操作,由于LAMP扩增产物通常是瀑布式增长的,极易出现操作环境污染造成的假阳性;通过沉淀浊度判定时,为防误判一般需要使用浊度分析仪,会导致检测成本上升。因此采用染料颜色对结果进行可视化显示已经得到临床基层检测人员的广泛青睐,这种方法同时还具备方便灵敏和容易辨别的优势。
使用荧光染料SYBR Green,PicoGreen等染料时,这些染料会与DNA双螺旋结构结合,但往往引物二聚体会对荧光结果有较大影响,导致出现假阳性,而且这些染料需要在扩增后开盖加入,易造成气溶胶污染[18]。钙黄绿素是一种镁离子指示剂,在反应前就可加入体系,无需开盖,后来被日本荣研化学株式会社开发使用[19],但是这种方法需要摸索钙黄绿素与Mn2+的合适配比,而且Mn2+对LAMP检测灵敏度影响较大。金属离子指示剂羟基萘酚蓝于2009年由GOTO等[20]首次采用,后来不断被证实它既能实现闭管操作,而且不影响扩增过程,结果可视化效果较好[21-22]。该金属离子指示剂在有Mg2+的反应体系中呈紫罗兰色,随着反应体系中Mg2+因形成焦磷酸镁沉淀的消耗,反应体系颜色由紫罗兰色转变为天蓝色,而阴性对照仍保持紫罗兰色。HNB指示剂在反应前即加入反应体系中,避免了开盖检测可能造成的气溶胶污染,并且它对LAMP反应的敏感度无影响。本研究通过优化筛选HNB适合的工作浓度,确定了其使用终浓度为200 μmol/L时显色效果最佳。
使用本研究建立的LAMP方法检测收集的临床仔猪腹泻样品,结果显示所建立的可视化RT-LAMP方法检测TGEV阳性率高,而普通PCR检测TGEV阳性率较低,同时对样品进行PEDV的RT-PCR检测,发现28和33号样品3种方法检测结果均为阳性;有10份样品TGEV RT-LAMP和PEDV RT-PCR检测均为阳性,说明这些仔猪存在TGEV和PEDV混合感染情况。有10份样品3种方法检测结果均为阴性,这些仔猪的腹泻可能是其他原因造成,要确定具体原因需要进行其他病原的检测,如PoRV检测等。目前,国内养猪业由于受非洲猪瘟的严重影响,本次研究收集的临床腹泻样品数有限,要想进一步开发推广使用该方法,还需收集大批量的样品进行测试,以对建立的方法进行更深入评价。
