牛冠状病毒、牛诺如病毒和牛嵴病毒多重PCR检测方法的建立及初步应用
2020-07-22王文佳徐照学兰亚莉师志海
王文佳,徐照学,兰亚莉*,师志海*
(1.河南牧业经济学院 制药工程学院,河南 郑州 450046;2.河南省农业科学院 畜牧兽医研究所,河南 郑州 450002;3.河南省畜禽繁育与营养调控重点实验室,河南 郑州 450002)
犊牛腹泻(calf diarrhea,CD)是一种影响犊牛健康,进而影响优质畜产品生产的严重病症。在美国,CD是断奶前犊牛死亡的首要原因[1],韩国[2]、伊朗[3]等国也有类似报道。CD给全球养牛业带来巨大经济损失[4]。近年来,随着我国养牛业规模的扩大,CD的发病率呈上升趋势,严重影响犊牛早期的生长发育和后期生产性能的发挥。同时,因其死亡率高,亦严重影响牛群的更新和养牛业的良性发展[5]。此外,在CD的防治过程中,大多以抗生素治疗为主,易产生耐药性及畜产品药物残留超标的问题[6]。另外,受病原感染的牛提供给人类的乳、肉制品,会成为人类感染某些病原的潜在传播媒介,给人类的生命健康和公共卫生安全带来实质性威胁[7]。
CD病因复杂,包括细菌、病毒、真菌、寄生虫以及环境等其他生物学因子,给临床防制带来了极大地困难。尽管说细菌、病毒、寄生虫等都可引起CD,但病毒可通过急性、持续性或潜伏性感染引起腹泻类疾病[5],在CD中扮演重要角色。近年来,特别是对与CD相关病毒的研究日益受到全球病毒学界及相关领域专家学者的青睐,并成为研究热点。牛冠状病毒(bovine coronavirus,BCoV)是冠状病毒科、冠状病毒属的单股正链RNA病毒,可引起CD、成年牛冬痢和呼吸道疾病。犊牛感染多发于5~30日龄。牛诺如病毒(bovine norovirus,BNoV)是杯状病毒科、诺如病毒属的无囊膜单股正链RNA病毒。1978年首次在英国腹泻犊牛的粪便中被发现[9],2018年首次在我国腹泻牛粪便中被检测到[10]。牛嵴病毒(bovine kobuvirus,BKV),又名Aichivirus B,是无囊膜的RNA病毒。2003年首次在健康牛血清和粪便中被发现[11],2008年在腹泻牛粪便中被检测到[12],2013年首次在我国西北部地区奶牛群中检测到[13]。关于BNoV和BKV的流行病学在我国尚无相关报道,以及BKV在CD中扮演的角色还存在争议,有待于更多的研究求证。基于此,本试验建立BCoV、BNoV和BKV多重PCR检测方法,并在河南部分地区规模化牛场采集样品进行检测,以期为BCoV、BNoV和BKV的疫情监控、临床检测、综合防控及分子流行病学研究提供基础资料。
1 材料与方法
1.1 试验材料2017年9月—2018年5月,127份腹泻犊牛(<4月龄)粪便样本采集自河南规模化牛场(表1),全部样品单独分装,详细记录品种、年龄、采样日期、样品数量等信息。牛冠状病毒(BCoV)、牛诺如病毒(BNoV)、牛嵴病毒(BKV)、牛星状病毒(bovine astrovirus,BAstV)、牛轮状病毒(bovine rotavirus,BRV)、牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)、牛纽布病毒(bovine nebovirus,BNeV)阳性样品均由本实验室鉴定保存。

表1 样品信息
MiniBEST Viral RNA/DNA Extraction Kit,PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit,Premix Taq,DNA Marker 2000,pMD 18-T,DH5α均为TaKaRa公司产品;Gel Extraction Kit,Plasmid Mini Kit均为OMEGA公司产品。
1.2 核酸提取127份粪便样品,用PBS 按1∶10混悬,漩涡震荡,4℃ 8 000 r/ min离心5 min,收获上清,-80℃保存用于后续实验。病毒RNA的提取参照提取试剂盒,-80℃保存病毒RNA;cDNA的反转录参照逆转录试剂盒,-20℃保存。
1.3 引物设计与合成根据GenBank上发表的BCoV和BNoV病毒基因的保守序列,利用Premier 5.0软件对该2种病毒的基因保守区域分别设计1对引物,预计扩增BCoV NSP1-2 基因部分片段896 bp,BNoV RdRp基因部分片段542 bp;BKV的引物参考其他文章[14],扩增BKV 3D基因部分片段216 bp。引物由华大基因生物科技有限公司合成,引物信息见表2。
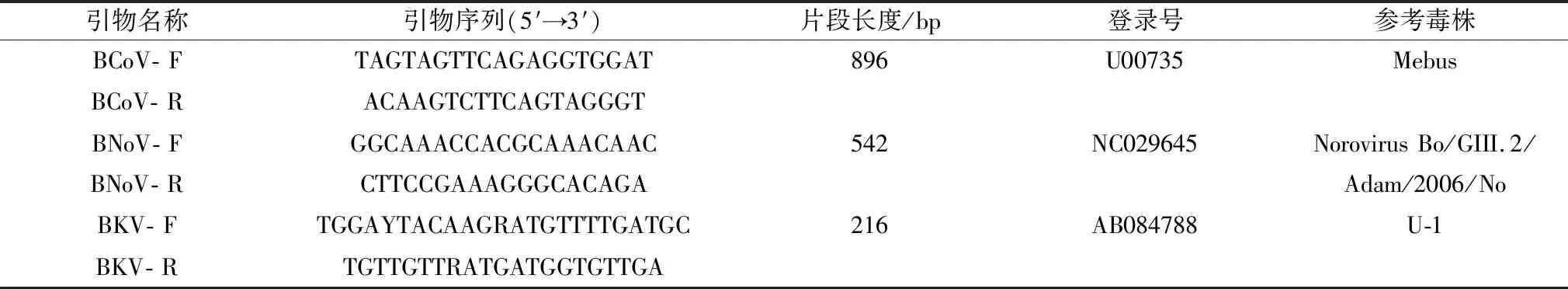
表2 引物信息
1.4 PCR扩增对多重PCR反应的引物、模板等用量进行优化和多次重复试验后确定最佳反应体系。将反应退火温度从45~56℃依次递增,多次重复试验后确定最佳退火温度。每次设置阴性对照。PCR扩增产物用1.0%的琼脂糖凝胶进行电泳鉴定。
1.5 特异性试验用建立的多重PCR方法对BCoV,BNoV,BKV,BRV,BAstV,BVDV,BNeV进行检测。
1.6 敏感性试验用上述引物分别对BCoV、BNoV和BKV的阳性样品进行单一PCR扩增,回收PCR扩增产物,分别与pMD18-T载体连接,构建阳性质粒。用超微量核酸蛋白分析仪测定所构建的阳性质粒的浓度,计算模板质粒的拷贝数,将阳性质粒10倍梯度稀释后进行多重PCR的敏感性试验。
1.7 重复性试验以构建的阳性质粒为模板,用建立的多重PCR方法每隔1周重复检测1次,连续检测3次,以验证该方法的可靠性和重复性。
1.8 应用性试验用所建立的多重PCR方法对127份临床腹泻粪便样本进行检测,并与用单一PCR检测结果进行比较。
2 结果
2.1 多重PCR体系的构建及优化通过对退火温度及引物浓度等条件的优化,最终确定该多重PCR体系包括Premix Taq 10 μL,BCoV,BNoV和BKV的上/下游引物各0.25 μL,模板1 μL,无菌去离子水补足至20 μL。退火温度最佳为52℃,最佳反应条件为:94℃ 5min;94℃ 1 min,52℃ 1 min,72℃ 1.5 min,30个循环;72℃ 7 min。
以BCoV,BNoV和BKV的单一模板和混合质粒为模板,用建立的多重PCR同时扩增,以ddH2O做阴性对照。结果显示,多重PCR分别扩增出BCoV约896 bp,BNoV约542 bp和BKV约216 bp 大小的目的片段(图1)。所有扩增出的特异性目的片段均经过测序验证。
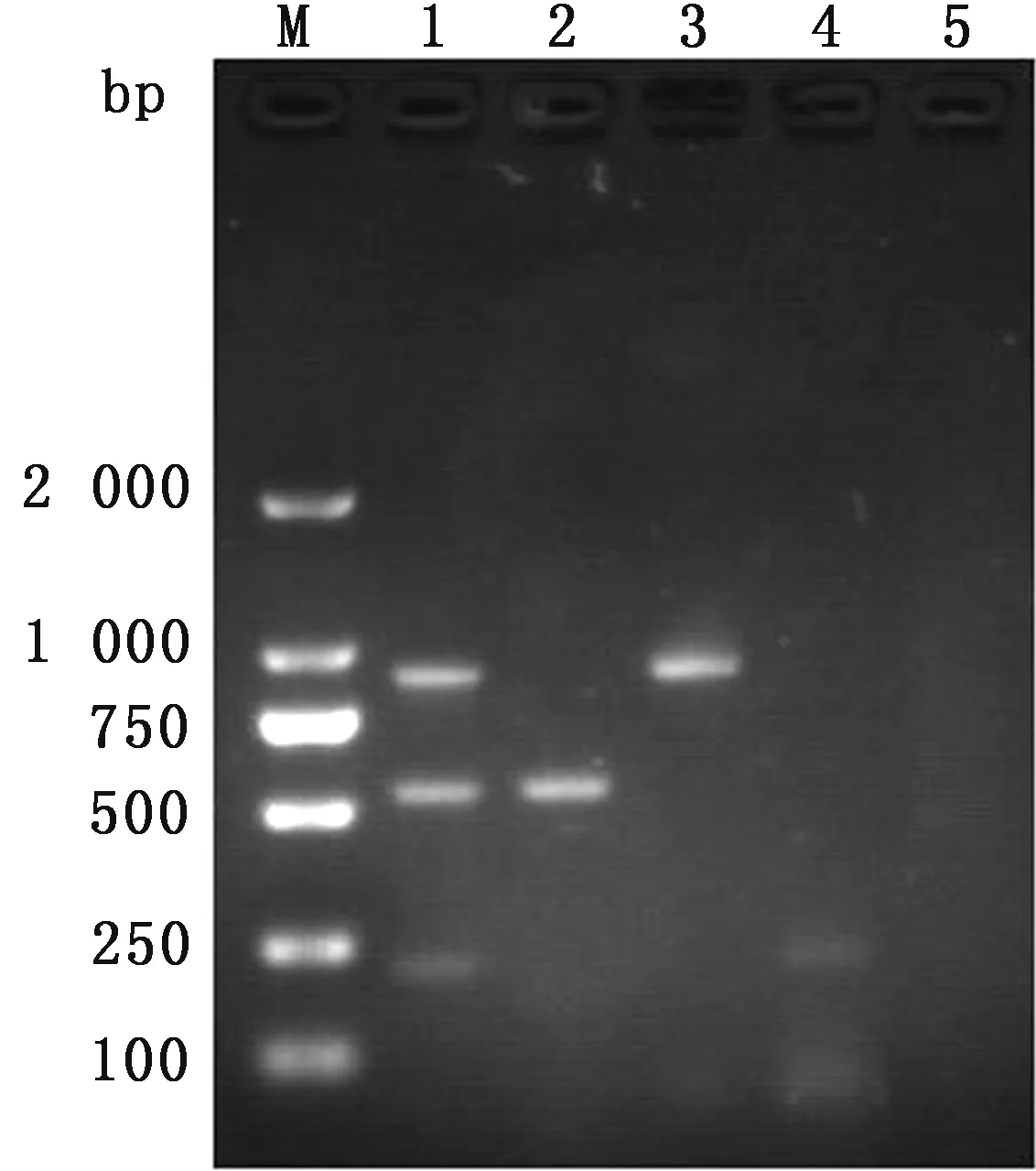
图1 BCoV、BNoV、BKV单一和多重PCR扩增 M.DL2000 DNA Marker;1.BCoV、BNoV和BKV的多重PCR扩增产物;2.BNoV单一PCR产物;3.BCoV单一PCR产物;4.BKV单一PCR产物;5.阴性对照
2.2 特异性试验用建立的多重PCR方法检测不同的阳性样品。结果表明,本试验建立的多重PCR方法具有良好的特异性(图2)。
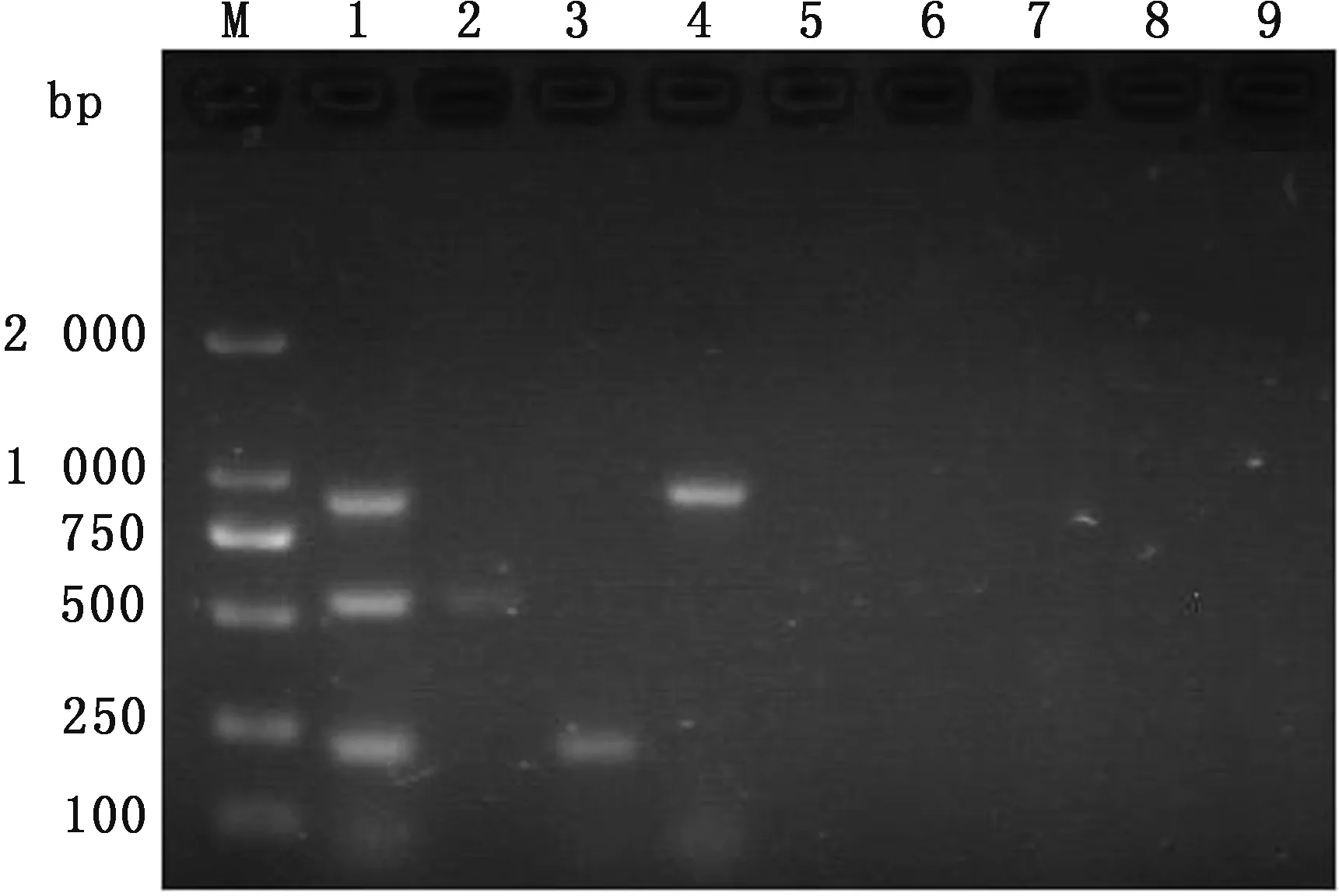
图2 多重PCR的特异性 M.DL2000 DNA Marker;1.BCoV,BNoV 和 BKV多重PCR扩增;2~8.分别是BNoV,BKV,BCoV,BRV,BAstV,BVDV,BNeV的PCR产物;9.阴性对照
2.3 敏感性试验结果显示,用建立的多重PCR方法对BCoV,BNoV和BKV的最低检测限分别为9.51×105,5.39×105和2.23×106copies/μL(图3)。

图3 多重PCR的敏感性 M.DL2000 DNA Marker;1~8.108~101 copies/μL BCoV+108~101 copies/μL BNoV+109~102 copies/μL BKV;9.阴性对照
2.4 重复性试验用建立的多重PCR方法对同一模版进行检测,3次试验结果一致(图4),表明该方法重复性良好。

图4 多重PCR的重复性 A,B,C.分别代表第1,3和5周的PCR M.DL2000 DNA Marker;1.BCoV+BNoV+BKV;2.BNoV;3.BCoV;4.BKV;5.阴性对照
2.5 应用性检测用建立的多重和单一PCR对127份临床样品进行检测,部分临床样品检测结果见图5。结果显示,所建立的多重PCR方法检测出的BCoV,BNoV和BKV的阳性数分别为19份(阳性率为14.96%),8份(阳性率为6.30%)和6份(阳性率为4.72%);并检出BCoV、BNoV和BKV共感染的样品2份(阳性率为1.57%)(表2)。检测结果与单一PCR检测结果符合率为100%。表明该方法能够快速准确的检测此3种病毒。

图5 部分临床样品的检测 M.DL2000 DNA Marker;1~15.临床样品;16.阴性对照
3 讨论
CD病因复杂,找出致病原因,做出准确诊断,采取相应措施是成功控制CD的关键。然而,在过去很长一段时间,有关CD的病原学调查都局限在细菌领域。近年来,关于病毒性病原在CD病因中的角色与地位越来越多的受到各国学者的关注,逐渐成为全世界病毒学界及相关领域专家学者的研究热点[15-16]。近年来,BKV和BNoV等病毒在我国牛群中陆续被检测到,应引起我国相关领域专家学者的关注和重视。目前,在我国关于BKV和BNoV的流行状况、致病力以及分子遗传进化分析等方面的相关报道甚少,本试验建立的检测方法为弥补此空白提供可靠的技术手段。
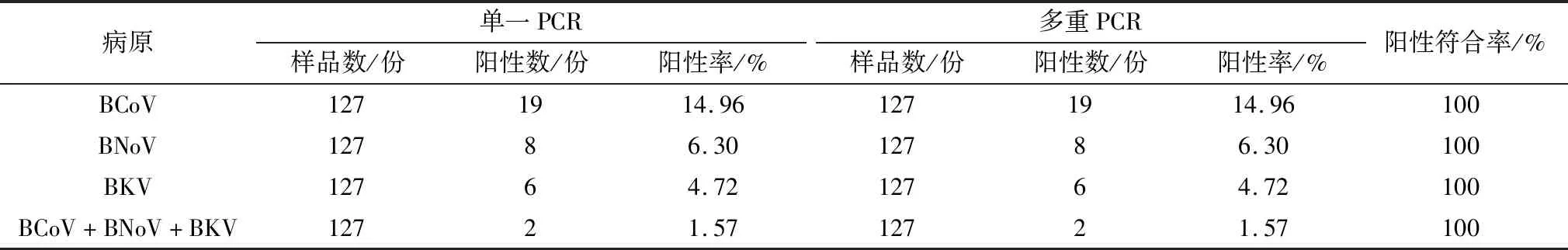
表3 临床样品的检测结果
BCoV,BNoV和BKV均与CD有关[17],并且三者有可能被同时检测到,仅靠临床鉴别诊断难以判定,从而给疾病的及时防治带来不便。传统的病毒检测方法如电镜观察、病毒分离鉴定、血清学试验等,存在费时费力、特异性差、试验周期长等不足,准确快速的诊断技术对此3种病毒的检测显得尤为重要。多重PCR技术可同时检测多种病原体,在鉴别诊断上应用价值较大,尤其是混合感染[18]。本试验建立的多重PCR诊断方法,可同时检测此3种病毒。运用该方法检测其他能够引起CD的病毒性病原,均无条带,说明特异性良好。另外使用该方法对BCoV,BNoV和BKV的模板(1 μL)最低能检测到3.74 pg的BCoV,1.91 pg的BNoV和7.10 pg的BKV,敏感性较高。该方法可用于临床样品中BCoV,BNoV和BKV的快速检测。用所建立的多重PCR方法对127份CD粪便样品进行检测,其中,BCoV、BNoV和BKV的检出率分别为14.96%,6.30%,4.72%。本试验中BKV的检出率低于CHANG等[13]报道的检出率(34.9%),可能与样本数量、饲养管理、生态条件等因素有关。
本试验通过优化多重PCR的反应条件,建立的BCoV,BNoV和BKV多重PCR检测方法,能从粪便样品中成功检测出BCoV,BNoV和BKV,特异性强,敏感性高,重复性好,可为此3种病毒的快速检测和流行病学调查等研究提供有力的技术支持。
