河北省 PEDV 流行毒株的分离鉴定及遗传演化分析
2020-07-22辛树阳严世杰郝建香付琦媛李文傲王春芳回卫荣唐梦虎马增军
辛树阳,严世杰,宋 涛,郝建香,付琦媛,李文傲,王春芳,回卫荣,唐梦虎,马增军,芮 萍
(河北科技师范学院,河北省预防兽医学重点实验室,河北秦皇岛 066600)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea,PEDV)引起的一种以急性肠胃炎、水样腹泻、呕吐、消瘦和脱水为主要特征的急性、接触性肠道传染病[1]。各年龄段猪对该病毒均易感,表现出不同的临床症状,1周内哺 乳仔猪感染尤为严重,发病率极高,病死率可高达50%~90%[2-3]。
1984年,我国首次发现PEDV[4-5],此后,我国猪场一直存在PEDV感染,但多呈零星分布或地域性流行,并未造成大规模流行。直至2010年10月,我国华南地区部分猪场开始暴发大规模PED流行,导致数百万头仔猪死亡,短时间内疫情迅速扩散至全国,甚至在疫苗免疫猪场也有PED疫情暴发[6],随后经病毒全基因组测序证实,引起PED疫情暴发的原因是PEDV 流行毒株发生变异[7],此后PED在我国普遍流行,给养猪业造成了巨大的经济损失。
本研究收集了2017—2018年河北省疑似感染PEDV的临床病料,通过RT-PCR、细胞培养、测序等进行病毒分离鉴定,并利用DNAstar、 MEGA 6.0等软件与GenBank公布的国内外PEDV参考毒株进行同源性比对和遗传进化分析, 以期揭示河北省PEDV的流行现状及遗传演化情况。
1 材料与方法
1.1 病料采集和处理2017—2018年本实验室在河北省规模化养殖场共采集了278份疑似感染PEDV 的病猪临床样品,包括小肠及肠道内容物等。无菌采集肠道组织和肠道内容物于2 mL EP管中, 匀浆破碎后离心收集组织研磨液上清,冻存于-80℃ 保存备用。
1.2 细胞、毒株和载体Vero细胞由本实验室保存;PEDV阳性对照毒株(CV777,AJ1102株)由华中农业大学农业微生物国家重点实验室惠赠;CH-HB1-2018株由本实验室分离保存;DH5α感受态细胞、pMD18-T Easy Vector购自宝生物工程有限公司。
1.3 主要试剂DEPC购自美国Sigma-Aldrich公司;RNAiso Plus购自大连宝生物公司。Prime ScriptTMⅡ 1st Strand cDNA Synthesis Kit,TaKaRa Ex Taq®,DL2000 DNA Marker和6×Loading Buffer购自大连宝生物公司;DNA纯化试剂盒和质粒小提试剂盒购自天根生化科技(北京)有限公司;Alexa Fluor 488-conjugated 驴抗鼠IgG 购自Santa Cruz。
1.4 引物设计参考PEDV CV777,AJ1102株的S基因序列以及孙倩倩等[8]建立的区分PEDV经典毒株和变异毒株的RT-PCR检测方法,设计1个共用上游引物和2个分别针对经典毒株和变异 毒株的下游引物(表1),用于PEDV流行病学调查。

表1 扩增目的片段引物
1.5 样品 RNA 提取及 RT-PCR按照试剂盒说明书提取总 RNA,按照 Prime Script Ⅱ 1st Strand cDNA Synthesis Kit 说明书对 RNA 进行反转录,以得到的 cDNA 为模板,扩增目的片段,PCR 扩增程序为:95℃预 变性 5 min,95℃变性 30 s,56℃退火 30 s,72℃延伸 30 s,35个循环;72℃延伸 10 min。PCR 产物经 1%琼脂糖凝胶电泳分析鉴定。
1.7 间接免疫荧光试验(IFA)将适量 PEDV 分别接种于 24 孔细胞培养板中长成单层 Vero 细胞,待 60%~70%的细胞产生 CPE 后收取细胞样品,PBS 洗涤 3 次,每次 5 min,室温下用 4%多聚甲醛固定 15 min,再用预冷的甲醇透化 10 min。PBS 洗涤 3 次,用含 5%BSA 封闭 30 min,每孔加入适当稀释的抗 N 蛋白单克隆抗体,37℃孵育 1 h,PBS 洗涤 3 次,每孔再加入二抗(Alexa Fluor 488-conjugated 驴抗鼠 IgG),37℃避光作用 45 min,PBS 洗涤 3 次,置于倒置荧光显微镜下观察。
1.8 PEDV 全基因组扩增、克隆及序列测定参照 AJ1102 株序列,设计 PEDV 全长引物,见表 2。用该引物对分离毒株 CH-HB1-2018 进行全基因扩增,PCR 反应条件为:95℃,5 min;95℃,1 min;56℃,1 min;72℃,2 min, 35 个循环;72℃,10 min。PCR 产物经 1%琼脂糖凝胶电泳分析鉴定后,按照 DNA 胶回收试剂盒说明书对 PCR 产物进行回收纯化,并与 pMD18-T 载体连接,转化至大肠杆菌 DH5α 感受态细胞中,挑取白色菌落摇菌,将鉴定阳性菌液送公司测序。

表2 PEDV 全基因组扩增引物
1.9 PEDV 全基因组序列比对和进化树分析利用 DNAstar 软件对测序结果进行序列比对分析,与 GenBank 中已上传的国内外 PEDV参考毒株全基因序列和 S 基因序列进行同源性比对和遗传进化分析,参考毒株信息见表 3。
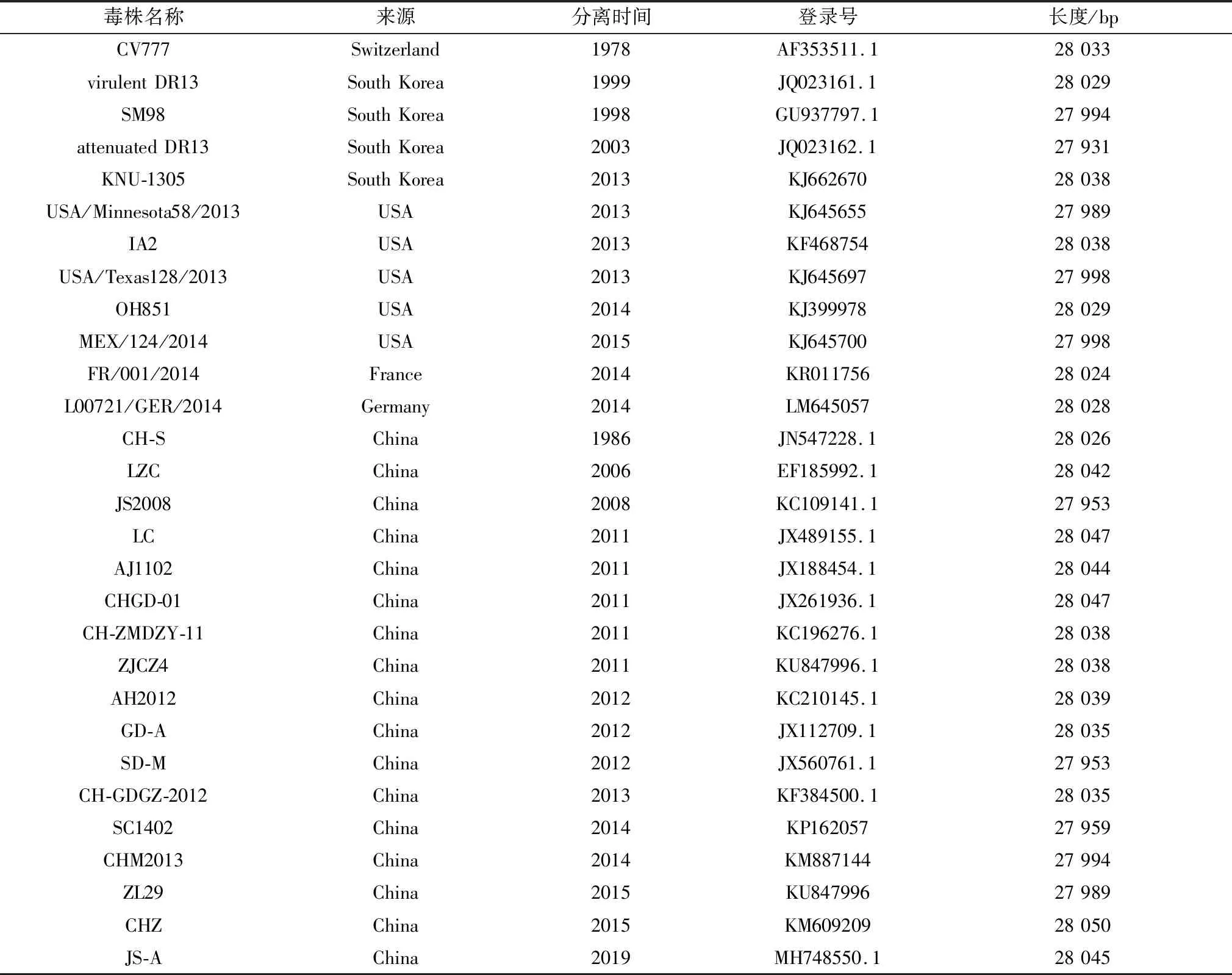
表3 PEDV 参考毒株信息
2 结果
2.1 RT-PCR 检测方法验证按照本研究设计的 RT-PCR 检测方法分别对 CV777 经典株和 AJ1102 变异株进行验证, PCR 产物经由 1%琼脂糖凝胶电泳试验鉴定(图 1),表明本研究设计的检测方法可以有效区分 PEDV 变异毒株和经典毒株。

图1 RT-PCR 检测方法验证结果 M.DL2000 DNA Marker;1.CV777 经典株;2.AJ1102 变异株;3.阴性对照
2.1 病料检测本研究在河北省多个地区规模化养殖场共采集 278 份病猪临床样品,各地区采样及病毒分离情况如图 2 所示,其中承德、张家口病毒分离率较低,保定、石家庄病毒分离率较高,表明病毒的流行情况可能与当地的生猪养殖密度有关。本研究设计的 RT-PCR 诊断方法可以特异性区分 PEDV 变异毒株和经典毒株(图 3),利用该对引物对采集的 278 份病猪临床样品进行 PEDV 检测。

图3 PEDV 变异毒株 RT-PCR 鉴别诊断的扩增结果M.DL2000 DNA Marker;1:PEDV 样品;2.阴性对照;3.AJ1102 变异株阳性对照;4.CV777 经典株阳性对照
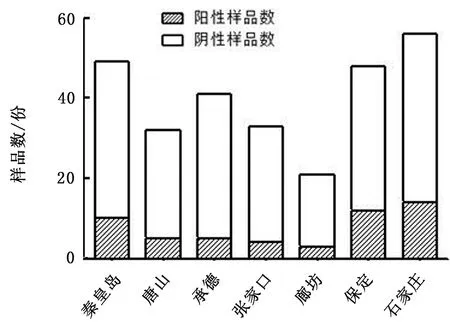
图2 2017—2018 年河北省各地区PEDV分离情况
2.2 PEDV 毒株的分离鉴定根据采样时间、地点等因素选取14份阳性样品进行病原分离,取处理好的组织研磨液上清感染 Vero 细胞,盲传 3 代后发现 3 号样品在第3代 Vero 接毒样品中出现明显 CPE, 收取病毒液后继续进行培养,最终获得 1 株能够在 Vero 细胞上稳定传代的 PEDV 毒株。利用PEDV N蛋白单抗作为一抗,通过 IFA 试验检测传代的 PEDV 在 Vero 细胞上的增殖情况(图 4A),进而证实成功分离到 1 株 PEDV 毒株,将其命名为 CH-HB1-2018 株。

图4 PEDV 的间接免疫荧光检测 A.PEDV 株;B.PEDV 阴性对照;C.PEDV 阳性对照
2.3 PEDV分离毒株全基因组片段扩增、克隆及序列拼接通过 RT-PCR,优化扩增条件,成功扩增出 CH-HB1-2018 株全基因组 DNA 片段,各片段大小与预期相符,将全基因组各片段送公司进行测序,利用 DNAstar 软件对测序结果进行拼接后获得 CH-HB1-2018 株的全基因组序列,并提交至 GenBank,登录号为 MK606368。
2.4 PEDV全基因组序列进化树分析利用 MEGA6.0 软件绘制 CH-HB1-2018 株与 29 株国内外 PEDV 代表毒株全基因组的系统进化树(图 5)以分析其遗传进化关系。30 株 PEDV 序列主要形成 G1,G2,G3 共3个进化分支,G1 分支主要由 CV777,SM98 等经典毒株组成,G2 分支由 AJ1102,AH2012 等变异毒株组成,G3 分支主要包括 OH851,ZL29 等 SINDEL 毒株。本研究分离毒株CH-HB1-2018 属于 G2 分支,且与 AJ1102 毒株的遗传进化距离较近。
歌词一:清明的风/吹绿了你的胡同/梨花雨/淋湿了书生的梦/树叶儿落/头顶上秋雁呢哝/城门外/没贴你名字
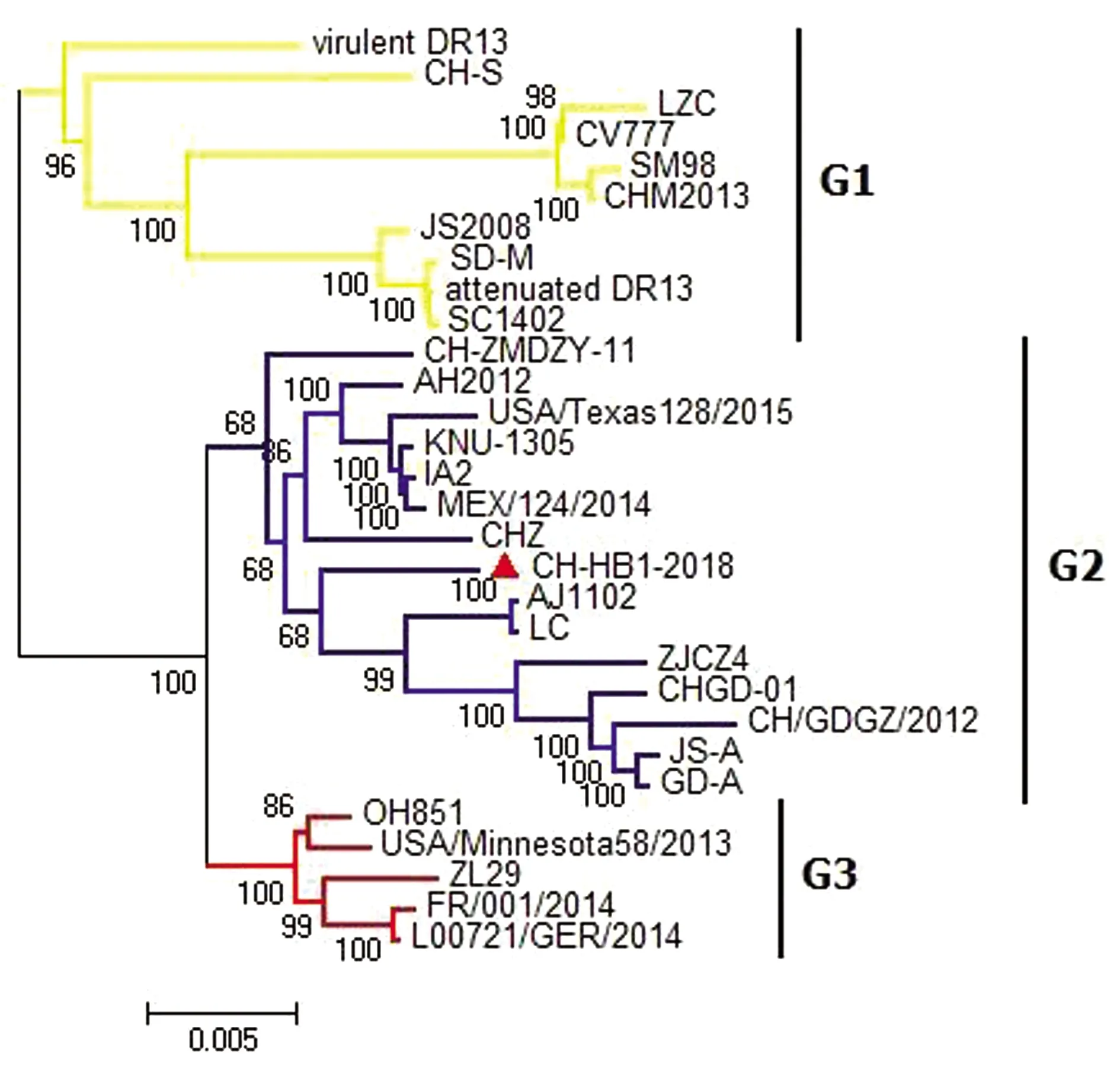
图5 PEDV 全基因组序列系统进化树分析 ▲表示本研究分离毒株
2.5 PEDV 全基因组序列核苷酸同源性分析通过 MegAlign 软件对 CH-HB1-2018 株与国内外 29 株 PEDV 代表毒株进行全基因组序列核苷酸同源性比对(图6)。结果显示,CH-HB1-2018株与中国变异毒株AH2012株和美国变异毒株IA2株的同源性最高,均为99.0%,与AJ1102,LC株等变异毒株的同源性相对较高,在98.0%~99.0%之间,与经典毒株的同源性最低,在96.2%~97.5%之间。

图6 30株毒株全基因组核苷酸同源性比较
2.6 PEDV S基因序列进化树分析S基因在 PEDV 基因组中变异最为明显,对 CH-HB1-2018 株与 29 株代表株的 S 基因进行遗传演化分析,结果如图 7 所示。与全基因组序列进化树相同,30 株 PEDV 的 S 基因分 别形成以经典毒株、变异毒株和 SINDEL 毒株为代表的 G1,G2,G3 分支,CH-HB1-2018 株的 S 基因从属于 G2 分支,与 ZJCJ4 株和 AJ1102 株的遗传进化距离最近。
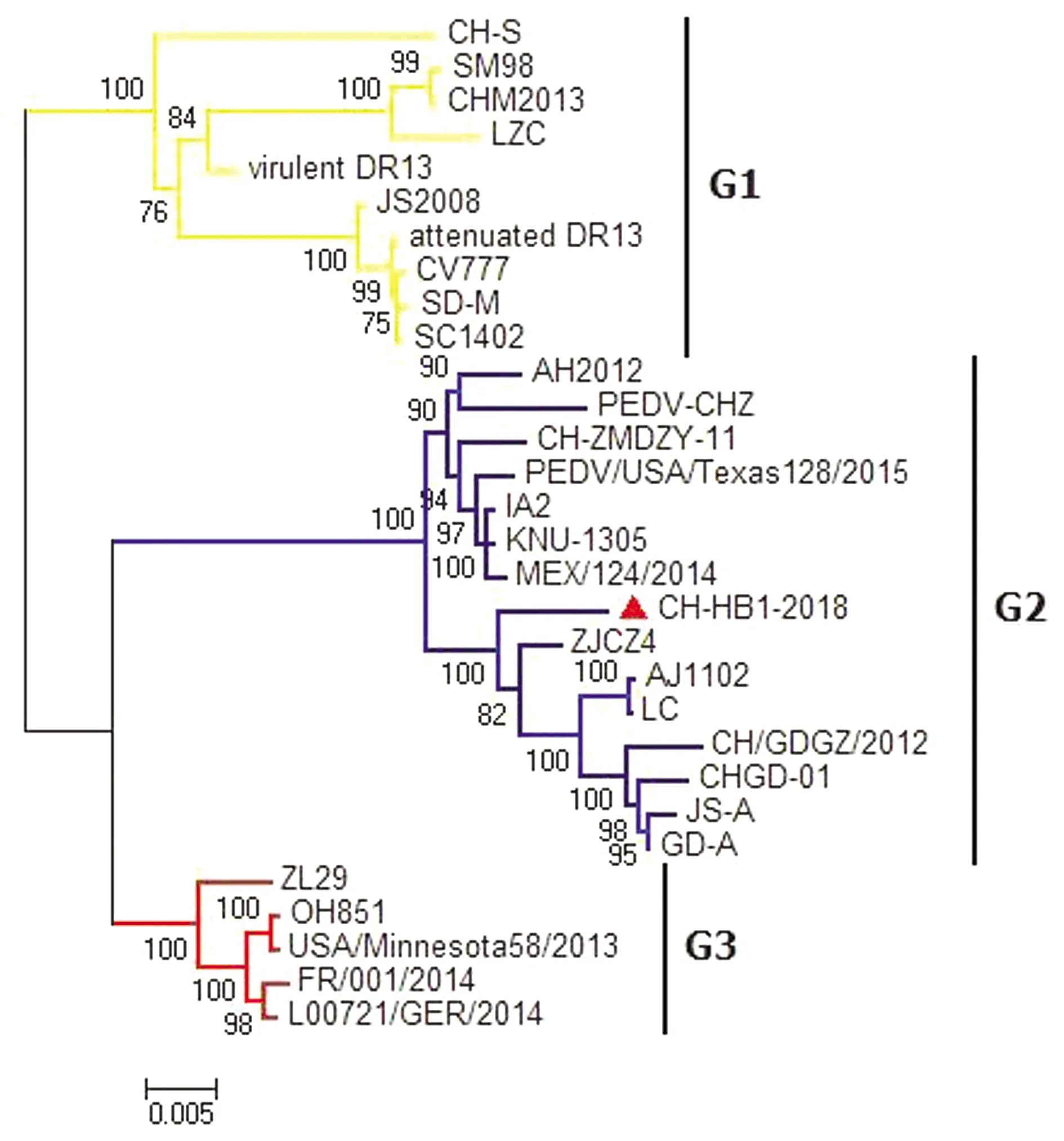
图7 S基因序列系统进化树分析 ▲表示本研究分离毒株
2.7 PEDV S 基因序列核苷酸同源性分析利用与全基因组序列比对的相同方法对 30 株 PEDV 毒株的 S 基因进行核苷酸同源性比对分析(图 8)。结果显示,CH-HB1-2018 株与经典毒株和 SINDEL 毒株 S 基因的同源性分别在 92.5%~94.2%和 94.9%~95.1%之间,与变异毒株 S 基因的同源性在 97.7%~98.9%之间, 其中与 ZJCZ4 株的同源性最高为 98.9%,与系统进化树分析结果一致。此外,30 株 PEDV 毒株 S 基因间的同源性显著低于全基因组序列的同源性,进而表明 S 基因变异最为明显。 核苷酸序列比对结果显示,CH-HB1-2018 株与经典毒株和 SINDEL 毒株相比在 162,170~180和 413~415 nt 处存在核苷酸插入,在 470~475 nt 处存在核苷酸缺失,与变异毒株的 插入缺失位点一致,表明本研究分离毒株为变异毒株。

图8 30 株毒株 S 基因核苷酸同源性比较
3 讨论
1984年我国在上海首次分离到PEDV,至今已在我国诸多省份广泛流行,给我国养猪业乃至公共卫生事业造成巨大的威胁[9]。2010年之后出现的PEDV变异毒株与早期经典毒株相比,呈现出致病性更强、流行范围更广等特点,因此,急需对PEDV的流行变异情况进行密切监测。本研究对2017—2018年间在河北地区采集的278份临床病料进行PEDV检测,阳性率为19.1%,其中PEDV变异毒株阳性率为17.6%,说明PEDV变异株的流行是当前引起猪流行性腹泻的主要原因。
PEDV只有1种血清型,但很多学者根据其全基因组、S基因或M基因将其分为不同分支以探究其遗传演化规律[10-14]。PARK等[15]根据部分S基因序列将其划分为G1,G2,G3分支;LEE等[16]根据S基因的全长序列将其划分为G1,G2两个分支;CHEN等[17]根据PEDV全基因组将其划分为G1,G2,G3共3个分支,其中G3群又被分成4个亚分支。本研究根据遗传演化分析结果将毒株分为了3个分支,分别为以CV777经典毒株为代表的G1分支,以IA2,AJ1102等变异毒株为代表的G2分支和以ZL29,OH851等SINDEL毒株为代表的G3分支。进化树分析结果显示,PEDV流行毒株的地域特点并不显著,在世界各地均有分布流行,本研究分离毒株CH-HB1-2018株为变异毒株,从属于G2分支,结合流行病学调查结果分析发现当前河北地区PEDV流行毒株以变异毒株为主,但也有经典毒株的存在。
SATO等[2]研究发现,DR13株的S基因在病毒传代过程中出现多个氨基酸位点的突变或缺失,并且PEDV的S基因存在29个潜在糖基化位点[18],因此S基因被认为与病毒毒力相关。本研究对30株PEDV序列的S基因进行序列比对发现,CH-HB1-2018株存在与变异毒株相同的氨基酸插入、缺失位点,且同源性分析结果表明S基因的变异程度最大,由此推测S基因在 病毒遗传演化过程中可能起到重要作用。
本研究通过对病毒的分离鉴定、遗传演化分析和同源性比对发现河北省PEDV流行毒株与参考毒株间的同源性较低,提示我们PEDV流行毒株持续发生遗传演化,随之可能会产生新型变异毒株。此外,S基因的高度变异极有可能增强病毒毒力,致使病毒致病性增强, 对该病毒的防控及公共卫生安全都存在巨大的威胁,因此,应该对PEDV的流行变异情况进行及时且密切的监测。本研究为河北省的PEDV流行病学调查提供了一定的参考依据,对该病毒的防控及净化具有非常重要的现实意义。
