盖塔病毒TaqMan探针荧光定量RT-PCR检测方法的建立
2020-07-22朱翔宇鲁荣光蔡熙姮
朱翔宇,鲁荣光,胡 博,蔡熙姮,刘 昊,史 宁*
(1.中国农业科学院特产研究所,吉林 长春 130112;2.佛山科学技术学院,广东 佛山 528000)
盖塔病毒(Getah virus,GETV)是披膜病毒科(Togaviridae)甲病毒属(Alphavirus)西门利克病毒复合组的一种单链RNA病毒,属于由蚊虫传播的虫媒病毒[1]。1955年从马来西亚捕获的雪背库蚊(Culexgelidus)中首次被分离并命名为Getah virus[2]。随后在日本、东南亚和澳大利亚等地,从蚊虫体内、马和猪的血液样品中分离到GETV[3-5]。GETV能在节肢动物和脊椎动物体内增殖,血清学检测结果显示目前GETV广泛分布于马来西亚、日本、澳大利亚、中国、蒙古国和俄罗斯等国家[6-14]。我国于1964年首次在海南库蚊样品中分离到GETV(M1株)后相继在中国多个省市采集的蚊虫样品中分离到多株GETV[11,15],最近国内有报道称,在湖南省的某养猪场和山东省的某蓝狐养殖场中分别发生了GETV的暴发,并成功分离到GETV[16-17],并且近期对云南省家畜的病毒血清学调查结果显示,在采集的多数家畜血清样品中检测到了GETV的中和抗体[18],此外,2018年周峰等[19]在某猪场的猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)减毒活疫苗中发现有GETV污染并进行了GETV的分离鉴定,在此之前周峰等[20]曾在河南省某养猪场疑似PRRS流产胎儿病料中分离到1株GETV,而2个毒株间具体有什么联系,尚未有明确定论。目前一般认为GETV是可以感染人的动物源性虫媒病毒[21-22]。尽管目前尚无人感染流行GETV的报道,但是国外已有报道在健康人血清样本和发热患者血清标本中均能检测到GETV中和抗体[11,23-24],表明该病毒很有可能引起人类感染,因此不可忽视GETV对人类健康产生的潜在威胁。
GETV感染家畜可以引发疾病,如马的发热、皮疹、后腿水肿及淋巴结肿大,并能引起猪的致死性疾病和生殖障碍等[3-4],因此GETV被列为重要动物源性病原体[25-26]。常用于诊断GETV的几种方法包括间接免疫荧光法(indirect immunofluorescence,IFA)、血凝和血凝抑制方法、免疫电镜观察、GETV C基因特异性引物PCR扩增等方法。近年来反转录PCR(retro-transcription-PCR,RT-PCR)及实时荧光定量PCR(real-time PCR,RT-qPCR)因快速、敏感等特点在病毒检测方面广泛应用,并且已经建立了针对部分虫媒病毒的RT-PCR、RT-qPCR检测方法[27-30]。本研究利用TaqMan探针荧光定量RT-PCR技术,建立一种快速检测GETV方法,为虫媒病毒检测提供方法学支持。
1 材料与方法
1.1 毒株与临床样品GETVSD1709株(MH106780)用于建立RT-qPCR测定。赤羽病毒(Akabane disease virus,AKAV)NM/BS/1株;巴泰病毒(Batai virus,BATV)NM/12株;日本乙型脑炎病毒(Japanese encephalitis virus,JEV)YN0901株;猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)CC-1株;伪狂犬病毒(pseudorabies virus,PRV)DL14/089株;猪圆环病毒Ⅱ型(porcine circovirus type 2,PCV2)NM2002株;犬瘟热病毒(canine distemper virus,CDV)HBF-1株;水貂细小病毒(mink enteritis virus,MEV)LT-18株,均由中国农业科学院特产研究所农业农村部经济动物疫病重点实验室保存,用于RT-qPCR方法的特异性评价。样本来源于2017年7月至2018年9月在吉林省收集的10 000只三带喙库蚊(Culextritaeniorhynchus),50~100只分装,共100管。
1.2 主要试剂与仪器QIAamp Viral RNA Mini Kit,美国QIAGEN公司产品;Vazyme HiS-cript II 1st Strand cDNA Synthesis Kit,南京诺唯赞生物科技有限公司产品;Probe qPCR Mix,Ex Taq聚合酶,DH5α感受态细胞,250 bp DNA Ladder Marker,宝生物工程(大连)有限公司产品;小剂量质粒(去内毒素)抽提试剂盒,Omega公司产品;FastStart Essential DNA Probes Master,罗氏诊断产品(上海)有限公司产品。
Nanodrop 2 000,Thermo公司产品;PCR仪,Applied Biosystems公司产品;凝胶成像仪,Bio-Rad公司产品;LightCycler®96实时荧光定量PCR仪,罗氏诊断产品(上海)有限公司产品。
1.3 引物与探针从GenBank下载了6株GETV序列(KY363862,AB859822,EF631999,MG865965,LC107870,LC223131),利用DNAStar进行比对非结构蛋白(NSP1)基因序列后,以759 ~948 nt的保守区域作为鉴定区域,并在此区域内设计引物和探针序列(表1),探针的5'端和3'端分别标记荧光报告基团荧光素(HEX)和荧光淬灭基团(TAMRA),扩增片段约为200 bp。引物和探针由上海生工生物工程技术服务有限公司合成。
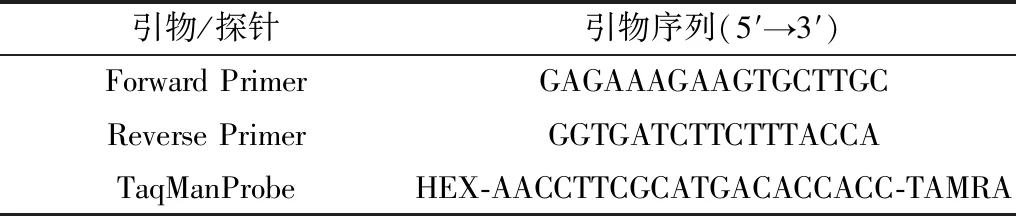
表1 GETV的RT-PCR荧光探针及扩增引物
将GETV基因与其他亲缘关系较近的甲病毒如东部马脑炎病毒、委内瑞拉马脑炎病毒和辛德毕斯病毒进行序列比对,结果显示GETV毒株与其他甲病毒毒株的核苷酸序列同源性在61.1%~70.5%范围内,且设计的引物与其他的甲病毒基因不匹配,表明引物具有良好的特异性。
1.4 病毒RNA的提取与质粒标准品的制备使用QIAamp Viral RNA Mini Kit从含有106PFU/mL GETV的200 μL Vero细胞培养上清液中提取GETV RNA。使用Vazyme HiS-cript II 1st Strand cDNA Synthesis Kit将RNA转化为cDNA,具体操作按试剂盒说明书进行。
将反转录获得的cDNA通过常规PCR进行扩增,PCR程序如下:95℃ 5 min;95℃ 30 s,60℃ 30 s和72℃ 30 s,共35个循环;最后72℃下延伸10 min。将PCR产物纯化后与pET-30a载体连接,转化至DH5α感受态中,送上海生工生物工程技术服务有限公司测序鉴定。按照小剂量质粒抽提试剂盒说明书提取序列正确的阳性质粒GETV-pET-30a作为阳性标准品,检测其浓度并计算出阳性标准品的拷贝数。
1.5 RT-qPCR方法的建立及优化以已知拷贝数的GETV阳性标准品GETV-pET-30a作为模板,利用FastStart Essential DNA Probes Master试剂盒中的试剂,总体系为25 μL,将探针和引物进行不同浓度的配比(浓度控制在0.1~2 μmol/L)来选择最佳浓度,根据SeqMan软件设计提供的引物与探针的最佳退火温度来调整反应温度与反应时间(温度为55~65℃,时间为20~40 s),循环参数分别为35,40和45,按照以上条件进行优化。
1.6 标准曲线的建立将制备的GETV重组质粒标准品2.03×100~2.03×108copies/μL进行10倍连续倍比稀释后作为模板,按照优化后的反应体系,反应条件进行RT-qPCR检测,以标准品浓度的对数为x轴,Ct值为y轴建立标准曲线。
1.6 RT-qPCR方法的特异性、敏感性、重复性试验提取GETV,AKAV,BATV,JEV,PRRSV,PRV,PCV2,CDV和CPV的DNA或RNA,以DNA或RNA反转录的cDNA作为模板,用建立的RT-qPCR方法进行检测,验证RT-qPCR方法的特异性,用无菌水作为阴性对照。将制备的GETV重组质粒标准品100~108copies/μL进行10倍连续倍比稀释后作为模板,以评估和比较RT-qPCR和常规RT-PCR测定的灵敏度。RT-PCR反应产物使用1.5%琼脂糖凝胶电泳进行鉴定分析。
对GETV重组质粒标准品进行10倍梯度稀释,选择2.03×105~2.03×107copies/μL的3个不同浓度的样品进行检测,每个样品作3次重复,并在不同时间重复检测3次,计算Cq平均值的标准差,验证该方法的重复性。
1.7 临床样品的检测将2017年7月至9月在吉林省多个农场收集的10 000只三带喙库蚊样品进行处理,按50~100只/管分装为100管。使用含2% FBS的MEM培养基将蚊子悬浮液和血清样品制备为10%乳剂,在4℃条件下以12 000 r/min离心30 min,使用0.22 μm滤膜过滤后进行RNA提取并反转录成cDNA,然后通过RT-qPCR和RT-PCR分别进行检测及分析。
1.8 病毒分离培养试验病毒分离培养是WHO公认鉴定病毒的金标准,参照刘帅等[31]的方法对RT-qPCR结果为阳性的样品进行病毒分离。取200 μL蚊悬浮液接种于含有5%胎牛血清和1%青霉素(10 000 U/mL)、1%链霉素(10 000 U/mL)的MEM培养基中培养的Vero细胞,置于37℃,5%CO2中恒温培养箱中。72 h后,观察到细胞病变(cytopathic effect,CPE)后将接毒的Vero细胞盲传3代后收获病毒。反复冻融3次后按说明书操作提取病毒RNA并反转录成cDNA,进行普通PCR扩增,反应产物经1.5%琼脂糖凝胶电泳进行鉴定。
2 结果
2.1 标准品浓度的换算使用Nano drop检测阳性标准品质粒的浓度为337.2 μg/L,根据公式换算后其拷贝数为2.03×108copies/μL。
2.1 双重荧光定量RT-PCR方法的建立与优化引物与探针最佳浓度分别为0.4,0.8 μmol/L,最佳退火温度为60℃。反应体系为20.0 μL,每个反应管包括10.0 μL Probe qPCR Mix,7.5 μLRNase-free ddH2O,上、下游引物各0.5 μL,0.5 μL TaqMan探针和1 μL cDNA样品(20~50 ng)。使用Roche LightCycler®96系统进行RT-qPCR,优化后的反应程序如下:95℃预变性30 s,95℃变性5 s,55℃退火10 s,72℃20 s,共40个循环。
2.2 标准曲线的绘制分析Cq值和目的基因浓度的对数之间的线性关系,得到的标准曲线的斜率为―2.883 3,截距为31.82,标准曲线方程为y=-2.883 3x+31.82(R2=1.00)(图1)。

图1 使用标准质粒进行10倍连续稀释产生的标准曲线
2.3 敏感性试验RT-qPCR扩增曲线(图2A)是通过检测梯度稀释的GETV的标准阳性质粒而产生的,拷贝数范围为2.03×101~2.03×108copies。RT-qPCR的检出限为2.03×101copies/μL,而常规RT-PCR在浓度为2.03×103copies/μL时显示为阴性(图2B),表明RT-qPCR的灵敏度比常规RT-PCR高100倍。
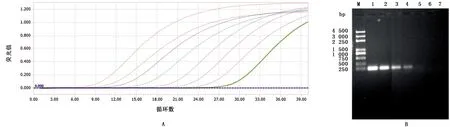
图2 荧光定量PCR(A)和常规普通PCR法(B)敏感性比较 M.250 bp DNA Ladder Marker;1~7.分别为2.03×108~2.03×102 copies/μL
2.4 重复性试验通过变异系数(CV)值的计算分别评估RT-qPCR检测样品时的批内重复性和批间重复性。测定批内和批间CV值分别为0.55%~0.97%和1.47%~1.66%(表2),说明此方法的重复性良好。
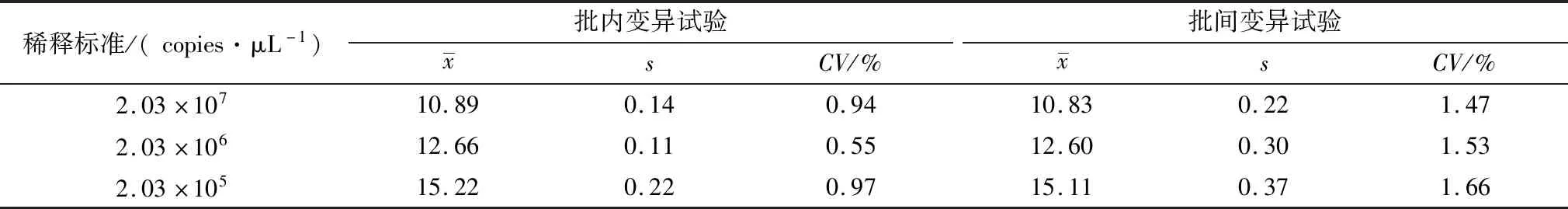
表2 TaqMan RT-qPCR测定的批内和批间离异度
2.5 特异性试验结果显示GETV cDNA可以出现特异性扩增曲线,序列分析结果证明扩增产物序列正确,且其他病毒DNA或cDNA的检测结果皆为阴性,表明本试验的引物、探针以及所建立的方法特异性良好。
2.6 临床样品的检测及应用通过RT-qPCR法共检测出8个阳性样品编号201707022,201807026,201708018,201708023,201709006,201809021,201709131和201809146)GETV RNA在蚊子样本中拷贝数分别为9.366×103,8.663×103,9.014×103,1.896×102,1.331×103,8.964×103,1.289×103和1.913×102copies/μL。而常规RT-PCR检测仅有4个样品结果为阳性(201707022,201807026,201708018和201809021)(表2),初步推测可能与病毒滴度有关。
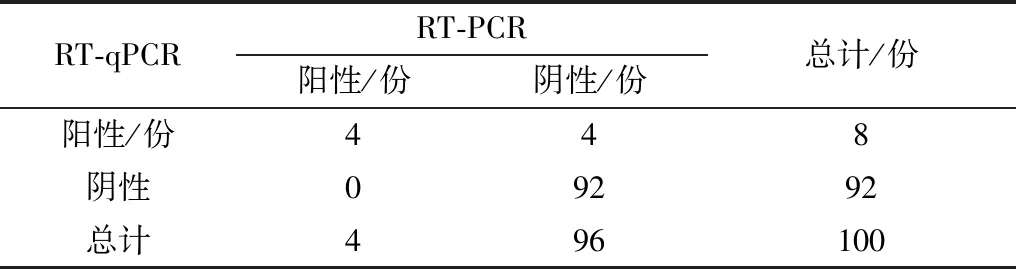
表3 应用RT-qPCR方法和常规RT-PCR方法检测临床样品
2.7 病毒分离培养将RT-qPCR结果阳性的8份样品接种Vero细胞后,第3天开始出现CPE,盲传3代后第4天出现明显CPE,细胞间隙增大、皱缩、变圆并大面积脱落,形成空斑,第6天细胞完全脱落,收获病毒。提取病毒RNA并反转录为cDNA,使用GETV特异性引物进行PCR鉴定,结果显示8份样品皆为阳性。
3 讨论
GETV是一种以蚊媒传播为主的病毒,迄今为止我国对该病毒的研究仅局限于对人群的血清流行病学调查和蚊子带毒情况研究,至于蚊子体内的病毒从何而来以及动物在该病毒传播过程中所起的作用尚不得而知。目前研究GETV的来源、在我国的生态学分布、对动物和人的致病性、确定其终末宿主以及蚊子是否在人和动物间扮演媒介角色等均具有重要的公共卫生意义和动物生产应用价值。
病毒分离培养是目前国际上公认的鉴定病毒的金标准,但是操作繁琐、对检验员和试验条件的要求都很高,很难在基层实验室应用。建立一种特异、灵敏和快速的诊断技术是有效防控传染病的重要措施之一,检测病毒的方法免疫学方法和分子生物学方法。但免疫学方法存在一定的误差,分子生物学方法可以做到更为精确的检测。常用的既可靠又精确的方法是荧光定量PCR,其中TaqMan探针法荧光定量PCR具有高度的特异性,比普通PCR结果更直观、精确。王傲杰等[32]建立了GETV的RT-PCR方法,特异性良好、敏感度较高,检出最低滴度为102.25TCID50/mL。
本研究在相对保守NSP1序列应用DNAStar等软件设计引物和探针,并借助NCBI网站在线Blast分析引物和探针的特异性,筛选出最佳引物和探针。经过条件优化成功建立了GETV实时荧光定量RT-PCR检测方法,并验证了其灵敏度、特异性和重复性。通过验证该方法具有较好的特异性,对本实验室其他病毒如AKAV、BATV、JEV、PRRSV、PRV、PCV2、CDV和CPV等无交叉反应。整个试验过程仅需3~4 h,且能高通量检测,敏感度达2.03×101copies/μL,比普通RT-PCR高100倍。对3种浓度病毒cDNA进行检测,每个浓度Cq值变异系数均≤2%,表明该方法具有良好重复性。应用本方法对现场蚊虫样品携带GETV进行检测,共检出8份阳性样品,经病毒分离及测序,确定8份标本均为GETV,表明本方法在对现场样品GETV的筛查中具有良好的应用价值。
总之,在本研究中,我们建立了一种快速,简便,特异且灵敏的TaqMan RT-qPCR方法用于检测GETV,尤其适用于少量感染GETV的蚊子和血清样品的快速检测和定量。
