过表达TPL2蛋白PK-15细胞系的建立及其功能验证
2020-07-22郝军红闫鸣昊张大俊张学刚申超超徐国伟李国丽张克山郑海学刘湘涛
郝军红,闫鸣昊,张大俊,张学刚,申超超,徐国伟,李国丽,张克山,郑海学,刘湘涛
(中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室/农业部畜禽病毒学重点开放实验室国家口蹄疫参考实验室,甘肃 兰州 730046)
TPL2是丝氨酸/苏氨酸激酶,最初被鉴定为原癌基因并在造血和非造血功能区表达[1]。全长的TPL2的开放阅读框会编码含467个氨基酸(amino acid,简称aa)的胞质蛋白,由于mRNA上存在2个翻译起始位点甲硫氨酸1(Methionine1,简称M1)和M30,TPL2 mRNA会编码58 000和52 000大小的2种蛋白[2]。TPL2信号传导在先天性和适应性免疫以及癌症中作为潜在的原癌基因发挥重要作用[3]。在未受刺激的细胞中,TPL2与NF-κB1p105组成性相关,这种相互作用对于TPL2稳定性是必需的,但阻断TPL2激酶活性[4]。IKKβ对p105的磷酸化导致TPL2释放[5]。IKKβ还介导TPL2在T290和S400的磷酸化,其调节TPL2激酶活性[5-8]。一旦被磷酸化,TPL2瞬时转导信号,但不稳定,快速通过蛋白酶体降解[4,9]。活化的TPL2直接磷酸化MEK1/2,其然后激活ERK1/2[10-11]。除了这个主要功能,TPL2也涉及MAPK8(JNK),MAPK14(P38)的活化,和转录因子NFAT和NF-κB[12-15]。此外,TPL2在先天免疫中的作用研究仅限于细菌感染模型,目前还缺乏病毒病原体方面的研究。TPL2在病毒感染期间以IRF7依赖性方式被诱导和激活,活化后的TPL2可抑制IRF3的转录活性,同时促进IRF3:IRF7二聚体的形成和激活ERK途径。缺乏TPL2导致抗病毒转录组的改变,最终增加细胞对病毒的易感性[16]。前期研究报道在TPL2缺陷的小鼠胚胎成纤维细胞中水泡性口炎病毒(VSV)的复制增加[16],因此,通过整合先天性和适应性抗病毒免疫应答,在流感病毒感染期间,TPL2限制病毒复制并促进宿主保护。
为获得稳定表达TPL2的PK-15/TPL2细胞系,用于对抗病毒如口蹄疫病毒(foot-and-mouth disease virus,FMDV)和猪塞内加谷病毒(Seneca Valley virus,SVV)进行评价,本试验拟构建稳定高表达TPL2的细胞模型,不仅为抗病毒研究TPL2的生物学活性机制研究奠定基础,也为FMDV或SVV病毒所致疾病的疫苗制备提供模型。
1 材料与方法
1.1 材料猪肾传代细胞PK-15由兰州兽医研究所口蹄疫流行病学实验室保存;10%胎牛血清(BI),DMEM培养基(Thermo fisher scientific),Opti-MEM、双抗(青霉素和链霉素溶液)(GIBICO),0.25% EDTA胰酶 (Gibco),PBS(Hy-Clone);Trizol(TaKaRa);口蹄疫毒株A/GDMM/CHA/2013,SVV毒株由兰州兽医研究所口蹄疫参考实验室提供;LipofectamineTM 3000(Invitrogen);5×Golden RT MasterMix (with dsDNase),20×Oligo dT(25)&Random Primer,Rnase Free H2O(HaiGene)。
1.2 仪器激光共聚焦显微镜(德国LEICA公司),GLOMAX化学发光检测仪(PROMEGA公司),电热恒温水浴锅(上海一恒仪器公司),5804R高速冷冻离心机、小型高速离心机(德国Eppendorf公司),凝胶成像仪(美国Bio-Rad公司),制冰机(FOCUSUN公司),紫外可见分光光度计(上海昂拉仪器公司),DYY-12型稳压电泳仪(北京六一仪器厂),生物安全柜(苏州苏净集团),96孔板摇床(其林贝尔公司),ABI梯度PCR仪、CO2恒温培养箱、QuanStudio5定量PCR仪,700系列-80℃冰箱(美国Thermo公司),实时荧光定量PCR仪(Bio-Rad)。
1.3 方法
1.3.1重组慢病毒载体Lv-TPL2的构建 利用化学合成法重组慢病毒载体Lv-TPL2载体构建:合成Sus scrofa (pig) TPL2基因,序列见NCBI上XM_021064737.1;两段酶切位点为:XbaⅠ和BamHⅠ,酶切重连插入到慢病毒载体Lv-PCDH的MCS区。
1.3.2定量引物设计与合成 引物序列见表1。

表1 试验引物序列
1.3.3细胞的转染和接毒 实时定量PCR法检测细胞内的有关基因mRNA的相对表达量。包括总RNA的提取、RNA的逆转录和实时荧光定量RT-PCR。具体方法参照文献[17]。
1.3.4间接免疫荧光实验、毒价测定 间接免疫荧光实验、毒价测定实验检测病毒的复制。具体方法参照文献[18]。
2 结果
2.1 慢病毒载体Lv-TPL2的构建对TPL2 mRNA在PK细胞中的表达进行测定结果显示,与pCDH- PK-15细胞株相比,试验组PK-15/TPL2细胞株中TPL2 mRNA表达明显升高,表达量为pCDH- PK-15细胞株的250倍,差异极显著(P<0.01)(图1)。表明Lv- TPL2稳定转染PK-15细胞能转录出相应的mRNA,外源基因已整合到 PK-15细胞基因组。qRT-PCR试验结束后,利用核酸电泳实验对qRT-PCR的产物进行验证,琼脂糖凝胶电泳结果显示,对于β-actin基因扩增产物的条带一致时,PK-15/TPL2细胞株TPL2基因与pCDH-PK-15细胞株相比,差异明显(图 2)。
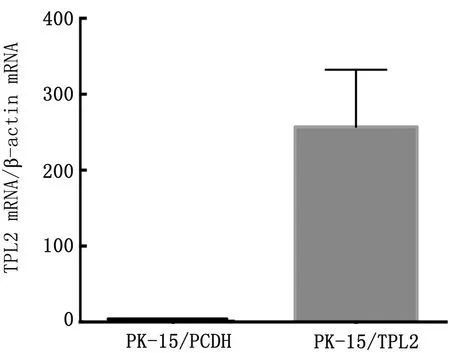
图1 qRT-PCR验证TPL2蛋白在PK-15/PCDH、PK-15/TPL2细胞表达

图2 核酸电泳试验验证TPL2的qRT-PCR产物
2.2 qRT-PCR鉴定接毒FMDV后对PK-15/TPL2细胞株中TPL2 mRNA的表达进行测定, qRT-PCR结果表明,与PK-15/ PCDH细胞株相比,在接毒FMDV后,试验组PK-15/TPL2细胞株中TPL2mRNA表达明显升高,差异极显著(图3)。
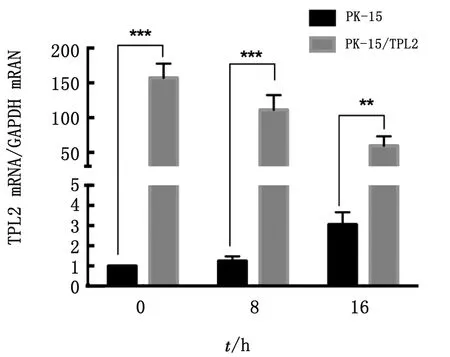
图3 PK-15/TPL2细胞接FMDV后实时定量检测TPL2mRNA转录水平变化 注:*P<0.05;**P<0.01;***P<0.001。下同
2.3 qRT-PCR/IFA鉴定接毒FMDV后在PK-15/TPL2细胞株抑制FMDV病毒的复制在接毒后8,16 h时收取的样品中,PK-15/TPL2细胞中FMDV的mRNA表达量均低于野生型PK-15细胞中FMDV的mRNA表达量(图4)。也就是说PK-15/TPL2细胞与野生型PK-15相比在接毒后8,16 h均能抑制FMDV的复制。这是因为PK-15/TPL2细胞在病毒刺激下过量表达TPL2,进而抑制了FMDV病毒的复制。在接毒后16 h时的样品中,PK-15/TPL2细胞中的病变程度均远低于野生型PK-15细胞的病变程度(图5)。这表明PK-15/TPL2细胞可以通过过量表达TPL2进而抑制FMDV病毒的复制。
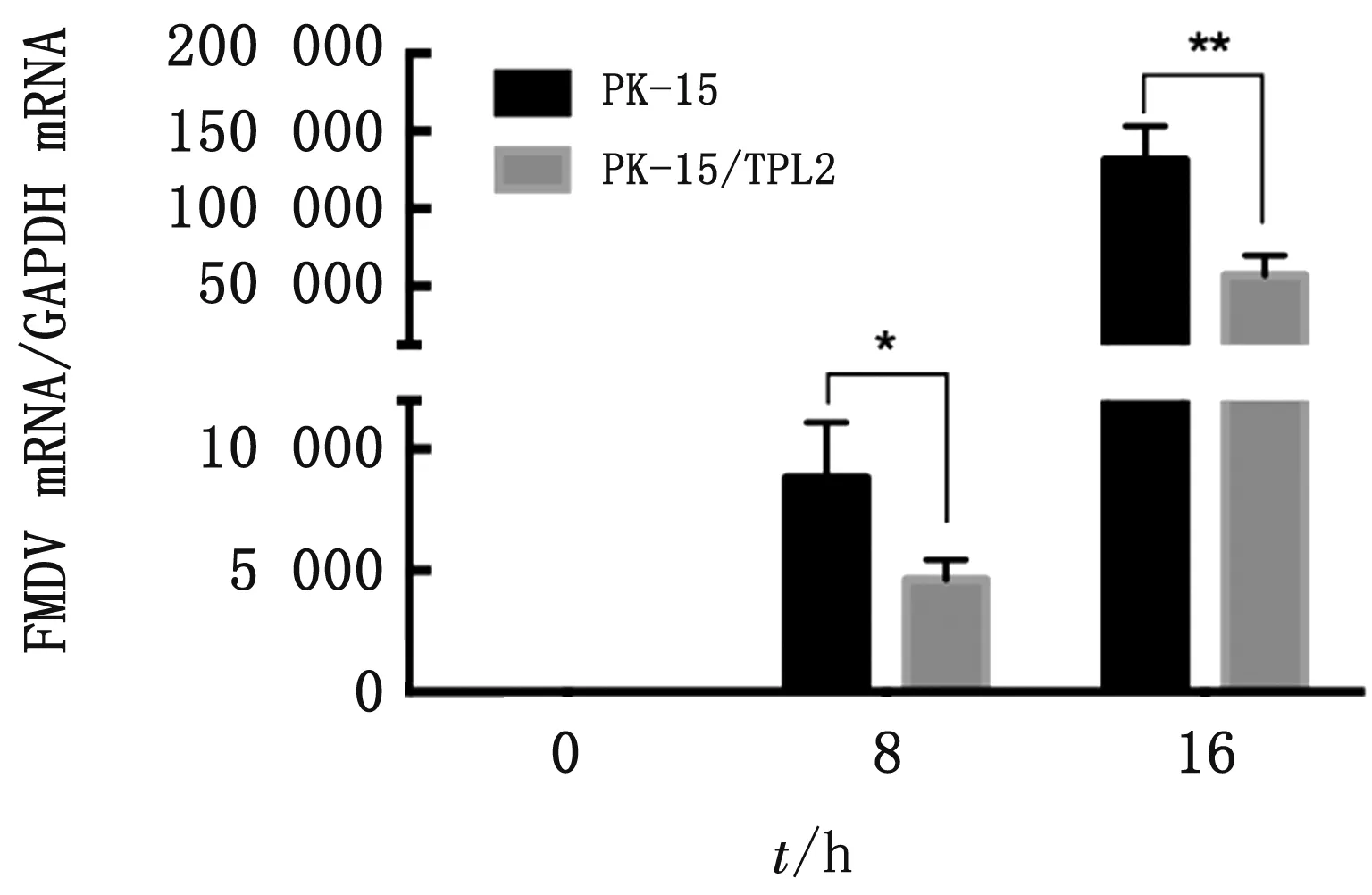
图4 PK-15/TPL2细胞系通过qRT-PCR验证显着抑制FMDV的复制
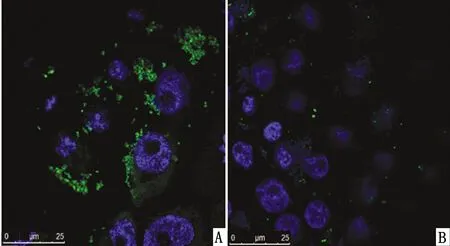
图5 PK-15/TPL2细胞系通过IFA显着抑制FMDV的复制(63×) A.感染FMDV 16 h的PK-15;B.感染FMDV 16 h的PK-15/TPL2
2.4 qRT-PCR/IFA鉴定接毒SVV后在PK-15/TPL2细胞株抑制SVV病毒的复制结果显示,在接毒后8,16 h时的样品中,PK-15/TPL2细胞中SVV的mRNA表达量低于野生型PK-15细胞中SVV的相对表达量(图6)。在接毒后16 h时的样品中,PK-15/TPL2细胞中的病变程度均远低于野生型PK-15细胞的病变程度(图7)。说明与野生型PK-15相比,PK-15/TPL2细胞抑制SVV的复制。
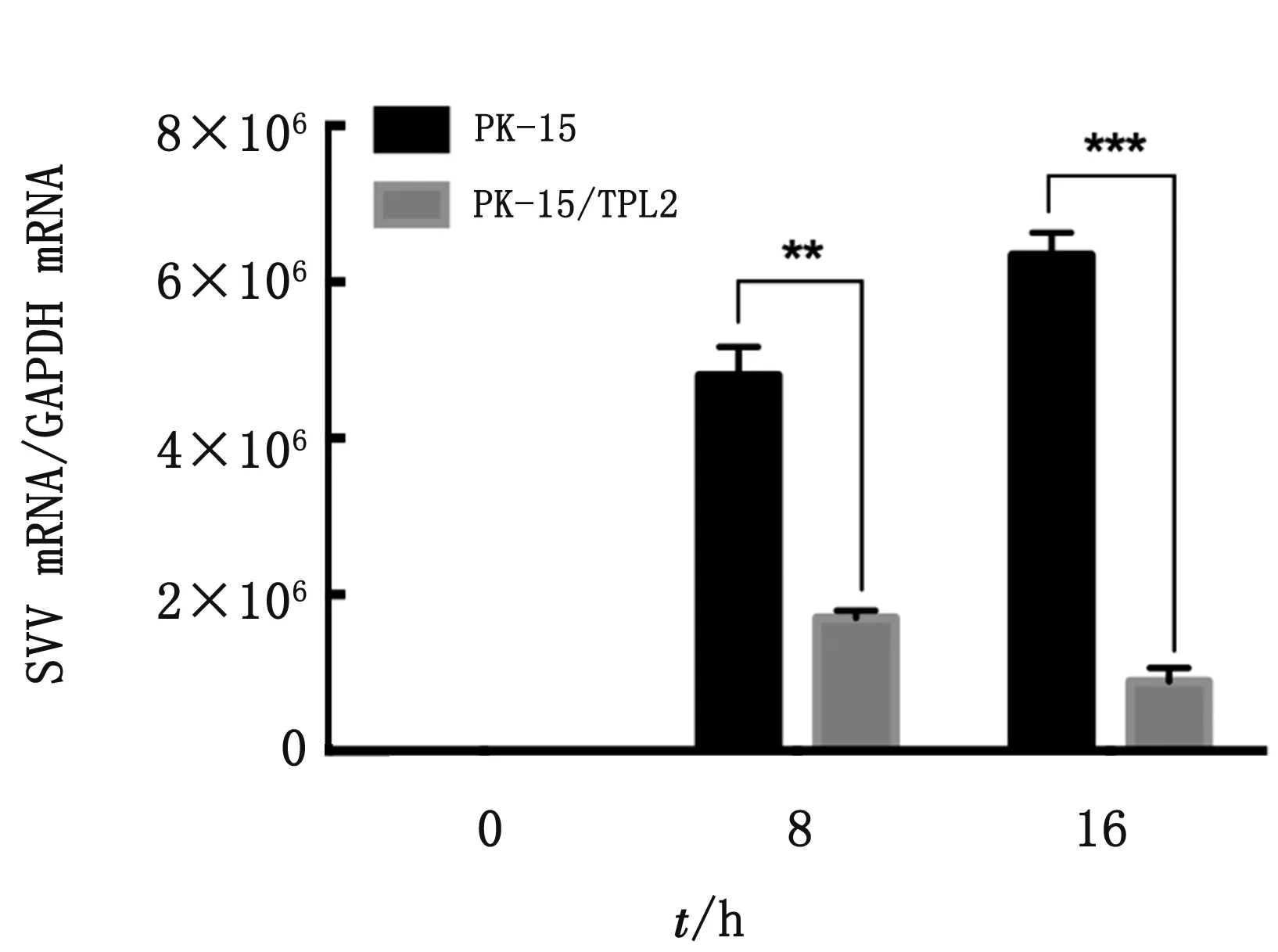
图6 PK-15/TPL2细胞系通过qRT-PCR显着抑制SVV的复制

图7 PK-15/TPL2细胞系通过IFA显着抑制SVV的复制(63×) A.感染SVV 16 h的PK-15;B.感染SVV 16 h的PK-15/TPL2
2.5 FMDV/SVV病毒在细胞株PK-15/TPL2中TCID50的测定按Reed-Muench法计算FMDV病毒的TCID50,PK-15细胞的TCID50为10-5.8/mL,PK-15/TPL2细胞系的TCID50测定结果为10-4.4/mL。按Reed-Muench法测定SVV病毒的TCID50,PK-15细胞的TCID50为10-8.5/mL。PK-15/TPL2细胞系的TCID50测定结果为10-5.5/mL。结果表明细胞株PK-15/TPL2明显抑制FMDV/SVV病毒的复制。
3 讨论
FMDV结构蛋白包括VP1、VP2、VP3和VP4,一般认为VP1起着重要的抗原作用,其21-40肽促能进机体产生细胞免疫反应[19],而141-160肽能引起机体的体液免疫反应[20]。由于FMDV的RGD序列可以通过天然免疫受体感染细胞,且具有抗体依赖增强作用[21],说明FMDV等小RNA病毒受外界条件变化时(连续传代,免疫压力等)会产生不同的抗原变异株[22],导致疫苗的免疫力减弱,很难通过疫苗手段进行控制与根除。因此,科学家们在研究病毒变异和疫苗的基础上开始关注病毒与宿主之间的关系。从病毒和感染细胞之间的相互作用来看,多种病毒可通过诱导细胞凋亡完成病毒自我增殖[23-24]。MAP3K8又称TPL2,是一种丝氨酸/苏氨酸激酶,在不同的组织中都有着广泛的表达。TPL2信号转导在先天性和适应性免疫以及在癌症中作为潜在的原癌基因起着重要作用[3]。TPL2已被认为是I型(IFN-α/β)和II型(IFN-γ)IFN的关键调节因子,是多种病毒感染途径的重要组成部分。TPL2以细胞类型特异性方式差异调节IFN-α/β和IFN-λ的诱导。尽管TPL2在IFNα/β和IFNλ的调节中都很重要,但只有IFNλ在体外和体内流感病毒感染期间需要TPL2诱导[25]。研究报道在TPL2缺陷的小鼠胚胎成纤维细胞中水泡性口炎病毒(VSV)的复制增加[16]。
本试验通过激光扫描共聚焦显微镜技术、间接免疫荧光实验、TCID50以及实时荧光定量等手段分别从基因水平、转录水平等验证已成功构建能够稳定表达TPL2的PK-15/TPL2细胞株。该细胞系连续传代TPL2蛋白不丢失,说明具有遗传稳定性。TPL2其蛋白主要表达于PK-15细胞质,因此,通过整合先天性和适应性抗病毒免疫应答,在流感病毒感染期间,TPL2限制病毒复制并促进宿主保护。PK-15/TPL2细胞株接种FMDV、SVV后,与正常PK-15细胞相比,细胞病变效应减弱。RT-PCR分析时,PK-15/TPL2细胞中FMDV、SVV相对表达量明显降低。由此说明整合在细胞上的TPL2成功获得表达(图1),从图4~7中也可以看出TPL2的表达使得FMDV、SVV病毒复制效果减弱。本试验采用慢病毒表达系统和基因合成技术建立一种可以降低FMDV、SVV复制的工具,慢病毒表达载体,包含了包装、转染、稳定整合所需要的遗传信息,它通过感染细胞,并随着宿主细胞的分裂而扩增,实现外源基因在宿主细胞内稳定的表达的目标,与瞬时转染相比,慢病毒转染能够达到转染效果更稳定,目标更准确[26],同时包装的慢病毒可以感染各种类型细胞,从而为本试验的成功构建提供有利途径。上述数据已证实,本次构建的细胞PK-15/TPL2细胞被稳定整合,具有遗传稳定性。
基因合成技术是在目的DNA片段两端插入酶切位点,TPL2基因5′端和3′端引入酶切位点XbaⅠ和BamHⅠ,酶切的基因和慢病毒载体Lv-PCDH载体后重连,得到重组慢病毒载体Lv-TPL2。高效、快速地将目的基因克隆到目的载体上,通过去除冗长的亚克隆步骤节省操作时间,不同于传统的限制性内切酶方法,避免了目的片段内存在切点的问题而使得大片段DNA保持其完整性,大大提高了克隆效率。依靠基因合成技术,使目的基因TPL2转移到了目标载体中,成功构建Lv-TPL2载体。本试验利用该技术通过重组高效、快速获得表达骨架,构建的PK-15/TPL2细胞与正常PK-15细胞相比,形态上稍有改变,经细胞IFA实验、TCID50试验等一系列试验验证,其生物学特性没有异常,所以无论科学研究还是生产疫苗,该PK-15/TPL2细胞完全可以用于小批量或大规模生产使用。
本试验旨在通过慢病毒表达系统,成功建立稳定表达TPL2的PK-15/TPL2细胞株:该细胞株因稳定表达TPL2蛋白具有明显抑制FMDV、SVV病毒复制的功能。不仅可以从细胞模型水平阐明抑制FMDV、SVV复制的关键靶基因,该细胞系的建立也为病毒的分离和研究TPL2的生物学活性奠定了基础。
