车前草提取物对糖尿病肾病大鼠肾功能、糖脂代谢、炎症因子及脂肪细胞因子的影响▲
2020-07-22王鑫蕾张荣萍赵小芹顾云娟
王鑫蕾 张荣萍 赵小芹 顾云娟
(南通大学附属医院内分泌代谢科,江苏省南通市 226001,电子邮箱:411077007@qq.com)
糖尿病肾病是糖尿病慢性微血管并发症之一。随着我国糖尿病发病率的逐年升高,糖尿病肾病的发病率也呈上升趋势,成为终末期肾病的第二大致病因素[1]。糖尿病肾病的发病涉及多种因素,如糖脂代谢紊乱、氧化应激、血流动力学异常、炎症因子及遗传易感因素等,其中糖脂代谢紊乱与炎症因子起到至关重要的作用[2]。车前草为车前科植物,又名车前、钱串草、车轮菜、猪耳菜等,具有清热利尿、抗炎、调节血糖血脂、降血尿酸、抗衰老、护肝等药理作用[3]。本研究观察车前草提取物对糖尿病肾病模型大鼠肾功能、糖脂代谢、炎症因子及脂肪因子的影响,以探讨车前草提取物对糖尿病肾病的治疗作用及其可能的机制。
1 材料与方法
1.1 实验动物 健康雄性8~10周龄SD大鼠60只,购自南通大学实验动物中心[许可证号:SYXK(苏)2017-0046],在无特定病原体级环境中饲养,12 h明暗交替。
1.2 实验药物、试剂及仪器 实验药物包括车前草干燥全草(南通大学附属医院中药房,批号:1709001),缬沙坦(北京诺华制药有限公司,批号:X2684),链脲佐菌素(Sigma公司,批号:S0130)。实验试剂包括尿蛋白定量试剂盒(南京建成生物工程研究所,批号:20170829),白细胞介素6(interleukin 6,IL-6)酶联免疫吸附检测(enzyme-linked immunosorbent assay,ELISA试剂盒(美国R&D公司,批号:10184-1-AP),转化生长因子β(transforming growth factor β,TGF-β)ELISA试剂盒(美国R&D公司,批号:18978-1-AP),脂联素ELISA试剂盒(上海远慕生物科技有限公司,批号:QY-s2089),游离脂肪酸结合蛋白4(free fatty acid-binding protein 4,FABP4) ELISA试剂盒(上海一研生物科技有限公司公司,批号:EY-3533);肌酐、尿素氮、总胆固醇、三酰甘油试剂盒均购自南京建成生物研究所(批号:C011-2-1、C013-2-1、A111-2-1、A110-2-1)。实验仪器包括血糖试纸(Bayer公司,批号:DP9DM3F10A),血糖仪(Bayer公司,批号:SN9531964 ),LED-A2000天平(福建华志公司),Allegra®X-15R Centrifuge型离心机(Beckman Coulter公司)。
1.3 实验方法
1.3.1 分组及建模:将60只大鼠按随机数字表法分为正常组、模型组、对照组、低剂量组、中剂量组与高剂量组,每组10只。除正常组外,其余大鼠均使用高糖高脂饲料喂养两周后,一次性腹腔注射32%链脲佐菌素(按照45 mg/kg)建立糖尿病肾病大鼠模型,血糖≥16.7 mmol/L、24 h尿蛋白含量>30 mg,提示建模成功。
1.3.2 车前草提取物制备:取车前草干燥全草100 g,加入8倍药材质量的65%乙醇,加热回流2 h,共3次。将3次回流滤液浓缩至100 mL,生药含量1 g/mL,冷藏备用,车前草提取物的给药剂量根据生药量计算。
1.3.3 给药方式:建模成功3 d后,对照组大鼠给予40 mg/kg缬沙坦灌胃,低剂量组、中剂量组与高剂量组分别给予1.17 g/kg、2.34 g/kg、4.68 g/kg车前草提取物灌胃,模型组大鼠给予与车前草实验组等体积的0.9%氯化钠灌胃,均1次/d,持续两周。正常组大鼠不做任何干预。
1.4 观察指标 (1)干预两周后,收集6组大鼠24 h尿液,采用考巴斯亮蓝法测定24 h尿蛋白含量。(2)大鼠禁食12 h后,记录大鼠体重,尾静脉断尾采血0.5~1.0 mL,采用葡萄糖氧化酶法检测血糖水平,然后在4℃条件下,6 000 r/min离心5 min分离血清,使用ELISA法检测脂联素及FABP4水平;眼内眦取静脉血0.3~1.0 mL,在4℃条件下,6 000 r/min离心5 min分离血清后采用ELISA法检测血清IL-6水平,肌氨酸氧化酶法检测肌酐,脲酶法检测尿素氮,单试剂磷酸甘油氧化酶-过氧化物酶法检测总胆固醇及三酰甘油。(3)二氧化碳窒息处死大鼠后,剥离肾脏周围脂肪组织后迅速摘除双肾,计算肾指数=双肾重量(mg)/处死前总体重(g)。(4)取20 μg右肾组织,磷酸缓冲盐溶液冲洗后,将肾脏组织剪碎,以1 ∶9的比例加入预冷磷酸缓冲盐溶液,于冰上匀浆,将匀浆液转移至离心管,在4℃条件下,2 000 r/min离心10 min,以ELISA法检测肾脏组织TGF-β水平。所有检测均严格按照试剂盒说明书完成。
1.5 统计学分析 采用SPSS 19.0软件进行统计学分析。计量资料用(x±s)表示,多组间比较采用方差分析,两两比较采用SNK-q检验。以P<0.05表示差异有统计学意义。
2 结 果
2.1 6组大鼠肾指数的比较 6组大鼠肾指数差异有统计学意义(P<0.05)。其中模型组、对照组、低剂量组、中剂量组及高剂量组肾指数均高于正常组;对照组、低剂量组、中剂量组及高剂量组的肾指数均低于模型组;低剂量组、中剂量组的肾指数均高于对照组(均P<0.05),而高剂量组与对照组比较无明显差异(P>0.05);低、中、高剂量组的肾指数依次下降(均P<0.05)。见表1。
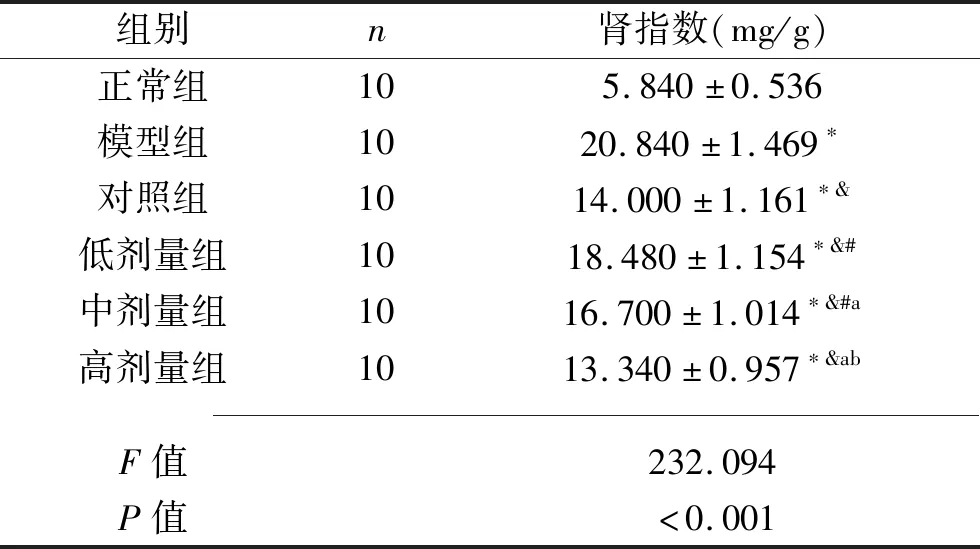
表1 6组大鼠肾指数的比较(x±s)
2.2 6组大鼠血糖、肾功能及血脂水平比较 其余5组的血糖、肌酐、尿素氮、总胆固醇及三酰甘油水平均高于正常组(均P<0.05);与模型组比较,对照组及各剂量组的肌酐、尿素氮及三酰甘油均降低,各剂量组血糖均降低,对照组及中、高剂量组总胆固醇水平降低(均P<0.05);与对照组比较,中、高剂量组的血糖、肌酐及尿素氮水平均降低,各剂量组的三酰甘油水平均降低,但低、中剂量组的总胆固醇水平升高(均P<0.05);低、中、高剂量组的血糖、肌酐、尿素氮、总胆固醇水平均依次降低,且中、高剂量组的三酰甘油水平低于低剂量组(均P<0.05)。见表2。
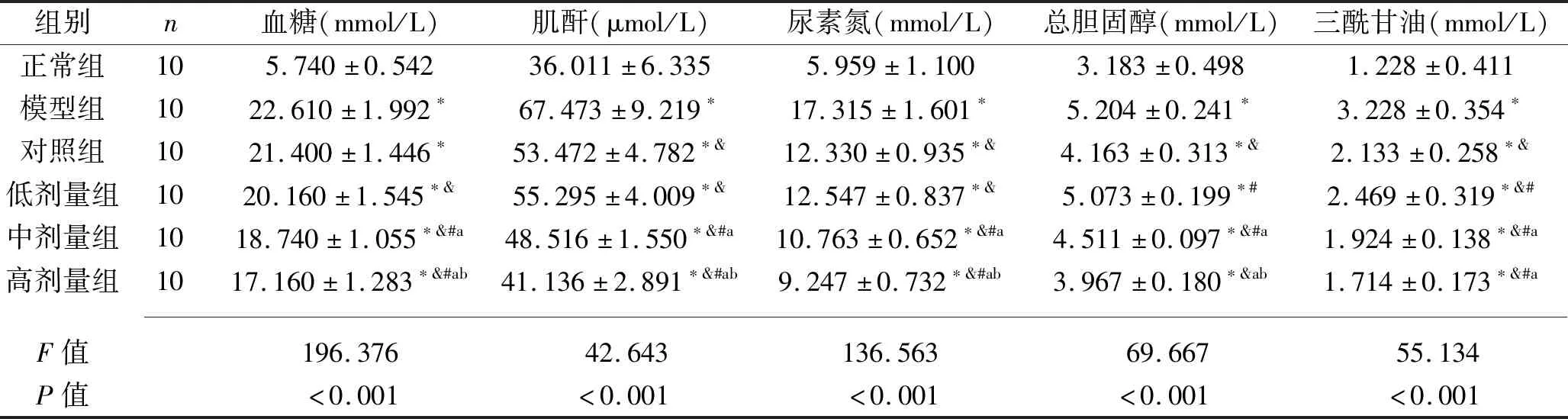
表2 6组大鼠血糖、肾功能及血脂水平比较(x±s)
2.3 6组大鼠24 h尿蛋白、血清IL-6、脂联素、FABP4及肾脏组织TGF-β水平比较 与正常组比较,其余5组的24 h尿蛋白、肾脏组织TGF-β以及血清脂联素、FABP4均升高,且模型组的血清IL-6升高而4个干预组血清IL-6下降(均P<0.05);与模型组比较,各干预组的24 h尿蛋白、血清IL-6、脂联素均下降,且对照组及中、高剂量组的血清FABP4、肾脏组织TGF-β均降低(均P<0.05);与对照组比较,各剂量组的24 h尿蛋白均升高且血清IL-6降低,高剂量组血清FABP4均降低,但低、中剂量组的血清脂联素、肾脏组织TGF-β以及低剂量组的血清FABP4均升高(均P<0.05);低、中、高剂量组的24 h尿蛋白、血清脂联素、IL-6、FABP4以及肾脏组织TGF-β均依次降低(均P<0.05)。见表3。
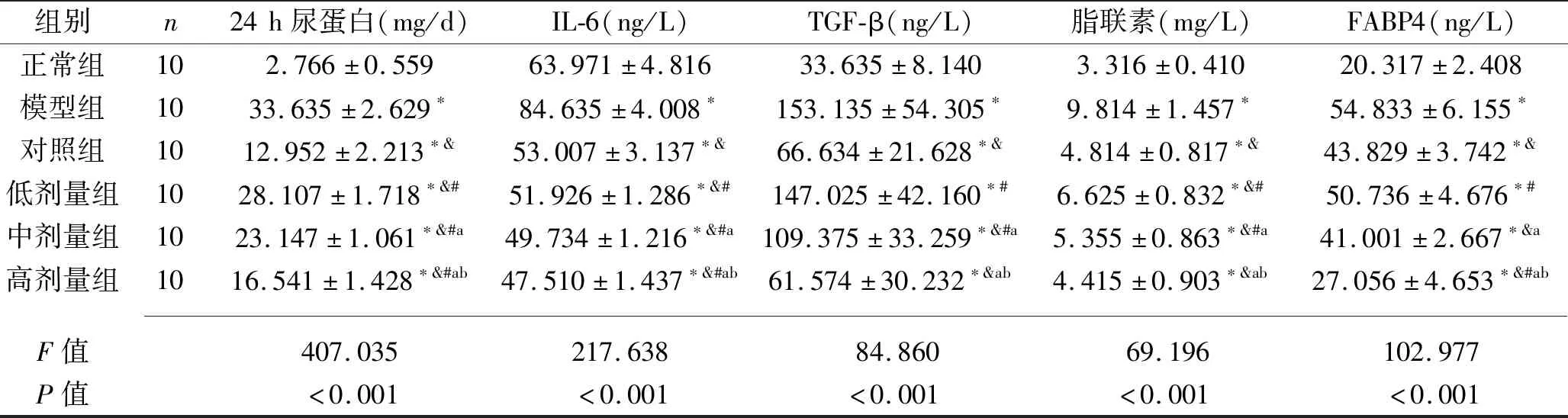
表3 6组大鼠24 h尿蛋白、血清IL-6、脂联素、FABP4及肾脏组织TGF-β水平比较(x±s)
3 讨 论
糖尿病肾病目前已成为终末期肾病重要病因[4],临床特征主要包括肾小球滤过率下降及尿蛋白量增加。糖尿病肾病的病理变化为:初始阶段肾小球高灌注及高滤过,致肾小球滤过率增加,肾小球毛细血管尿白蛋白漏出,从而导致结构改变,如肾小球基底膜增厚、肾小球肥大、肾小球硬化、系膜细胞扩张、足细胞损伤及丢失[5]。糖尿病肾病的发病机制复杂多样:在糖脂代谢紊乱前提下,机体内氧化应激被激活,促炎症介质如IL-6等释放,与膜结合IL-6受体及gp130信号转换链结合,从而促进肾小管间质成纤维细胞增殖与分化,导致肾小球内浸润单核巨噬细胞,引起细胞外基质增多,促进肾小球及肾小管硬化[6]。而TGF-β为多效性细胞因子,作为肾脏纤维化的重要介质,促进下游信号通路的激活,导致细胞外基质过度沉积,从而引起肾间质纤维化致肾小球硬化[7]。本研究结果显示,车前草提取物各剂量组糖尿病肾病大鼠的肾脏指数、血糖、肾功能指标、24 h尿蛋白、三酰甘油、IL-6均低于模型组(均P<0.05),且中、高剂量组肾脏组织TGF-β、总胆固醇均低于模型组(均P<0.05),提示车前草提取物可以降低糖尿病肾病大鼠模型IL-6及TGF-β水平,改善肾功能及糖脂代谢从而预防肾小球及肾小管硬化。以上指标(除三酰甘油外)均随药物剂量的增加而降低,提示高剂量的车前草提取物干预效果更好。
脂联素是脂肪细胞分泌的内源性活性因子,由胰岛素刺激而分泌,具有抗胰岛素抵抗、抗动脉粥样硬化、抗炎反应、调节糖脂代谢等作用,从而保护内皮细胞,促进游离脂肪酸氧化、提高外周组织胰岛素敏感性、抑制葡萄糖再生[8]。脂联素与胰岛素抵抗具有相关性,而胰岛素抵抗通过多种途径损伤肾脏组织,因此随着糖尿病肾病不断发展,脂联素水平与糖尿病肾脏功能受损程度呈正相关[9]。本研究结果显示,糖尿病肾病大鼠模型组的脂联素水平高于正常组(P<0.05),且对照组、各剂量组的脂联素水平均低于模型组,而低剂量组、中剂量组的脂联素水平均高于对照组(均P<0.05),而高剂量组脂联素水平与对照组相比无显著差异(P>0.05),提示车前草提取物能降低糖尿病肾病大鼠血清脂联素水平,从而改善肾脏功能受损程度,尤其是高剂量的效果最佳。
FABP4由脂肪细胞及巨噬细胞分泌,主要参与游离脂肪酸储存、转运及代谢,并能调节细胞增殖与分化;高FABP4水平与超重及肥胖、糖脂代谢紊乱、动脉粥样硬化相关,是代谢综合征的早期危险因子[10]。此外,FABP4在非糖尿病及2型糖尿病终末期肾脏损伤患者体内均升高[11],且其是2型糖尿病早期糖尿病肾病的生物学标志[12]。本研究结果显示,糖尿病肾病大鼠模型组的血清FABP4水平高于正常组(P<0.05),且对照组、中剂量组及高剂量组的FABP4水平均低于模型组,而低剂量组FABP4水平高于对照组,高剂量组FABP4水平低于对照组(均P<0.05),提示车前草提取物能降低糖尿病肾病大鼠血清FABP4水平,从而对糖尿病肾病大鼠肾脏损伤起到保护作用,高剂量车前草提取物作用最为显著。
此外,既往研究表明,车前草可分离出黄酮及其苷类、多酚类、多糖类、三萜及甾体类、苯甲基咖啡酰糖脂类等多种化合物[13],其中黄酮及其苷类、多酚类具有抗氧化酶活性,能有效地清除2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基和1,1-二苯基-2-三硝基苯肼自由基,抑制脂质体过氧化进程,提高体内抗氧化酶活性,减轻细胞内部自由基损伤,从而达到抗氧化作用[14]。同时,车前草多糖可通过增加白细胞、T淋巴细胞亚群及淋巴细胞数量,促进巨噬细胞自噬,而提高机体免疫活性[15]。因此,车前草可能通过抗氧化、调节机体免疫活性的途径治疗糖尿病肾病。
综上所述,车前草提取物可改善糖尿病肾病大鼠糖脂代谢及肾功能,下调炎症因子、脂肪因子的表达,其中高剂量(4.68 g/kg)车前草提取物的干预效果更佳。但本研究仍存在不足,如样本量较少、观察时间较短、观察指标较少等,在后续研究中将进一步探讨车前草提取物对糖尿病肾病的影响及机制。
