壮药拔毒生肌膏对糖尿病大鼠创面愈合及表皮生长因子、血管内皮生长因子、溶菌酶表达水平的影响▲
2020-07-22周翠萍江志雄
周翠萍 张 力 江志雄
(1 广西中医药大学第一临床医学院,南宁市 530001,电子邮箱:873072260@qq.com;2 广西中医药大学第一附属医院创面修复、周围血管科, 南宁市 530012)
近年来,糖尿病已成为困扰全球的健康问题,其患者数量呈上升趋势,虽不直接危害生命,但它严重影响患者的生活质量,已被纳入中国慢性疾病谱,且在老年病中排名前十[1-2]。糖尿病溃疡是其严重的并发症之一,由于糖尿病溃疡所致截肢的患者人数一直居高不下,已成为近年来学者研究的热点。广西中医药大学第一附属医院临床上应用壮药拔毒生肌膏治疗糖尿病溃疡、压疮、缺血性溃疡等慢性难愈合创面取得良好效果,但其作用机制有待进一步研究。前期研究表明,壮药拔毒生肌膏能够促进大鼠氧化应激性创面愈合,并上调其表皮生长因子(epidermal growth factor,EGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)及溶菌酶的表达[3]。在此基础上,本研究采用腹腔注射链脲佐菌素(streptozotocin,STZ)联合背部打孔法建立糖尿病大鼠创面模型,24 h后用药干预,光镜下观察创面组织病理情况并计算大鼠创面愈合率,同时检测血清和组织中EGF、VEGF及血清溶菌酶水平变化情况,进一步研究壮药拔毒生肌膏促进糖尿病创面愈合的作用及其机制。
1 材料与方法
1.1 实验药物 壮药拔毒生肌膏由宫粉、轻粉、硼砂、白芷、大黄、槐枝、白蜡、猪脂等按一定比例配制,由广西中医药大学第一附属医院制剂科制备;重组牛碱性成纤维细胞生长因子凝胶(贝复济,珠海亿胜生物制药,批号:S20040001)。
1.2 实验动物 健康雄性SD大鼠96只,无特定病原体级,体重(225±15)g,购自长沙市天勤生物技术有限公司,合格证号:SCXK(湘)2014-0011。适应性饲养1周后开始实验,所有实验动物均取得广西中医药大学伦理审查委员会审批。
1.3 实验试剂及仪器 STZ(Sigma公司,货号:S0130),柠檬酸钠缓冲液溶解,避光,冰浴,反复吹打至完全溶解为淡黄色澄清液体,现配现用;EGF、VEGF放射免疫试剂盒(北京华英生物,批号均为20180421),溶菌酶测试盒(南京建成生物工程所,批号:AO50-1),大鼠 EGF 酶联免疫试剂盒(联科生物工程研究所,批号:EK3831/2),VEGF抗体试剂盒(武汉博士德,批号:BA0407)。低速离心机(上海安亭科学仪器厂,型号:TDL-80-2B),轮转式切片机(徕卡公司,型号:RM2235),倒置显微镜和成像系统(日本尼康公司,型号:Nikon Ci-S、Nikon DS-U3),脱水机和包埋机(武汉俊杰电子有限公司,型号:JT-12S、JB-P7),全自动放免计数仪(西安核仪器厂,型号:XH-6020),酶标仪(Thermo Fisher Scientific公司,型号:Multiskan TC),恒温震荡培养箱(Thermo Fisher Scientific公司,型号:ST70-2),烤片机(常州国华电器有限公司,型号:DB-B2)。
1.4 分组及糖尿病大鼠模型的建立 按随机数字法将大鼠分为假手术组、模型组、贝复济组、拔毒生肌膏组,各24只。除假手术组外其余各组均腹腔注射STZ制作糖尿病大鼠模型[4]:诱导前禁食24 h,诱导时给予65 mg/kg STZ溶液腹腔注射,在30 min内完成注射,注射结束后更换垫料,1 h后喂食饲料。各组大鼠于注射前称体重并测定血糖,注射后72 h每日测定体重、血糖,持续2周。注射前随机血糖水平<8.9 mmol/L,注射后72 h随机血糖水平≥16.7 mmol/L,即视为糖尿病模型诱导成功,若血糖不达标者,3 d后补注射20 mg/kg STZ溶液,再监测血糖情况。
1.5 糖尿病大鼠创面模型的建立及干预 糖尿病大鼠模型制备成功1周后,制备大鼠创面模型[3]。先用标记笔在大鼠背部画出直径约为1.8 cm的圆形创面,腹腔注射10%水合氯醛溶液(1.2 mL/L),麻醉成功后采用组织剪沿标记笔笔记剪开皮肤组织,深至皮下,立即采用呋喃西林液清洁创面。根据创面大小将纱条剪成超出创面约0.5 cm小方块纱条,24 h后拔毒生肌膏组创面外敷拔毒生肌膏纱条,贝复济组创面外敷贝复济浸透纱条,假手术组和模型组创面外敷生理盐水纱条,最后各组均覆盖两层无菌干纱布,胶布固定,1次/d。持续干预12 d。
1.6 标本采集 药物干预后 3 d、6 d 及12 d各组按随机数字表法,分别取8只大鼠,10%水合氯醛溶液(大鼠30 mg/kg)腹腔注射麻醉,腹腔动脉采血2 mL,静置30 min后,3 000 r/min离心15 min,移液枪吸取上清液2 mL,放置-80℃冰箱待测。取血后采集相同位点创面组织,分成两份,一份创面组织用4%多聚甲醛常温固定,另一份组织置于冻存管,放置液氮中冻存待测。
1.7 检测指标
1.7.1 创面愈合率:用标记笔在透明方格纸画出各组大鼠创伤后24 h、3 d、6 d及12 d创面,以伤后24 h第一次画的创面面积为创伤面积,以各时相点取材时的创面面积为时相点创面面积。采用ImageJ软件计算创面面积。创面愈合率=[(创伤面积-时相点创面面积)/创伤面积]×100%[5]。
1.7.2 血清EGF、VEGF和溶菌酶的检测:参照EGF、VEGF放射免疫试剂盒说明书,检测血清EGF、VEGF的含量;根据溶菌酶试剂盒检测步骤,采用比浊法检测血清溶菌酶含量。
1.7.3 组织EGF和VEGF的检测:参照各试剂盒说明书,采用酶联免疫吸附法测定组织EGF表达;采用免疫组化链霉菌抗生物素蛋白-过氧化物酶检测组织VEGF表达。VEGF结果的判读:低倍镜下寻找阳性表达较集中的地方(在血管内皮细胞胞浆中呈现棕黄色),在400倍光镜下随机拍照3个视野,各计数100个细胞,结果采用半定量分析。首先对阳性强度进行评分,无表达为0分;弱阳性为血管内皮细胞胞浆内颗粒较细,显色高于背景,评为1分;阳性为血管内皮细胞胞浆内颗粒细而多,显色较明显,评为2分;强阳性为胞浆内阳性颗粒粗而多,显色明显,评为3分。然后把弱阳性的细胞数乘1分,阳性细胞数乘2分,强阳性细胞数乘3分,计算平均每张切片阳性细胞VEGF表达的累计积分[6]。
1.7.4 创面组织的病理观察:选择合适部位取材组织厚度约3 mm,常规组织脱水、浸蜡,石蜡包埋,切片,烤片,脱蜡,高浓度梯度酒精脱蜡,苏木精复染,盐酸分化,氨水返蓝,伊红染色,低浓度酒精冲洗,吹干,中性树胶封片,显微镜下观察创面组织生长情况(光学显微镜400倍)。
1.8 统计学分析 应用SPSS 23.0软件进行统计学分析。计量资料以(x±s)表示,方差齐则组间比较采用单因素方差分析,两两比较采用LSD-t检验,方差不齐则采用秩和检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 各组大鼠创面愈合率 模型组干预后3 d及12 d的创面愈合率均低于假手术组(均P<0.05)。与模型组比较,贝复济组干预后3 d及6 d的创面愈合率均升高,拔毒生肌膏组干预后6 d及12 d的创面愈合率均升高(均P<0.05);且拔毒生肌膏组各时间点的创面愈合率与假手术组比较差异均无统计学意义(P>0.05),而贝复济组干预后 12 d的创面愈合率低于假手术组和拔毒生肌膏组(均P<0.05)。见表1。
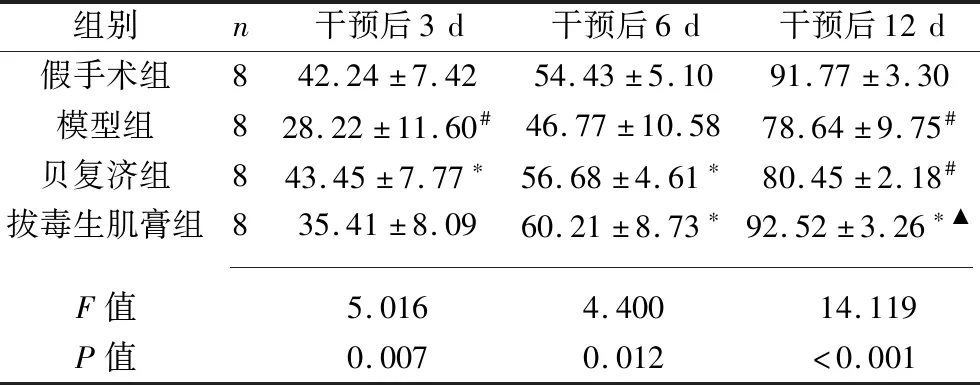
表1 不同时间点4组大鼠创面愈合率比较(x±s,%)
2.2 各组大鼠血清EGF和VEGF水平比较 (1)血清EGF水平:与假手术组比较,模型组干预后3 d的EGF水平降低(P<0.05),贝复济组和拔毒生肌膏干预后6 d及12 d EGF水平均升高(均P<0.05),而其余时间点3组血清EGF水平与假手术组比较差异均无统计学意义(均P>0.05);贝复济组和拔毒生肌膏组各时间点血清EGF水平均高于模型组;拔毒生肌膏组干预后6 d的血清EGF水平低于贝复济组(P<0.05),而其余时间点两组血清EGF水平差异无统计学意义(P>0.05)。见表2。(2)血清VEGF水平:与假手术组比较,模型组干预后3 d、6 d的VEGF水平降低,贝复济组干预后12 d的VEGF水平升高,拔毒生肌膏组干预后6 d VEGF水平降低(均P<0.05),而其余时间点3组血清VEGF水平与假手术组比较差异均无统计学意义(均P>0.05);贝复济组各时间点的血清VEGF水平均高于模型组,而拔毒生肌膏组干预后6 d、12 d的血清VEGF水平均高于模型组(P<0.05);各时间点,贝复济组与拔毒生肌膏组的血清VEGF水平差异均无统计学意义(均P>0.05)。见表2。

表2 不同时间点4组大鼠血清EGF、VEGF水平比较(x±s,ng/mL)
2.3 各组大鼠组织EGF、VEGF水平比较 (1)组织EGF水平:与假手术组比较,模型组干预后3 d的组织EGF水平升高,而干预后6 d及12 d组织EGF水平降低,贝复济组、拔毒生肌膏组干预后3 d的组织EGF水平降低,而干预后12 d的组织EGF水平升高(均P<0.05),其余时间点3组组织EGF水平与假手术组比较差异均无统计学意义(均P>0.05);与模型组比较,贝复济组、拔毒生肌膏组干预后3 d组织EGF水平降低,而其余时间点水平升高(均P<0.05);各个时间点,贝复济组与拔毒生肌膏组的组织EGF水平差异均无统计学意义(均P>0.05)。见表3。(2) 组织VEGF水平:与假手术组比较,模型组干预后3 d及6 d组织VEGF水平降低,拔毒生肌膏组干预后3 d组织VEGF水平降低(均P<0.05),其余时间点3组组织VEGF水平与假手术组比较差异均无统计学意义(均P>0.05);各个时间点,贝复济组与拔毒生肌膏组的组织VEGF水平均高于模型组(均P<0.05),但两组间组织VEGF水平差异均无统计学意义(均P>0.05)。见表3。
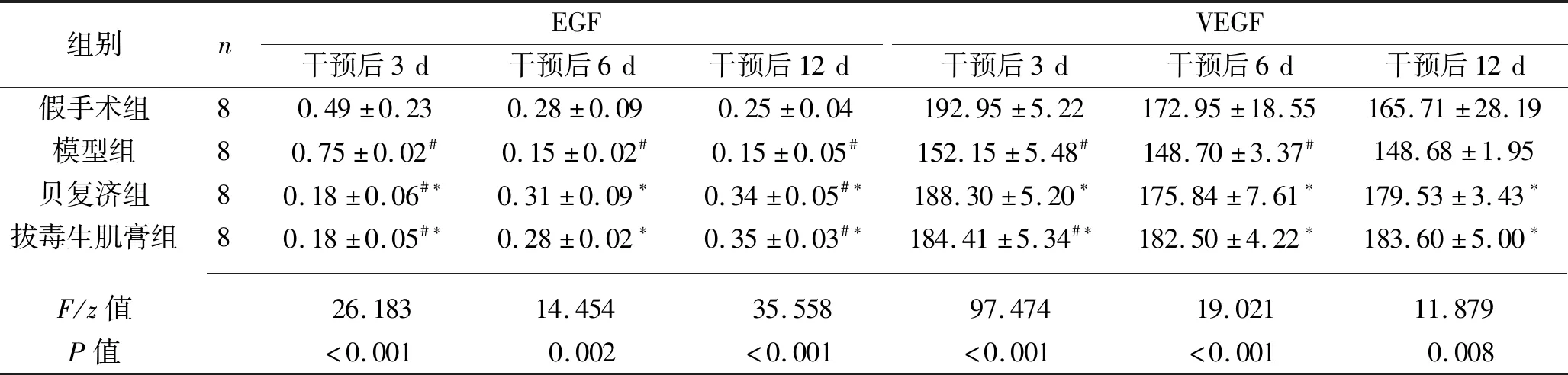
表3 不同时间点4组大鼠组织EGF、VEGF水平比较(x±s,ng/mL)
2.4 各组大鼠血清溶菌酶水平比较 与假手术组比较,模型组干预后3 d、12 d血清溶菌酶水平降低,拔毒生肌膏组、贝复济组干预后3 d的血清溶菌酶水平降低,而干预后6 d血清溶菌酶水平升高(均P<0.05),其余时间点3组血清溶菌酶水平与假手术组比较差异均无统计学意义(均P>0.05);各个时间点,贝复济组与拔毒生肌膏组血清的溶菌酶水平均高于模型组(均P<0.05),但两组间差异均无统计学意义(均P>0.05)。见表4。

表4 不同时间点4组大鼠血清溶菌酶水平比较(x±s,ng/mL)
2.5 各组大鼠创面组织病理变化 假手术组干预后3 d创面组织轻度水肿,痂下肉芽组织开始生成;干预后6 d创面组织水肿逐渐减轻,创面可见大量新生毛细血管,大量成纤维细胞整齐排列于创面;干预后12 d创面组织大部分已被鳞状上皮覆盖,痂下肉芽组织已成熟。模型组干预后3 d、6 d创面组织明显水肿和出血,并化脓结痂,创面炎性反应较重,直到干预后12 d创面组织水肿和出血逐渐消失,但仍有白细胞渗出和淋巴细胞浸润。贝复济组干预后3 d创面炎性反应、组织水肿和出血明显,痂下肉芽组织生长快于模型组;干预后6 d创面组织水肿和出血现象开始消失,成纤维细胞增多,新生毛细血管变多;干预后12 d创面组织一半已被鳞状上皮覆盖,痂下肉芽组织开始成熟。拔毒生肌膏组大鼠早期组织病理变化与贝复济组相似,干预后3 d、6 d痂下肉芽组织生长较快,干预后6 d创面组织水肿和出血消失,成纤维细胞、新生毛细血管均增加;干预后12 d痂下可见逐渐成熟的肉芽组织,鳞状上皮已覆盖一半的创面组织。见图1。

图1 各组大鼠不同时相创面组织形态变化
3 讨 论
糖尿病足溃疡是糖尿病最严重且影响较大的并发症之一[7]。有研究显示,近3年来全球约有4.51亿人罹患糖尿病,其中糖尿病足溃疡患者约占15%[8]。糖尿病足溃疡截肢率不断上升,给患者自身的身心健康、生活、工作及家庭均带来极大的影响[9]。随着时代的发展进步,大多数人越来越追求肢体及躯体的完美性,而中医药外敷在糖尿病足溃疡治疗中具有简、便、廉、验的优势[10],有研究表明生肌玉红膏、湿润烧伤膏应用于糖尿病溃疡效果显著[3,11-12],这让多数患者克服了长期内服用药及肢体缺失的恐惧感,为中药外敷辨证治疗慢性难愈性创面奠定了一定的基础。壮药拔毒生肌膏具有拔毒生肌、去瘀生新的功效,通过液化坏死组织,促进上皮爬行及新生肉芽组织生长[13],给糖尿病足溃疡等慢性难愈性创面患者带来福音。
本研究结果显示假手术组创面(非高糖状态)愈合快速,而模型组干预后3 d及12 d的创面愈合率均低于假手术组,表明大鼠在高糖状态下创面愈合缓慢,提示糖尿病是抑制创面愈合的重要因素。贝复济在临床上常用于治疗压疮、烧伤等创面,能加快上皮细胞爬行,促进创面愈合效果显著[14-15],故本研究将其作为对照组药物。本研究中拔毒生肌膏组、贝复济组的糖尿病模型大鼠创面组织水肿和出血较早消失,肉芽组织较快生长,在干预后12 d两组大鼠创面痂下肉芽组织已开始成熟,创面组织超过半数被鳞状上皮覆盖,而模型组创面组织仍有白细胞渗出和淋巴细胞浸润,创面水肿和出血慢慢消失;同时,与模型组比较,贝复济组干预后3 d及6 d的创面愈合率均升高,拔毒生肌膏组干预后6 d及12 d的创面愈合率均升高(均P<0.05)。这提示拔毒生肌膏和贝复济能够加速糖尿病合并创面愈合,均是治疗糖尿病合并创面愈合的有效药物。但拔毒生肌膏组各时间点的创面率与假手术组比较差异均无统计学意义(P>0.05),而贝复济组干预后12 d的创面愈合率低于假手术组和拔毒生肌膏组(均P<0.05),即拔毒生肌膏在后期促进创面愈合速度加快,提示拔毒生肌膏的作用优于贝复济。
创面修复由止血期、炎症反应期、增殖性修复期和伤口重塑4个过程组成。愈合过程中EGF是促进创面愈合的生长因子[15],其主要在创面愈合中后期促进创面再上皮化,同时在炎症阶段也能促进各种细胞的增殖迁移[16];此外,VEGF亦是较为重要的促进创面愈合的生长因子[18-21],其只作用于血管内皮细胞,促进血管生成。溶菌酶具有杀菌抗炎作用,能够促进组织修复及提高免疫力[22],其表达上调有利于创面愈合[23]。有研究显示,给予溶菌酶-抗菌肽融合蛋白作用于糖尿病创面,利于创面修复及肉芽组织中的血管生成,降低促炎因子的水平[24]。本研究中,干预后6 d、12 d贝复济组、拔毒生肌膏组血清及组织EGF、VEGF水平均高于模型组;各个时间点贝复济组与拔毒生肌膏组的血清溶菌酶水平均高于模型组(均P<0.05)。这提示贝复济及拔毒生肌膏均能上调糖尿病大鼠血清及创面组织EGF、VEGF的表达,以及血清溶菌酶水平,从而加快创面愈合。
本研究中,拔毒生肌膏在创面愈合后期的作用优于贝复济,然而除干预后6 d拔毒生肌膏组的血清EGF水平低于贝复济组外,贝复济组、拔毒生肌膏组其余时间点血清EGF水平,以及各个时间点组织EGF和VEGF、血清溶菌酶水平均无明显差异(P>0.05),这表明贝复济、拔毒生肌膏促进EGF、VEGF表达的能力相当。贝复济本质是成纤维细胞因子,作用靶点明确;而拔毒生肌膏的分子作用机制不明,其可能通过多靶点,多信号通路调控创面愈合,其作用机制有待进一步探索及研究。
综上所述,壮药拔毒生肌膏通过调控血清和组织EGF、VEGF及血清溶菌酶表达,改善糖尿病大鼠创面肉芽水肿,加快创面组织上皮爬行,进而促进创面愈合,且其在后期促进创面愈合的作用优于贝复济,这为临床中药外用于糖尿病创面提供有用的实验数据。目前,对于壮药拔毒生肌膏分子生物学的研究仍较少,仅局限于临床观察,其促进创面愈合的相关通路及多靶点的研究有待进一步明确。
