异牡荆苷作为sortase A抑制剂对小鼠金黄色葡萄球菌肺炎的保护作用
2020-07-21田莉莉王铁东王大成
田莉莉,母 丹,王 莉,王铁东,王大成,高 丰,王 琳*
(1.吉林大学 动物医学学院 人兽共患病研究教育部重点实验室,吉林 长春 130062;2.吉林大学 动物科学学院,吉林 长春 130062)
金黄色葡萄球菌(Staphylococcusaureus,S.aureus)是一种重要的人畜共患和机会性病原体,可引起多种疾病,如症状轻微的皮肤感染或心内膜炎、菌血症、败血症、骨髓炎、血液感染和肺炎等严重感染[1]。由于高毒力及多药耐药性金黄色葡萄球菌,尤其是耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)的出现和广泛传播,导致了很高的致病率和死亡率,严重危害公共健康,引起了极大关注[2]。金黄色葡萄球菌通过分泌大量的毒力因子而引发感染,这些因子包括表面相关黏附素和分泌的蛋白毒素[3]。表面相关黏附素能与宿主组织和细胞蛋白质相互作用,促进细菌黏附到细胞外基质成分或侵入到细胞内[4-5]。分泌的蛋白毒素和酶能破坏宿主细胞和组织或帮助细菌逃避宿主免疫系统的清除,促进细菌在宿主体内的传播[6]。利用小分子抑制剂靶向金黄色葡萄球菌的毒力因子是一种很有前途的抗感染策略,它在不给细菌施加选择性压力的情况下减弱细菌的毒力,从而降低耐药性产生的风险[7-8]。据报道,ClfA/ClfB、纤维蛋白结合蛋白(FnBPs)和胶原黏附素(CAN)等表面相关黏附素都是导致金黄色葡萄球菌引发感染的重要蛋白,这些细胞表面蛋白均通过sortase A(SrtA)被共价锚定在细菌表面[9-11]。
SrtA是一种被广泛研究的膜定位转肽酶,它通过介导多种黏附蛋白在细菌表面的分布在金黄色葡萄球菌的发病机制中起着关键作用[12]。研究表明,SrtA基因突变能够显著减少细菌表面蛋白的锚定[13],并且抑制SrtA能显著降低金黄色葡萄球菌的毒力,从而改善肺炎、脓毒症和感染性心内膜炎的预后[14-17]。因此,SrtA成为开发新型抗感染药物的理想靶标。
目前报道的SrtA抑制剂主要有植物天然产物、小分子化合物和拟肽化合物等,均对金黄色葡萄球菌感染具有较好的治疗作用[18-19]。异牡荆苷(apigenin-6-C-glucoside)是一种天然的黄酮类化合物,广泛存在于各种食用或药用植物中,如葫芦科的果实或木豆、小麦、三角果和竹子的叶子中[20]。它具有多种药理活性,包括抗氧化、抗炎、抗阿尔茨海默病和抗癌作用[21-24]。课题组先前的研究表明,异牡荆苷在体外对金黄色葡萄球菌没有抗菌作用,但能够通过抑制SrtA的活性抑制生物膜的形成和SpA在细胞壁上的锚定[25]。尽管我们已证实异牡荆苷是一种有效的SrtA抑制剂,但作用机制和其对金黄色葡萄球菌感染的治疗效果尚不清楚。在本研究中,我们通过分子对接和分子动力学模拟确证了异牡荆苷与金黄色葡萄球菌SrtA的相互作用模式和结合位点,并进一步通过肺炎模型评价了其对小鼠金黄色葡萄球菌感染性肺炎的治疗作用。本研究的结果表明,异牡荆苷或可作为开发治疗金黄色葡萄球菌感染药物的先导化合物。
1 材料与方法
1.1 菌株、质粒及试剂MRSA菌株USA300购自美国模式培养物集存库(ATCC,Manassas,VA);USA300ΔSrtA菌株由本实验室构建保存;用于蛋白表达载体的大肠杆菌BL21(DE3)由本实验室保存;pET28a-SrtA质粒由本实验室保存;脑心浸液培养基(brian heart infusion;BHI),LB培养基购自青岛海博有限公司;胎牛血清购自上海吉泰依科赛生物科技有限公司;异牡荆苷购自四川普菲德生物有限公司;兔抗SrtA多克隆抗血清由本实验室保存;溶菌酶购自北京索莱宝生物公司;异丙基硫-D-半乳糖苷(IPTG)购自上海生工生物有限公司;辣根过氧化物酶(HRP)标记的羊抗兔IgG购自碧云天生物公司;His标签融合蛋白纯化层析柱购自GE公司;SrtA底物肽Abz-LPATG-Dap(Dnp)-NH2由上海吉尔生化有限公司合成;其他常规试剂均为国产分析纯。
1.2 SrtA蛋白的纯化采用热激法将pET28a-SrtA质粒转化至大肠杆菌表达菌株BL21(DE3)中,经卡那霉素抗性筛选,挑取单个阳性菌落,鉴定正确后以1∶100接种到 LB液体培养基中,37℃培养至D600为0.6~1.0时,加入终浓度为0.5 mmol/L的异丙基硫-D-半乳糖苷(IPTG)在16℃培养过夜,以诱导重组蛋白的表达。采用Ni-NTA亲和层析技术对带有 His 标签的SrtA蛋白进行纯化,以10 mmol/L 咪唑缓冲液洗脱杂蛋白,300 mmol/L咪唑缓冲液洗脱目的蛋白,收集目的蛋白,备用[25-26]。
1.3 SrtA活性测定通过荧光共振能量转移法(FRET)考察SrtA活性[27-28]。在300 μL反应体系中加入10 μmol/L纯化的SrtA蛋白和不同浓度异牡荆苷于黑色96孔平板中,37℃下避光孵育30 min,然后加入终浓度为50 μmol/L的SrtA底物肽Abz-LPATG-Dap(Dnp)-NH2,只加入缓冲液和底物肽作为对照组,室温下孵育1 h后,测定在350 nm激发波长,496 nm发射波长下的荧光强度。
1.4 SrtA可逆抑制试验将100 μL纯化的SrtA蛋白(10 μmol/L)与200 μmol/L的异牡荆苷(10 × IC50)混合,37℃恒温孵育1 h后,添加9.9 mL反应缓冲液将混合物稀释至100倍。然后在黑色96孔板中加入190 μL稀释液及10 μL SrtA底物肽Abz-LPATG-Dap(Dnp)-NH2(终浓度为10 μmol/L),使用酶标仪测定在350 nm激发波长、495 nm发射波长下的荧光强度[29]。
1.5 Western blot分析将金黄色葡萄球菌USA300与不同质量浓度异牡荆苷(0,32,64,128,256 mg/L)在BHI培养基中混合培养至D600为0.8,用PBS洗涤2次后,离心(500 r/min,4℃,1 min)收集菌体,加入10 g/L溶菌酶和40 g/L溶葡球菌酶的裂解缓冲液(10 mmol/L Tris-HCl,1 mmol/L EDTA和250 mmol/L蔗糖,pH 7.4)在37℃孵育1 h裂解细菌。采用12% SDS-PAGE凝胶分离等量的细菌蛋白(20 μg),然后电转至PVDF膜上。用5%脱脂奶粉封闭1 h后,用TBST洗涤3次,加入兔抗SrtA多克隆抗血清(1∶500)孵育2 h,洗涤后加入辣根过氧化物酶(HRP)标记羊抗兔IgG室温孵育1 h,洗涤后加入ECL底物显色液观察条带。
1.6 细胞侵袭试验金黄色葡萄球菌侵袭人肺腺癌A549细胞试验参考之前的文献报道[30-31]。将A549细胞(3×105细胞/孔)接种于24孔培养板中过夜培养(37℃,5% CO2),将过夜培养的金黄色葡萄球菌USA300和ΔSrtA按照1∶100比例接种至含终质量浓度为64,128,256 mg/L的异牡荆苷的培养基中, 0.5% 二甲基亚砜(DMSO)作为空白对照组,在37℃,220 r/min振荡培养至D600为1.0,以不含异牡荆苷的BHI肉汤培养的ΔSrtA菌株为阳性对照。按照1∶100接种金黄色葡萄球菌后,在37℃,5% CO2培养箱中培养2 h。每个孔用PBS冲洗3次,再加入1 mL含有300 mg/L庆大霉素的DMEM /高葡萄糖培养基,在37℃,5% CO2培养箱中孵育1 h。用新鲜培养基将培养板洗涤3次,用无菌蒸馏水裂解细胞,分3份分别涂在BHI琼脂平板上,计数CFU并按照CHEUNG等[32]描述的方法处理数据。
1.7 分子对接与分子动力学模拟为了研究异牡荆苷与SrtA的结合机制,从蛋白质数据库下载金黄色葡萄球菌SrtA的三维结构(Protein Data Bank[PDB]ID:1T2P)。使用Autodock vina 1.1.2进行分子对接以研究异牡荆苷和SrtA之间的结合模式[33]。利用Amber14软件包中的分子动力学模拟程序,对从分子对接中获得的异牡荆苷-SrtA复合物的最佳对接姿势(构象)进行了25 ns的分子动力学模拟,并计算结合自由能[34-37]。
1.8 金黄色葡萄球菌肺炎小鼠模型的建立金黄色葡萄球菌USA300在37℃ 过夜培养,按1∶100稀释至200 mL新鲜无菌BHI培养基中,振荡培养至D600=1.0。然后离心收集培养液,PBS洗涤菌体3次,重悬于100 μL PBS中。7周龄C57BL/6J小鼠用异氟醚麻醉,滴鼻接种30 μL(2×109CFU)金黄色葡萄球菌悬液[38]。感染1 h后皮下给予100 mg/kg的异牡荆苷,此后每隔12 h给小鼠注射1次异牡荆苷。对照组小鼠皮下注射相同体积的含0.5% DMSO的无菌PBS。统计12,24,36,48,60,72,84,96 h小鼠的死亡情况,计算生存率。
肺组织细菌计数和组织病理学分析,将15只C57BL/6J 小鼠随机分为3组,每组5只,分别为金黄色葡萄球菌USA300感染组(mock)、异牡荆苷治疗组(isovitetin)和突变组(ΔSrtA)。用30 μL(1×109CFU)的金黄色葡萄球菌悬液滴鼻感染小鼠,2 h后给药,给药量和给药方式同生存率实验相同。感染后24 h颈椎脱臼处死,然后用无菌技术取出左肺,一半用于菌落计数,另一半置于1%福尔马林中固定,HE染色后光镜下观察肺组织切片,采集图像。
1.9 统计学分析研究中的试验数据采用GraphPadPrism5.0进行分析,所有计量数据以平均值±标准差表示,以P值<0.05为差异有统计学意义,*表示P<0.05,**表示P<0.01,***表示P<0.001。
2 结果
2.1 异牡荆苷可逆抑制金黄色葡萄球菌SrtA活性采用FRET法研究异牡荆苷对SrtA活性的抑制作用,结果如图1A所示,异牡荆苷以剂量依赖的方式抑制SrtA的活性, IC50值为(28.98±0.21) mg/L。为了进一步确定异牡荆苷对SrtA的抑制是否可逆,将10倍IC50浓度的异牡荆苷与与单独的缓冲液(对照)或SrtA孵育并稀释,然后通过SrtA底物肽Abz-LPATG-Dap(Dnp)-NH2裂解测量SrtA活性,其中对照样品的活性为100%。结果显示,与对照组相比,SrtA的活性恢复至(83±2.31)%(图1B),表明异牡荆苷对SrtA的抑制是可逆的,通过非共价作用结合于分选酶的活性位点。
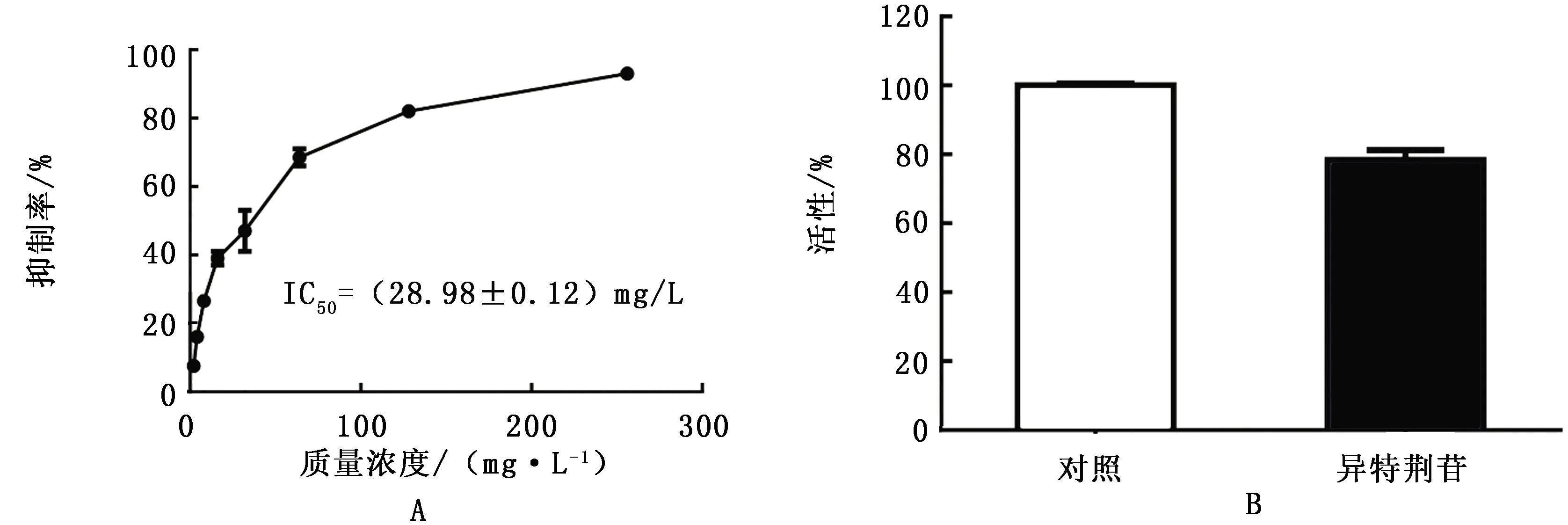
图1 异牡荆苷对SrtA的抑制作用 A.异牡荆苷对金黄色葡萄球菌USA300 SrtA的体外活性抑制作用;B.异牡荆苷对SrtA的可逆抑制作用
2.2 异牡荆苷不抑制SrtA的表达为确定异牡荆苷是否抑制SrtA的表达,用不同质量浓度的异牡荆苷(0,32,64,128,256 mg/L)分别处理金黄色葡萄球菌,提取总蛋白,Western blot分析SrtA的表达水平。结果如图2所示,异牡荆苷处理组的条带与未处理组的条带一致,表明异牡荆苷不影响SrtA的表达。

图2 SrtA蛋白的Western blot分析
2.3 异牡荆苷抑制金黄色葡萄球菌侵袭A549细胞金黄色葡萄球菌感染的主要部位通常是上皮细胞,在细胞表面定植或通过SrtA介导的细胞表面蛋白侵入细胞,导致急性和慢性感染。我们利用上皮细胞系A549确定异牡荆苷是否能抑制金黄色葡萄球菌侵袭上皮细胞。结果如图3所示,与PBS处理的对照组相比,256 mg/L异牡荆苷处理组细胞内金黄色葡萄球菌的数量显著减少。这一结果表明,异牡荆苷通过抑制SrtA的活性减弱了金黄色葡萄球菌USA300对A549细胞的侵袭。

图3 异牡荆苷减弱金黄色葡萄球菌USA300对A549细胞的侵袭 与对照组相比,*示P<0.05,**示P<0.01,***示P<0.001。下同
2.4 异牡荆苷与SrtA的结合机制为了探索异牡荆苷和SrtA之间的潜在结合模式,使用AutoDock vina 1.1.2和Amber14软件包进行分子对接和分子动力学模拟。为了确定对接模型的动态稳定性和方法的合理性,计算了基于模拟时间的起始结构的蛋白质骨架的均方根偏差(RMSD)值。结果表明,系统的蛋白质结构在模拟过程中达到了稳定状态(图4A),氢键、静电和范德华相互作用是异牡荆苷与SrtA相互作用的主要作用力。具体而言,残基Ala-92靠近异牡荆苷的葡萄糖基,在SrtA和异牡荆苷之间形成氢键相互作用(键长:1.9Å)(图4C)。用AmberTools 15中MM-GBSA方法计算了异牡荆苷结合位点周围的残基对结合自由能的总贡献,在SrtA-异牡荆苷复合物中,残基Ala-92有较强的静电作用力贡献(ΔEele),其ΔEele小于-14.6 kJ/mol(图4B)。此外,残基Arg-197靠近异牡荆苷的黄酮支架,形成阳离子-π相互作用,表现出中等的ΔEele贡献,ΔEele<-10.5 kJ/mol(图4B)。此外,Ala-104、Ile-182、Trp-194和Ile-199的侧链ΔEele<-4.2 kJ/mol,由于这些残基与异牡荆苷接近,与异牡荆苷形成强烈的范德华相互作用。总的来说,大部分分解能相互作用源于范德华相互作用,主要通过疏水作用,如Ala-92、Ala-104、Ala-118、Val-166、Ile-182、Val-193、Trp-194和Ile-199。此外,通过计算SrtA-异牡荆苷复合物的总结合自由能,发现异牡荆苷的ΔGbind约为-65.7 kJ/mol,表明异牡荆苷能与SrtA强结合。

图4 异牡荆苷与SrtA相互作用的分子模拟 A.SrtA-异牡荆苷复合物的所有原子相对于其初始结构随时间变化的均方根偏差(RMSD); B.在SrtA-异牡荆苷复合物中基于每个残基分解结合能; C.SrtA蛋白与异牡荆苷结合关键氨基酸残基
2.5 异牡荆苷对小鼠金黄色葡萄球菌肺炎的保护作用由于异牡荆苷能抑制SrtA的活性和金黄色葡萄球菌对A549上皮细胞的侵袭,为进一步确定异牡荆苷否具有体内保护作用,我们建立了小鼠金黄色葡萄球菌肺炎感染模型,以7周龄C57BL/6J小鼠为实验对象,通过滴鼻接种致死剂量的金黄色葡萄球菌USA300,治疗组每12 h注射一次异牡荆苷,每隔12 h计算感染小鼠的死亡率至96 h。结果如图5 A所示,异牡荆苷治疗组24,48,72 h的死亡率明显低于对照组(P值分别为0.005,0.032,0.025),说明异牡荆苷能够显著降低小鼠死亡率。
小鼠感染金黄色葡萄球菌24 h后,将采集的肺部组织研磨涂板,统计菌落数。结果如图5 B所示,感染金黄色葡萄球菌的小鼠肺部菌落数为(6.21±0.178) lg CFU/g,经异牡荆苷治疗后,与对照组相比肺部菌落数显著降低,仅为(4.7±0.169) lg CFU/g,表明异牡荆苷对金黄色葡萄球菌感染引起的小鼠肺炎具有一定的治疗效果。
为了评估异牡荆苷对小鼠肺炎的保护作用,首先对肺组织外观进行检查,结果显示异牡荆苷治疗组小鼠肺组织呈粉红色和海绵状,局灶性感染较少,而感染对照组小鼠肺组织表面呈红色和斑驳状,有许多局灶性感染(图5 C)。病理组织学分析显示,模型组小鼠肺泡腔大部分被炎性细胞浸润,而用异牡荆苷治疗组炎症显著减轻,如肺泡腔中炎性细胞积聚较少。综上所述,异牡荆苷可以减弱金黄色葡萄球菌的体内毒力,对金黄色葡萄球菌引起的小鼠肺炎具有较好的保护作用。
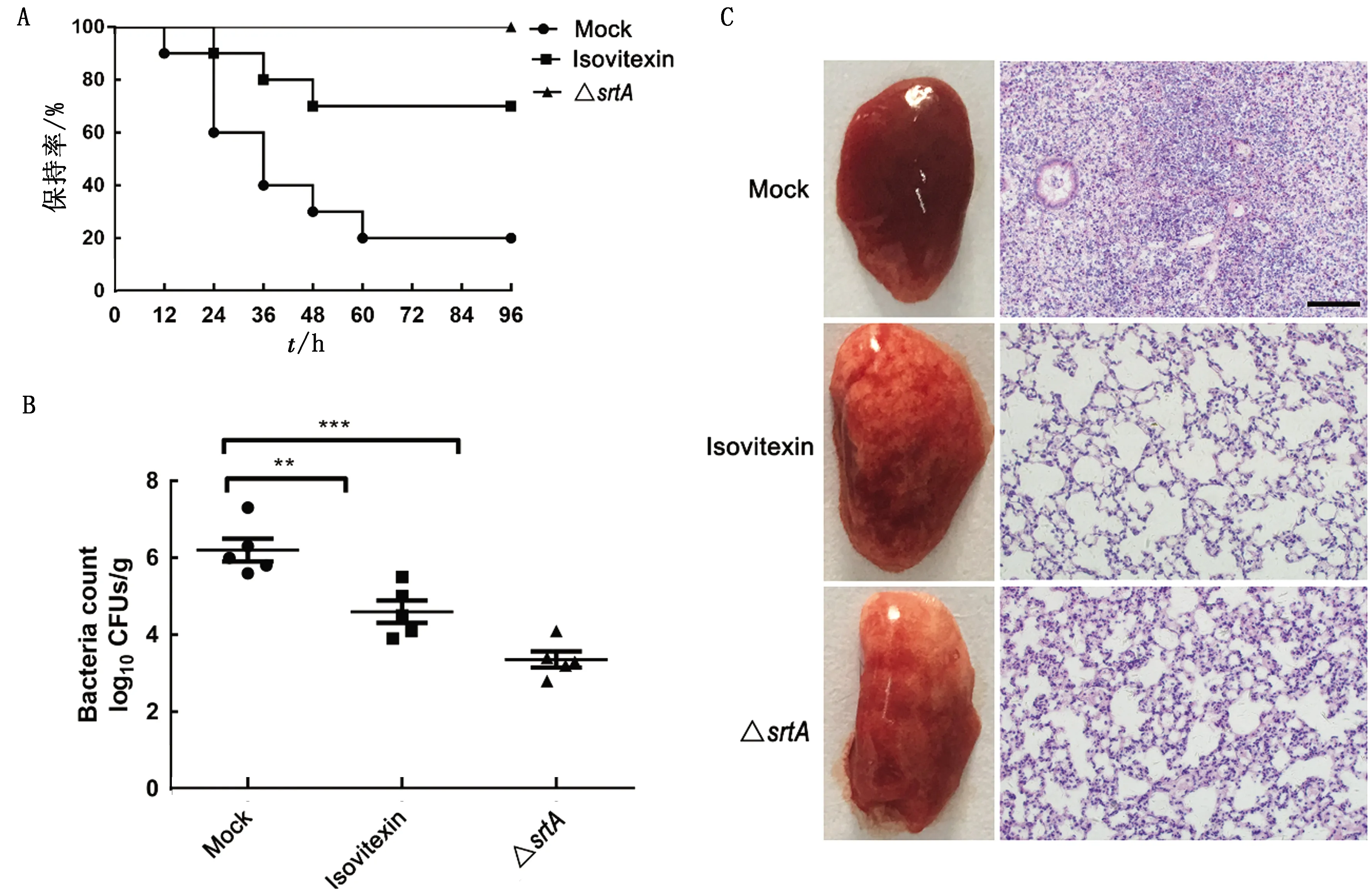
图5 异牡荆苷对金黄色葡萄球菌诱导的小鼠肺炎的治疗作用 A.异牡荆苷对金黄色葡萄球菌USA300肺炎小鼠的保护率;B.异牡荆苷对金黄色葡萄球菌USA300感染小鼠肺组织载菌量影响;C.异牡荆苷对金黄色葡萄球菌USA300肺炎小鼠肺组织的保护作用
3 讨论
金黄色葡萄球菌是医院和社区获得性肺炎的主要致病菌之一,迫切需要开发新型高效的抗感染药物来控制多重耐药金黄色葡萄球菌引起的感染。
SrtA是金黄色葡萄球菌的一个重要毒力因子,在表面蛋白锚定到细胞壁的过程中发挥关键性的作用[39],这些表面蛋白能够介导细菌定植到宿主组织和细胞、形成生物膜和逃避免疫反应等。因此,靶向SrtA并阻断表面蛋白的锚定是治疗金黄色葡萄球菌感染的一种有效途径。SrtA突变株在小鼠肺炎模型中表现出弱毒力,表明SrtA在葡萄球菌肺炎的发病机制中起着重要的作用[40]。因此,我们可以通过干扰SrtA的活性来抑制表面蛋白的锚定,进而治疗金黄色葡萄球菌引起的肺部感染。本研究证实异牡荆苷能显著降低金黄色葡萄球菌对A549细胞的侵袭作用。通过分子对接及分子动力学模拟的方法进一步确证了异牡荆苷与SrtA的相互作用位点,阐明了异牡荆苷抑制SrtA的作用机制。结果表明,异牡荆苷与SrtA的结合主要依赖于氢键、静电及范德华力相互作用,相互作用的残基主要有Ala-92、Ala-104、Ala-118、Val-166、Ile-182、Val-193、Trp-194和Ile-199。此外,异牡荆苷治疗显著提高了MRSA致死剂量感染小鼠的存活率,降低了肺组织中的存活细菌数,改善了肺组织的病理损伤,减轻了肺部炎症。这些治疗作用可能是由于SrtA的抑制导致细菌对上皮细胞的黏附和侵袭减少,表明异牡荆苷是治疗金黄色葡萄球菌肺炎优秀的候选化合物。据报道,活性残基Arg197、H120和C184都是SrtA发挥底物催化作用的关键位点[41],因此,异牡荆苷可能是通过阻碍酶与底物结合发挥抑制StrA活性的作用。
据报道,在医院肺炎感染中,MRSA的出现率不断增加,这使得该病难以治愈[42]。尽管该疾病可以用万古霉素(首选药物)治疗,但死亡率仍然很高,并且出现中度耐药性[43]。在新生小鼠的肺炎模型中,SpA被证明是起关键作用的毒力因子[44]。此外,ZIMMERLI等[45]的研究证明葡萄球菌嵌入细胞外基质的能力在慢性和持续性感染(如肺炎,心内膜炎和异物相关感染)中起着重要作用,而金黄色葡萄球菌侵入宿主细胞之前首先要黏附在细胞表面,这些与黏附相关的蛋白以及SpA都是通过SrtA锚定到细胞壁发挥作用的,因此可以推断SrtA是金黄色葡萄球菌感染引起的肺炎中的重要毒力因子。本研究表明,异牡荆苷治疗显著提高了金黄色葡萄球菌肺炎小鼠的存活率,降低了肺组织中的存活细菌数,改善了肺组织的病理损伤,减轻了肺部炎症。这些治疗作用可能是由于药物对SrtA的抑制导致细菌对上皮细胞的黏附和侵袭减少,进一步从体内证明异牡荆苷是治疗金黄色葡萄球菌肺炎优秀的候选化合物。
综上所述,本研究表明异牡荆苷是SrtA的可逆性抑制剂,在体内可以减弱MRSA的毒力,对金黄色葡萄球菌引起的肺炎具有较好的保护作用。因此,异牡荆苷是一种潜在的先导化合物,可作为治疗MRSA感染的抗毒性药物进一步开发。
