基因工程表达鸡IFN-λ抗Ⅰ群禽腺病毒感染
2020-07-21许鑫燕王延龙吴艳涛张小荣
许鑫燕,王延龙,杨 倩,吴艳涛,2,张小荣,2*
(1.扬州大学 兽医学院,江苏 扬州 225009;2.江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
近年来,由Ⅰ群禽腺病毒感染引起的心包积水-肝炎综合征(hydropericardium hepatitis syndrome,HHS)和包涵体肝炎(inclusion body hepatitis,IBH)在我国的发病率呈上升趋势,给养鸡业造成很大的经济损失。其中HHS主要由FAdV-4引起,而IBH则主要由FAdV-8b引起[1]。Ⅲ型干扰素(IFN)又称为IFN-λ,是2003年发现的一种新型IFN家族,具有与Ⅰ,Ⅱ型IFN类似的抗病毒特性,但利用不同的配体-受体系统,主要在一些上皮细胞及免疫细胞上发挥作用[2]。本研究旨在评价应用昆虫杆状病毒表达系统制备的基因工程chIFN-λ对Ⅰ群禽腺病毒的感染抗病毒效果,以期为禽Ⅰ群腺病毒感染的防控开辟新的途径。
1 材料与方法
1.1 病毒及细胞表达chIFN-λ的重组杆状病毒AcMNPV-chIFN-λ[3]、FAdV-4 GX2013株、FAdV-8b QD2016株[4]、水泡性口炎病毒、Sf9草地贪夜蛾卵巢细胞均由扬州大学农业部畜禽传染病学重点开放实验室保存。
1.2 主要试剂Sf900 Ⅱ SFM培养基和DMEM培养基购自Thermo Fisher Scientific公司;Lonsera特级胎牛血清购自上海双洳生物科技有限公司;其他各类分析纯试剂均购自国药集团化学试剂有限公司。
1.3 细胞和实验动物鸡肝癌细胞系LMH购自ATCC(CRL-2118);SPF鸡购自济南斯派福瑞禽业科技有限公司。
1.4 chIFN-λ在昆虫细胞中的表达与纯化将液氮冻存的Sf9昆虫细胞进行复苏,用Sf-900TMⅡ SFM培养液进行培养和扩繁。将扩繁到足够数量的细胞用含1% FCS的Sf-900TMII SFM培养液重悬至2×106细胞/mL的浓度,接种到细胞培养瓶中,在27℃培养箱放置1 h待细胞完全贴壁后,按照MOI = 1的比例接种重组杆状病毒AcMNPV-chIFN-λ,27℃继续培养。72 h后,首先收获细胞培养上清液,然后向培养瓶中加入培养上清液1/10体积的PBS(pH7.4),收获细胞,超声波裂解细胞,5 000 r/min离心10 min,收集上清液,并将之前收集到的上清液合并,所得即为重组chIFN-λ表达产物,小量分装后―70℃保存备用。
1.5 重组chIFN-λ抗病毒效价测定利用LMH/VSV微量病变抑制法检测制备的重组chIFN-λ的抗病毒效价[3]。具体方法为:在96孔细胞培养板中接种LMH细胞至90%汇合度,将重组chIFN-λ表达产物以10倍梯度稀释,100 μL/孔加入96孔板中致敏LMH细胞,每个稀释度做5个重复,37℃、5% CO2培养箱培养12 h,弃上清液,每孔加入100 TCID50/100 μL VSV病毒液,24~48 h后观察细胞病变。将抑制50%细胞病变(CPE)出现孔的IFN最高稀释度定为1个IFN活性单位(U)。
1.6 重组chIFN-λ对禽Ⅰ群腺病毒的抗病毒作用评价
1.6.1体外抗病毒作用评价 在96孔细胞培养板中接种LMH细胞至90%汇合度,将重组chIFN-λ表达产物以10倍梯度稀释,100 μL/孔加入96孔板中致敏LMH细胞,每个稀释度做8个重复,37℃、5% CO2培养箱培养12 h,弃上清液,每孔加入100 TCID50/100 μL的FAdV-4 GX2013株或FAdV-8b QD-2016株病毒液,24~48 h后观察细胞病变。将抑制50% CPE出现孔的IFN最高稀释度定为1个IFN活性单位(U)。
1.6.2体内抗病毒作用评价 对FAdV-4的体内抗病毒试验:15只1月龄SPF鸡平均分为3组,每组5只。第1组为攻毒治疗组,首先按照2×106/只的剂量在左侧胸部肌肉注射重组chIFN-λ,6 h后在右侧胸部肌肉注射FAdV-4 GX2013株(105.5TCID50/mL,0.2 mL/只),以后每日用同样剂量的重组chIFN-λ进行胸部肌肉注射;第2组相同的方式进行攻毒,但不注射重组chIFN-λ进行治疗;第3组为健康对照组,不做任何处理。每日观察和记录各组试验鸡的发病和死亡情况,于攻毒后5 d扑杀所有未死亡鸡。对FAdV-8b的体内抗病毒试验:试验分组同上,攻毒毒株为FAdV-8b QD2016株(105.5TCID50/mL,0.2 mL/只)。每日观察和记录各组试验鸡的发病和死亡情况,于攻毒后5 d扑杀所有未死亡鸡,同时采集试验鸡的咽喉拭子和泄殖腔拭子,处理后提取DNA,应用SYBR Green I实时荧光定量PCR的方法测定病毒含量,对试验鸡的排毒情况进行监测。
2 结果
2.1 重组chIFN-λ表达产物的效价测定用重组杆状病毒AcMNPV-chIFN-λ感染Sf9细胞,72 h后分别收集细胞培养上清和细胞裂解上清,混合获得粗制重组chIFN-λ。通过VSV细胞病变抑制法测定,重组chIFN-λ表达产物在LMH细胞上的抗病毒效价为3.16×106U/mL。
2.2 重组chIFN-λ对禽Ⅰ群腺病毒的体外抗病毒作用通过细胞病变抑制法分别测定重组chIFN-λ对FAdV-4 GX2013株、FAdV-8b QD-2016株的抑制作用,结果显示,重组chIFN-λ在LMH细胞上的抑制效价分别为1.33 ×106,1.78 ×106U/mL。
2.3 重组chIFN-λ对禽Ⅰ群腺病毒的抗病毒作用
2.3.1对FAdV-4的体内抗病毒作用 健康对照组试验鸡在攻毒后5 d内未出现任何临床症状。攻毒对照组试验鸡在攻毒后3 d内全部死亡。重组chIFN-λ治疗组试验鸡攻毒后5 d存活率为60%,死亡鸡的死亡时间相对于攻毒对照组也有所推迟。各组攻毒后生存曲线见图1。
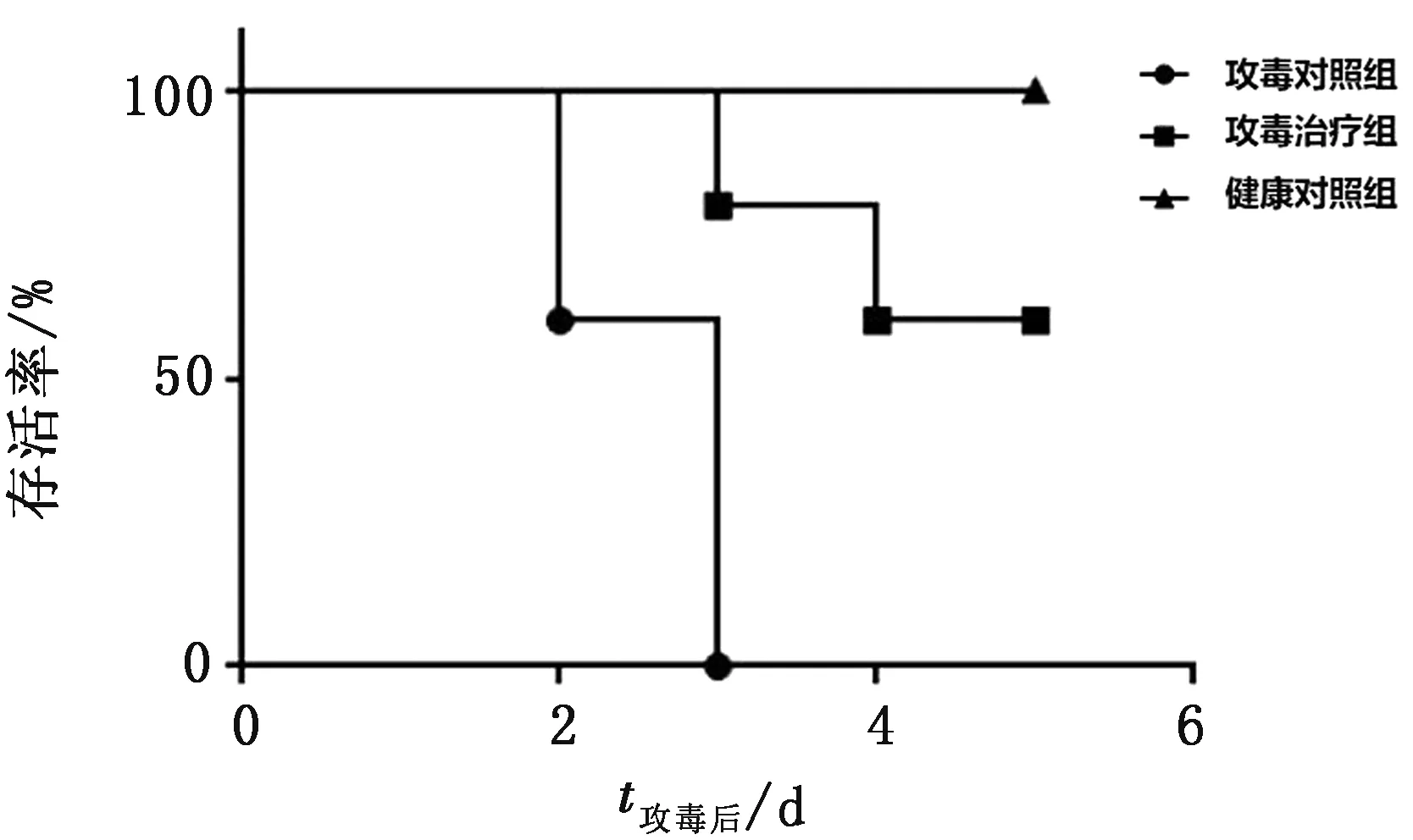
图1 FAdV-4攻毒后各试验组生存曲线图
2.3.2对FAdV-8b的体内抗病毒作用 FAdV-8b攻毒后各试验组均未出现明显临床症状和死亡。攻毒后5 d分别采集各组试验鸡只的咽喉拭子和泄殖腔拭子,实时荧光定量PCR方法进行排毒情况监测。结果显示与攻毒对照组相比,重组chIFN-λ治疗组试验鸡经呼吸道和消化道排毒的量均显著降低(图2),存在极显著差异(P<0.01)。
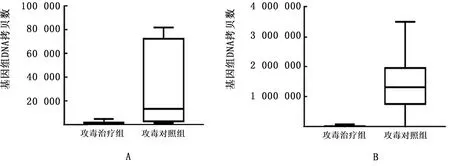
图2 FAdV-8b攻毒后第5天排毒检测结果 A.呼吸道排毒;B.消化道排毒
3 讨论
研究表明,chIFN-λ其具有抗病毒、抗肿瘤、抗寄生虫及促进免疫调节等作用。有实验证明,chIFN-λ可以有效诱导黏膜上皮内的肥大细胞、淋巴细胞等的分化增殖,增强非特异性免疫功能,对以上皮细胞为感染对象的病毒有较好的抗病毒效果[5-6]。
前期研究已经证明Ⅲ型IFN在人的肝炎治疗中发挥着一定作用[7-9]。禽Ⅰ群腺病毒感染途径主要是消化道和呼吸道,可引起感染鸡的肝脏发生特征性病变[10-14],因此推测chIFN-λ可能对禽Ⅰ群腺病毒感染也会有较好的抗病毒治疗效果。
从本研究的结果看,chIFN-λ确实对禽Ⅰ群腺病毒感染有显著的抑制作用。在研究中由于FAdV-4肌肉注射攻毒是致死的[15],所以以治疗后的存活率作为治疗效果的评价指标,因为攻毒对照组试验鸡在攻毒后3 d内全部死亡,所以未进行排毒检测;而FAdV-8b在人工感染试验中通常不引起死亡,甚至在实验室条件下也无法复制模拟出典型的临床表现,但感染鸡可通过呼吸道和消化道途径大量排毒[15],因此在本研究中以攻毒后5 d的排毒情况作为治疗效果的评价指标。
在本研究中,重组chIFN-λ的制备是利用表达chIFN-λ重组杆状病毒感染昆虫细胞培养后所收获的粗制产物,考虑到成本因素,并未进行进一步精制纯化,可能会对结果存在一定的影响,在下一步的研究中还需要进一步改进和优化。为进一步降低在大规模临床应用条件下的成本,进一步探索利用高密度发酵技术提高重组chIFN-λ的表达量也是下一步需要重点研究的课题之一。
