MSCT征象联合纹理分析在预测胸腺上皮性肿瘤WHO简化病理分型中的价值
2020-07-21
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海200032
胸腺上皮性肿瘤(thymic epithelial tumor,TET)起源于胸腺上皮细胞,是前上纵隔最常见的原发肿瘤,约占前纵隔肿瘤的50%[1]。TET的生物学及形态学表现多样、争议较大,现被临床广泛认可应用的是最新修订的2015年版世界卫生组织(World Health Organization,WHO)组织学分型[2]。该分型根据上皮细胞的形态及其与淋巴细胞的比例,将TET分为A、AB、B1、B2、B3 (胸腺瘤)及C(胸腺癌)6个亚型,各亚型肿瘤的侵袭性及恶性程度依次增加,是公认的判断TET预后的独立危险因素[3]。为方便临床应用,多数研究者根据该WHO分型及预后,将TET简化为低危组(A、AB、B1型)和高危组(B2、B3、C型)[4]。术前对WHO组织学分型以及恶性程度进行评估对于TET患者的临床治疗具有重要价值。
多层螺旋计算机断层扫描(multi-slice spiral computed tomography,MSCT)作为TET术前诊断及术后随访最常用的影像学方法,能清晰地显示肿瘤的大小、位置、形态、强化方式、与相邻结构关系及有无远处转移等征象,为临床提供重要信息,但在进一步鉴别其组织学亚型中价值有限[5]。CT纹理分析(CT texture analysis,CTTA)作为近年来兴起的图像后处理技术,通过定量提取图像像素分布规律及特征,能够全面、客观地反映肿瘤潜在的生物学特性[6-7]。已有研究[8-9]表明,基于CT以及正电子发射CT(positron emission tomography/CT,PET/CT)图像的纹理分析能够有效地鉴别不同病理组织分型的TET。本研究旨在探讨MSCT征象联合纹理分析在预测TET WHO简化病理分型中的价值。
1 资料和方法
1.1 临床资料
回顾并分析2011年1月—2018年6月复旦大学附属肿瘤医院收治的符合以下标准的患者的临床及影像学资料。纳入标准:①经手术后病理学检查证实为TET;② 免疫组织化学病理分型结果明确;③术前1个月内行胸部增强CT检查增强。排除标准:①术前接受过化疗、放疗等任何方式的治疗;② 图像质量不佳影响病灶分割。共120例患者纳入研究:男性66例,女性54例,年龄24~77岁,平均(54.14±11.04)岁。低危组61例,高危组59例。
1.2 设备和方法
采用德国Siemens公司Somatom Sensation 32或64层螺旋CT进行动态增强扫描,管电压120 kVp,管电流250~300 mA,层厚、层距为1.0 mm。患者取平卧位,检查前指导患者训练呼吸,吸气末开始扫描,扫描范围为胸廓入口至双侧后肋膈角水平。增强扫描采用对比剂碘海醇(300 mg I/mL),剂量1.5~2.0 mL/kg,注射速率2~3 mL/s。注射对比剂后25~40 s进行单期扫描。
1.3 CT征象评估
由2名分别具有3年和20年工作经验的放射诊断科医师共同阅片,观察者仅被告知肿瘤病理学类型为TET,不告知具体病理学分型,在CT增强图像(纵隔窗)上评估并记录肿块的大小(选取肿块最大横截面测定最长径及与其垂直的最短径)、位置(单侧或跨中线)、形态(规则或不规则)、边缘(光滑或毛糙)、密度(有无钙化、囊变坏死)、强化程度(与同层面胸大肌相比)、纵隔脂肪线(清晰、模糊或消失)、心包或胸腔积液(无或有)及转移(淋巴结或其他脏器,淋巴结转移标准为短径大于10 mm)等信息,意见不一致时通过讨论达成一致。
1.4 CT纹理特征提取
将CT图像以DICOM格式导入LIFEx软件(LIFEx 4.00)进行纹理分析。由上述2名医师选取肿瘤最大层面沿病灶轮廓勾画感兴趣区(region of interest,ROI),意见不同时通过讨论取得一致(图1)。ROI的选取尽量包括全部肿瘤,同时避开血管、钙化及气体。软件自动计算得到14种参数,包括8种反映灰度值分布的直方图特征:最小值、平均值、标准差、最大值、偏度、峰度、熵和能量;6种反映图像异质性的灰度共生矩阵特征:同质性、能量、反差、自相关、熵和异质性[10]。
1.5 TET组织学分型
由2名有经验的病理学医师根据2015年WHO TET组织学分型方案,对术后病理学标本进行分型:
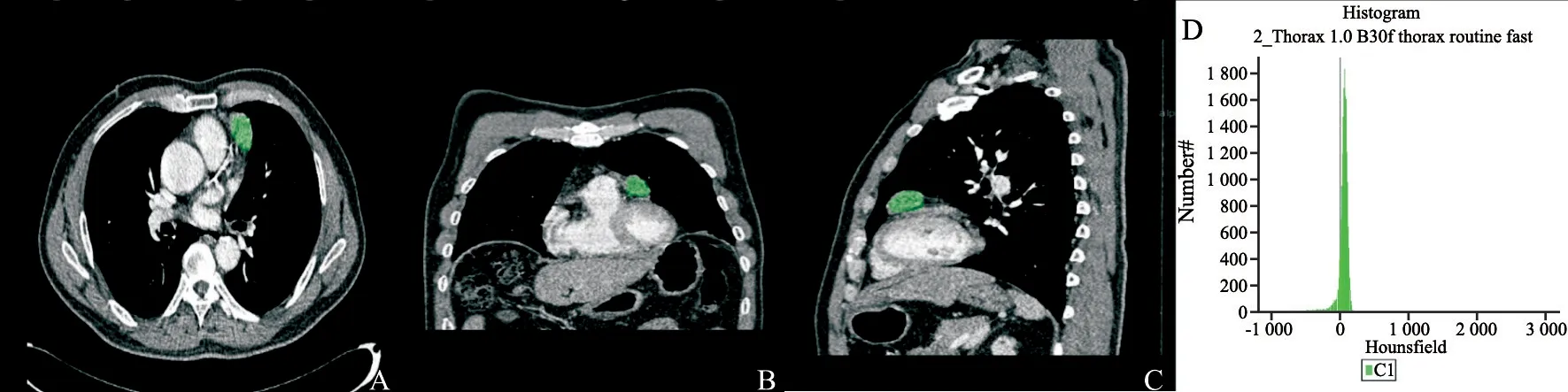
图1 55岁男性患者的肿块ROI提取示意图Fig.1 Chest enhanced CT images of a 55-year-old man with type B2 thymic epithelial tumor
①A型胸腺瘤包括非典型变异型:由肿瘤性胸腺上皮性细胞群组成,缺乏或少见不成熟性淋巴细胞。② AB型胸腺瘤(混合型):A型胸腺瘤不含或含有很少量的TDT阳性T淋巴细胞,如果>10%的范围出现中等量TDT阳性T淋巴细胞区域,或含有任意范围的大量TDT阳性T淋巴细胞区域。③B1型胸腺瘤:高密度的未成熟T 淋巴细胞及散在分布的肿瘤性上皮细胞,在低倍镜下甚至不易发现。④ B2型胸腺瘤:肿瘤性上皮细胞量多,散在分布于丰富的未成熟淋巴细胞中,血管周间隙常见。⑤ B3型胸腺瘤:由轻、中度异型的上皮细胞组成,混有少量非肿瘤性未成熟T淋巴细胞。⑥ C型胸腺瘤(胸腺癌):由于典型的分化、异型性大和器官样结构的缺失,使其完全不同于胸腺瘤而被单独区分开来。
1.6 统计学处理
使用R3.4.3和SPSS 23.0进行统计学分析。P<0.05为差异有统计学意义。对记录的计量资料进行正态性和方差齐性检验,符合正态分布的数据用表示,不符合正态分布的数据采用中位数及四分位数间距表示。采用独立样本t检验(正态分布)或Mann-WhitneyU检验(偏态分布)比较两组间计量资料的差异。分类资料采用频数及百分比表示,两组间分类资料的差异采用χ2检验。相关性分析采用斯皮尔曼相关分析,相关系数绝对值(|r|)>0.8表示高度相关。采用R软件套索(least absolute shrinkage and selection operator,Lasso)回归进行特征的降维、筛选,去除冗余的参数(|r|>0.8),以减少数据过度拟合的影响[11]。通过筛选的特征与对应权重系数进行线性组合得到患者的预测模型。采用受试者工作特征(receiver operating characteristic,ROC)曲线和曲线下面积(area under curve,AUC)评价模型在预测低危组和高危组TET的效能。不同预测模型之间诊断效能的比较采用DeLong检验。采用组内相关系数(intraclass correlation coefficient,ICC)评价评估者1和评估者2之间的一致性,ICC为0.81~1.00表示一致性好。
2 结果
2.1 临床与病理学诊断结果
本研究120例TET患者中低危组61例(A型5例,AB型47例,B1型9例),高危组59例(B2型27例,B3型16例,C型16例)。TET可发生于任何年龄,本研究中平均发病年龄为54岁,低危组TET的平均发病年龄高于高危组;低危组TET中女性占多数,高危组中男性明显多于女性。两组的年龄差异与性别差异有统计学意义(P<0.05,表1)。就诊时无明显症状65例,以胸痛、胸闷、胸部不适、咳嗽等呼吸系统症状为首发症状41例,临床表现为重症肌无力14例。低危组与高危组TET的首发临床症状差异无统计学意义(P>0.05)。
2.2 观察者间的一致性评价
评估者1和评估者2分别独立完成120例TET患者CT图像的ROI分割以及纹理特征的提取,结果得到数据1和数据2。对两组数据进行一致性评价,结果显示,14个参数的ICC均>0.80(P<0.001),表明一致性高。取两组数据的均值构成新的纹理数据,进行下一步的统计分析。
2.3 MSCT征象及纹理特征的相关性分析
对120例TET患者的11种CT征象及14种纹理参数进行相关性分析,显示不同协变量之间存在多重复杂的互相关(图2)。
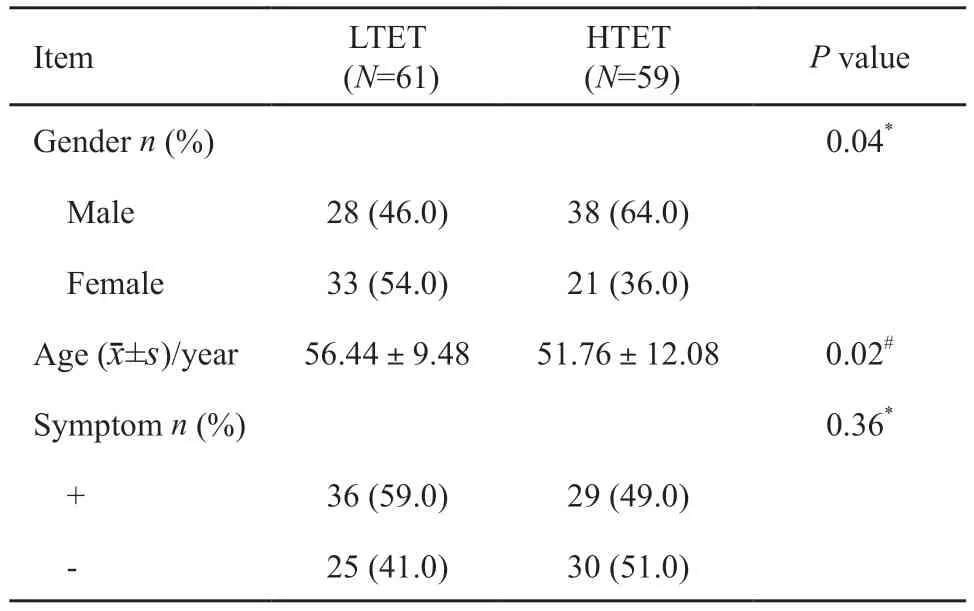
表1 患者基本人口学特征及临床信息Tab.1 Clinical and demographic characteristics of TET patients

图2 CT征象与纹理特征相关性热图Fig.2 The cross-correlation matrix for covariates
2.4 基于MSCT征象及纹理特征的预测模型的建立
将CT征象纳入Lasso模型进行筛选,得到4个重要的预测参数,并通过以下公式计算获得每例患者的CT征象模型(图3):CT预测模型=-0.18-0.02×最短径+0.62×边缘+0.02×强化程度+0.81×纵隔脂肪线。
14种纹理参数经过Lasso模型筛选后,得到相应的预测模型(图4):CT纹理模型=0.76-0.01×平均值。

图3 使用Lasso模型筛选CT征象Fig.3 Features selection for CT model by Lasso regression

图4 使用Lasso模型筛选CT纹理特征Fig.4 Features selection for TA model by Lasso regression

图5 使用Lasso模型筛选CT征象以及纹理特征Fig.5 Features selection for combination models by Lasso regression
将11种CT征象及14种纹理参数同时纳入Lasso模型,通过筛选的特征与对应加权系数的线性组合得到联合预测模型(图5):联合预测模型=2.37-0.01×最小径+0.65×边缘+0.72×纵隔脂肪线-0.04×平均值。
方差检验结果显示上述筛选出的特征在低危组和高危组中的差异有统计学意义(P<0.05,表2)。
2.5 预测模型效能的评估及比较
本研究建立的3个预测模型均能较好地预测低危和高危TET(表3)。DeLong检验结果显示,CT预测模型、纹理预测模型以及联合预测模型的效能依次增高,联合模型的预测效能和准确率最高(P<0.05,图6)。
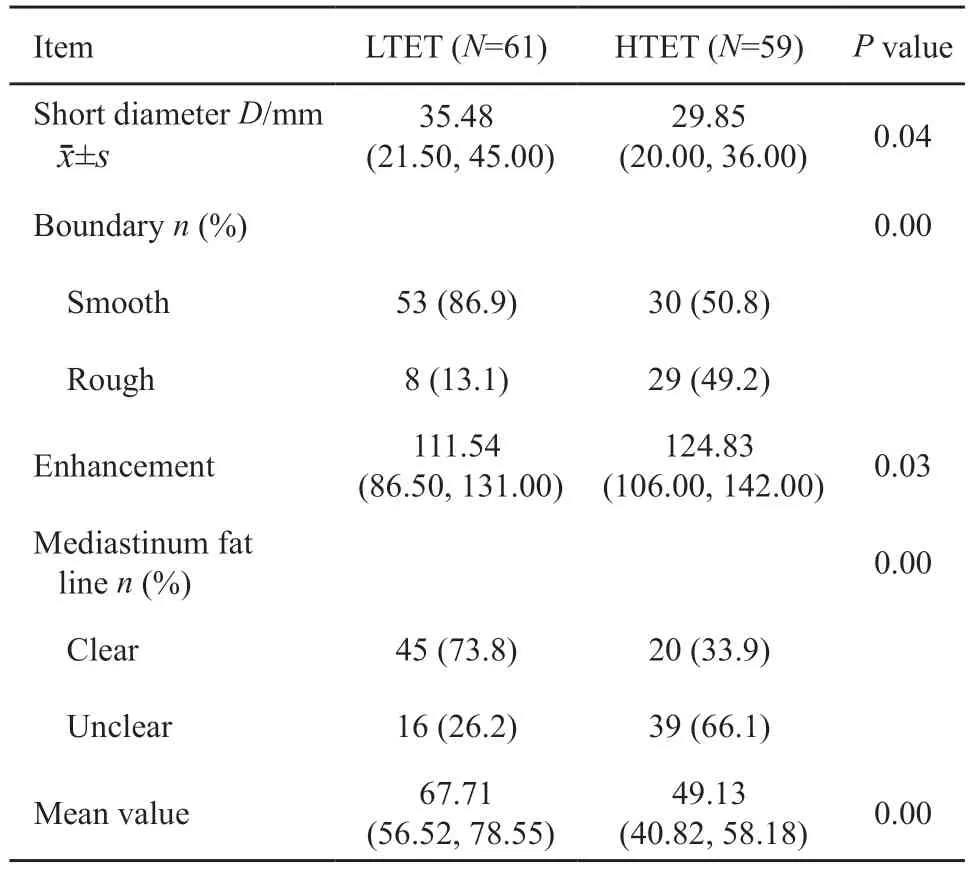
表2 预测模型及其构成特征的比较Tab.2 Pre-scores of prediction models and their compositions of TET patients

表3 预测模型在评估TET恶性程度的效能Tab.3 Performance of the models to predict the risk of TET
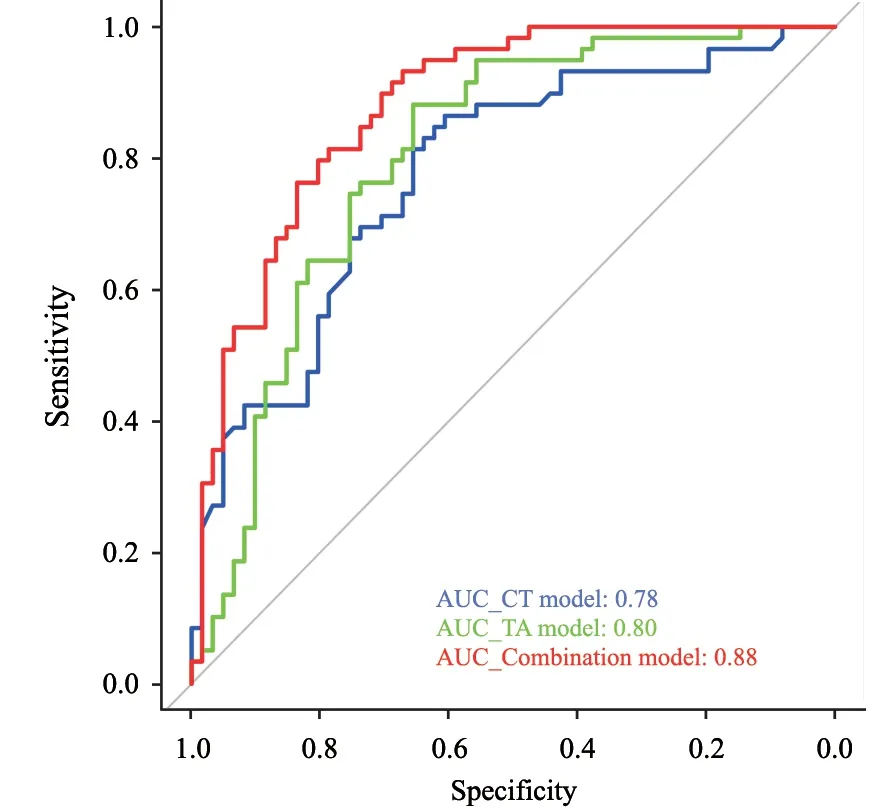
图6 CT预测模型、纹理预测模型以及联合预测模型的ROC比较Fig.6 ROC curve analysis of the prediction models
3 讨 论
本研究分别探讨了MSCT征象和基于CT图像的纹理特征在TET恶性程度评估中的价值,并且建立了预测模型。结果显示,纹理模型在预测TET恶性程度中的价值高于CT模型;将两者相结合得到的联合模型在评估TET恶性程度时的效能及准确率最高,对于临床TET的治疗及预后有重要的辅助价值。
MSCT是TET患者首选的影像学检查方法,CT图像可以直观地反映肿块的大小、部位、形态以及密度等信息。本研究结果显示,当肿块体积越小、边缘越毛糙、强化越明显、纵隔脂肪线越模糊甚至消失时,提示肿块恶性程度高的可能性越大;以此为基础建立的CT模型在预测TET恶性程度时的准确率为70.8%。
本研究中,低危组TET的最短径大于高危组TET,且最短径与恶性度呈负相关。目前对于病灶的大小与TET恶性程度的相关性缺乏共识,刘辰等[12]的研究结果同样表明,低危组TET的短径大于高危TET,但是两组间差异无统计学意义。多数研究认为肿块的边缘,强化程度以及纵隔脂肪线与TET的恶性程度相关,即恶性程度高的TET多表现为边缘粗糙,明显强化,纵隔脂肪线模糊甚至消失[13-14]。
本研究中,低危组TET的平均值高于高危组TET,平均值反映了纹理规则程度,数值越大,说明纹理规律性越强、易于描述,这可能是因为低危组(A、AB、B1型)TET内淋巴细胞数量多,分布较均匀,反映在纹理上就是肿瘤区域的纹理越规律;而高危组(B2、B3、C型)TET内上皮细胞丰富,异质性较高。肿瘤的异质性是恶性肿瘤的公认特征,研究表明,恶性程度越高的肿瘤,内部异质性越高[15]。Yasaka等[8]研究结果同样支持纹理特征中的平均值可用于预测TET恶性程度。
理论上,纹理特征比肉眼评估得到的影像学征象更能反映肿瘤的潜在生物学特性以及微观异质性程度。本研究建立的纹理预测模型对于TET恶性程度的预测效能优于CT预测模型,这一结果与该理论相符。本研究中,CT征象与纹理特征结合得到的联合预测模型在评估TET恶性程度中的效能及准确性最高(P<0.05),与报道相符[16]。
本研究存在以下几点不足:①本研究为单中心回顾性研究,样本量较少,进行前瞻性、多中心的临床研究以提高纹理分析在TET治疗前恶性程度评估中的价值,是我们下一步的研究方向;② 本研究仅将TET分为低危和高危两组进行探讨,以后的研究将会对TET进行更详细的分类。
MSCT检查是TET首选的影像学检查方法,纹理特征比肉眼评估得到的CT征象更能反映TET的潜在生物学特性以及微观异质性程度,CT征象与纹理特征相结合能够更好地实现影像学特征与分子生物学特征的结合,在预测TET恶性程度中更有优势,可为临床制订治疗方案及评估预后提供更全面及准确的依据。
