非小细胞肺癌中九基因联合检测突变分析
2020-07-20汪黎鸿阎晓初
邓 庆,罗 韬,葛 佳,刘 锋,李 磊,汪黎鸿,王 姣,阎晓初
肺癌是常见的恶性肿瘤之一,其患病率及病死率均居全国首位[1]。其中非小细胞肺癌(non-small cell lung cancers, NSCLC)占肺癌的80%~85%[2-4]。近年越来越多的肺癌相关驱动基因被发现,为个体化治疗及靶向治疗的推广奠定了基础。大量临床研究表明驱动基因的突变状态可以作为靶向药物治疗疗效的重要预测因子,EGFR和KRAS突变状态可以指导EGFR-TKIs的用药[5-6];ALK和ROS1基因融合突变患者对ALK/ROS1抑制剂有一定的疗效[7];BRAF基因突变患者可以从RAF抑制剂及MEK抑制剂联合使用中受益[8];RET基因融合患者对RET抑制剂卡博替尼敏感[9];HER-2突变患者对曲妥珠单抗具有一定的敏感性[10]。NCCN指南明确指出,在进行靶向治疗前需要对基因的突变状态进行检测,并建议对更广泛的有效基因进行检测[11],NSCLC的多基因联合突变检测可以为患者的靶向治疗提供更有效、更精准的治疗方法。
目前检测基因突变方法主要有直接测序法和ARMS-PCR法。直接测序法能够完整检测出整条片段,但其敏感度有限[11-12]。ARMS法只对指定基因进行检测,具有高灵敏性,对标本的DNA浓度及质量要求较低,能检测出样本中低至1%的突变[12],对于活检小标本也能得到理想的结果,ARMS法操作方便快捷,可同时检测9个基因的突变,能够同时检测点突变、插入缺失、融合等多种热点突变。最新版NCCN指南推荐的8个核心驱动基因EGFR、ALK、ROS1、NRAS、RET、KRAS、BRAF、HER-2基因均可行该方法检测。本文通过对522例NSCLC石蜡组织进行9个基因联合检测分析,旨在探讨NSCLC中9个主要驱动基因的基因状态及其与临床的相关性。
1 材料与方法
1.1 临床资料收集陆军军医大学第一附属医院病理科2018年2月~2019年2月经手术切除、穿刺活检的NSCLC样本522例。
1.2 试剂与仪器实验仪器采用安捷伦公司的荧光定量PCR仪(MX3000P美国)。核酸提取试剂盒、九种(ALK、ROS1、RET、EGFR、KRAS、HER-2、PIK3CA、NRAS和BRAF)突变基因检测试剂盒(荧光PCR法)由厦门艾德生物公司提供。
1.3 方法石蜡组织样本确定组织学诊断后,提取组织DNA及RNA用于后续检测。使用核酸提取试剂盒(厦门艾德生物公司)提取组织核酸。核酸提取后用紫外分光光度计测量DNA/RNA质量及浓度,按照测量的DNA/RNA浓度稀释至2~5 ng/L备用。采用福建厦门艾德生物公司的多种突变基因检测试剂盒(荧光PCR法)提供的方法,在Mx3000P实时荧光定量PCR仪中进行扩增。
1.4 统计学分析采用SPSS 18.0软件进行统计学处理。应用连续校正χ2检验或Fisher精确概率法分析基因突变与临床病理特征的相关性,所有P值均基于双向假设检验,以P<0.05为差异有统计学意义。
2 结果
2.1 临床病理特征522例NSCLC中,男性329例,占比63.03%,女性193例,占36.97%;有吸烟史237例,占比45.40%,无吸烟史187例,占35.82%,吸烟史不明者98例,占比18.77%;其中鳞癌123例,占23.56%,腺癌365例,占69.92%,腺鳞癌7例,占1.34%,未知分型(NOS)患者27例,占比5.17%;临床分期Ⅰ期6.35%,Ⅱ期3.26%,Ⅲ期18.96%,Ⅳ期56.03%,未知分期15.52%。
2.2 9种驱动基因突变状态本组522例患者中,经统计发现其中EGFR突变、KRAS突变以及ALK融合的发生率较高,分别为47.32%、7.28%、5.17%。其中女性患者中EGFR突变率、ALK融合率明显高于男性患者(P<0.001);KRAS突变在男性患者中的发生率显著高于女性(P<0.001);肺腺癌患者中EGFR、KRAS突变率明显高于肺鳞癌患者(P<0.001);EGFR突变、ALK融合在无吸烟史患者中的突变率显著高于吸烟患者(P<0.05)。HER-2、NRAS、BRAF、PIK3CA、RET、ROS1突变率分别为1.72%、0.95%、0.57%、1.72%、1.34%、1.34%,这6种突变中均未发现与患者性别、组织学类型、吸烟史、临床分期存在明显相关性(表1)。
2.3 5例共突变基因状态在早期研究中ALK、EGFR基因不存在共突变,但在实际检测中可发现一些散在的共突变类型,本组522例NSCLC中有2例ALK、KRAS基因共突变(图1),2例ALK、EGFR共突变(图2)及1例EGFR、KRAS共突变(图3)。其中4例患者可以采用相应的靶向药物进行治疗,但EGFR、KRAS共突变患者对EGFR TKIs药物不敏感(表2)。
3 讨论
肺癌已成为对人类健康威胁最大的恶性肿瘤之一,男性肺癌的发病率及病死率均居榜首,女性肺癌患者的发病率及病死率占恶性肿瘤的第二位,由此可见肺癌防治刻不容缓。随着对靶向药物研究的深入及运用,患者的无瘤生存期明显增加,病死率及复发率明显降低。NCCN指南提出初治活检中必须检测的8种肺癌驱动基因(包括EGFR、ALK、KRAS、ROS1、RET、BRAF、HER-2、NRAS),目前已公认基因靶向药物可作为晚期NSCLC的一线选择。因此准确检测肺癌这8种驱动基因状态已成为患者用药的重要依据。ARMS-PCR联合检测NSCLC中9种驱动基因方法的使用,可同时检测9个基因的突变,缩短了检测时间,节省了检测成本。九基因联合检测的价格与单点检测两个基因的价格相近,同等成本下,九基因联合检测给患者带来了更多的靶向用药选择。同时九基因联合检测还囊括了靶向用药基因及相应耐药基因检测,其中KRAS、PIK3CA突变会影响EGFR-TKIs的用药效果,因此九基因联合检测可以更加准确的为患者提供靶向用药的选择。
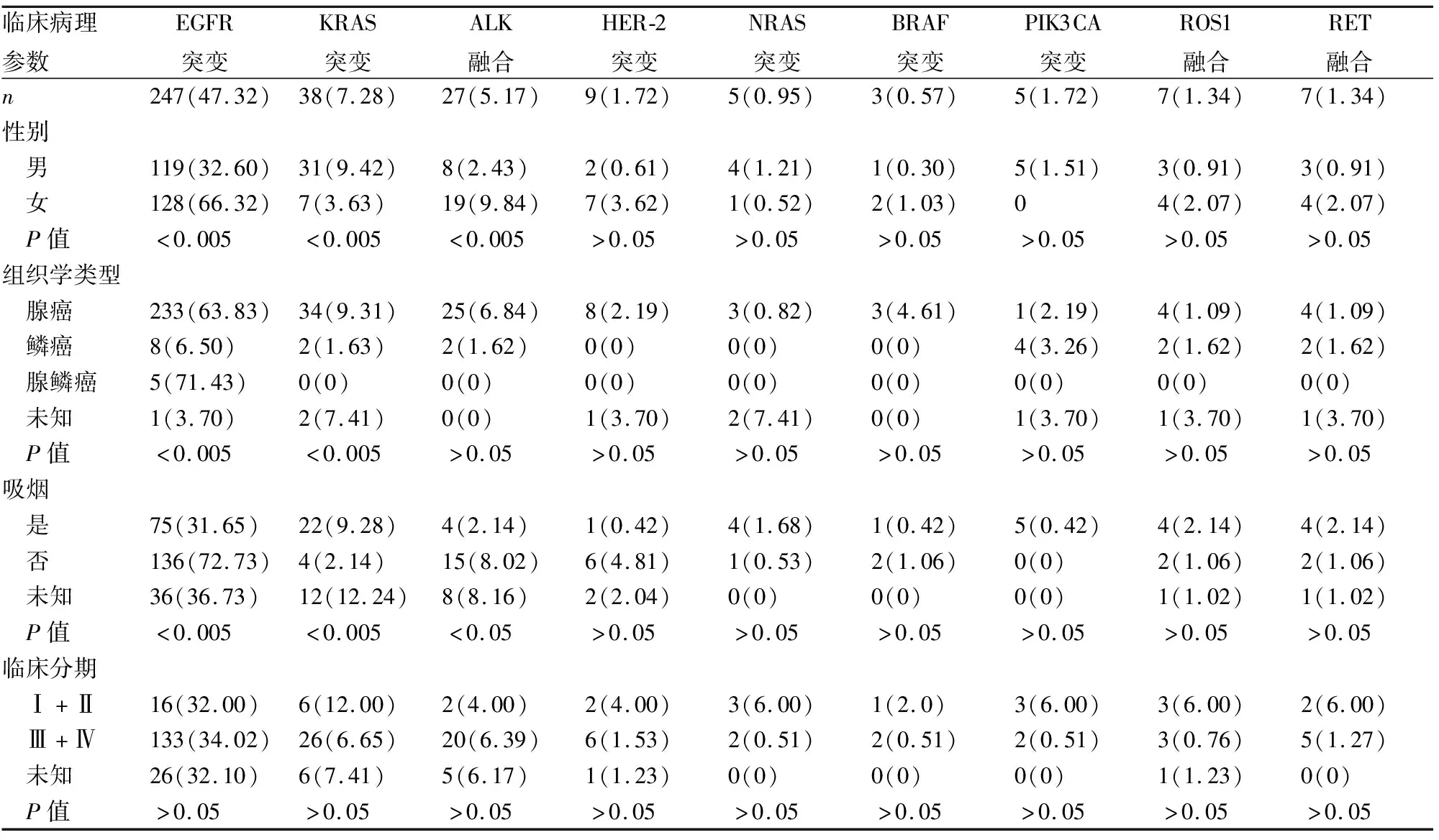
表1 非小细胞肺癌的9种驱动基因突变者的临床特征[n(%)]

表2 非小细胞肺癌中共突变患者临床特征及靶向药的选择
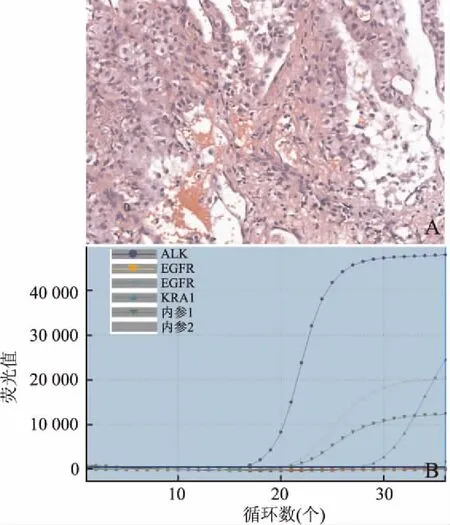
图1 (例2)ALK、KRAS共突变:A.HE图;B.ALK、KRAS共突变检测分子结果图
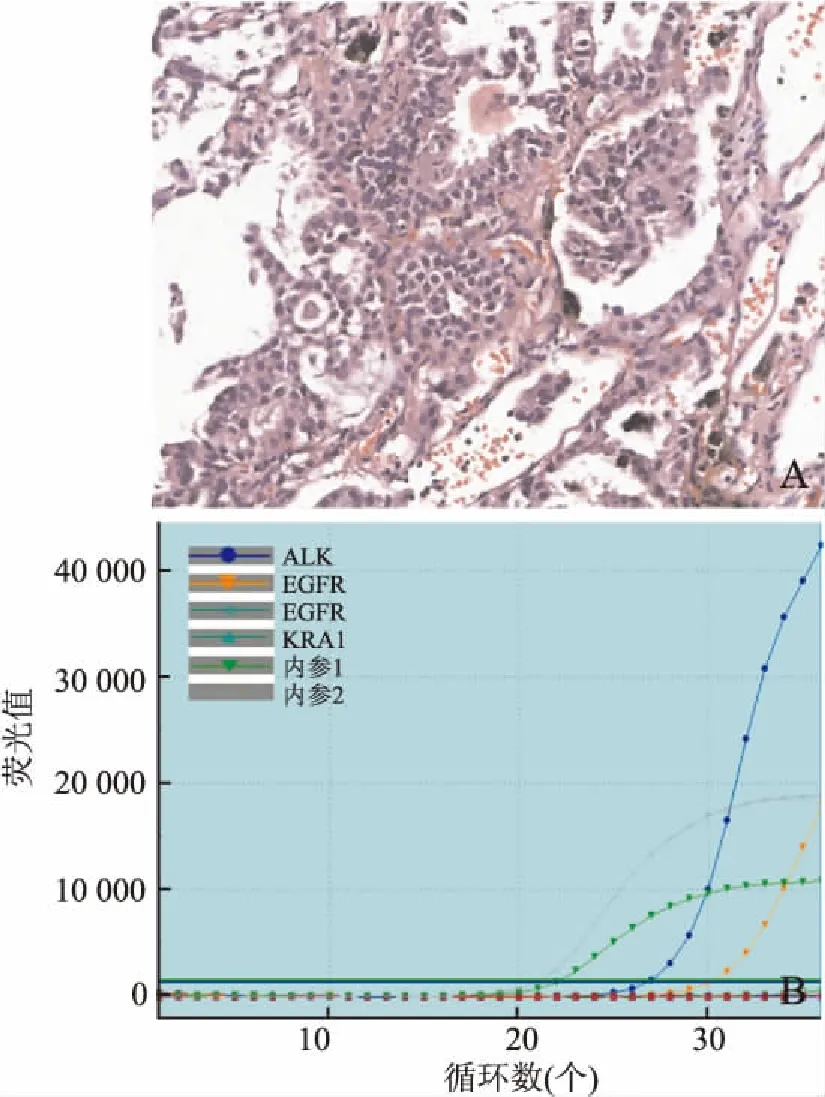
图2 (例3)ALK、EGFR共突变:A.HE图;B.ALK、EGFR共突变检测分子结果图
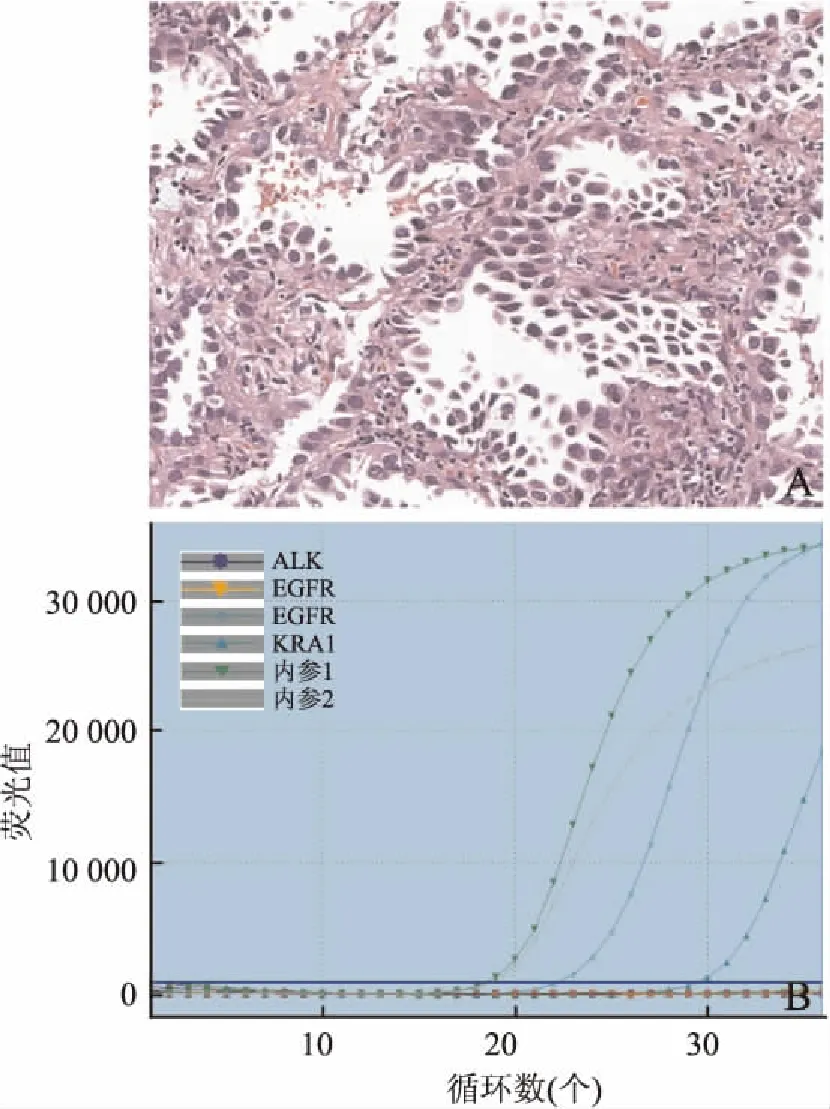
图3 (例5)EGFR、KRAS共突变:A.HE图;B.EGFR、KRAS共突变检测分子结果图
在522例NSCLC患者中,EGFR突变率最高,占47.32%,其中腺癌患者EGFR突变率显著高于其他类型,女性患者突变率明显高于男性患者,未吸烟患者突变率高于有吸烟史患者。ALK基因融合率为5.17%,其融合率与Soda等[13]的报道相近。临床EGFR、ALK抑制剂的使用给NSCLC患者的治疗带来了曙光,其他驱动基因的改变也在临床上得到相应的研究及使用,并取得的不同程度的成功。EGFR-TKIs的治疗效果受KRAS突变的牵制,而其突变率为7.28%,与国内其他报道相似[14]。ALK融合与EGFR突变相似,女性患者突变率明显高于男性,不吸烟患者明显高于吸烟患者。相反的KRAS突变在男性患者中的突变率明显高于女性,吸烟患者高于不吸烟患者,差异有统计学意义[15-16]。九基因联合检测在单基因检测基础上增加了10.15%的患者可进行靶向药物选择。较为罕见的突变类型HER-2、NRAS、BRAF、PIK3CA、ROS1、RET突变率分别为1.72%、0.95%、0.57%、1.72%、1.34%、1.34%,与以往文献报道的突变率基本一致[17-20]。
早期EGFR突变和ALK融合被认为是相互排斥的[21],近期研究相继否认了此观点[22-24]。本实验中发现了多种基因共突变的患者,其中ALK融合、EGFR突变同时存在的患者有2例,ALK融合伴KRAS突变的患者2例,EGFR、KRAS共突变患者1例。5例共突变患者中有4例患者可以进行靶向药物的选择,其中ALK融合、EGFR突变2例患者中,1例80岁患者服用EGFR抑制剂(吉非替尼)5个月,服用前期呈现出良好效果,后期效果不佳,可能因为患者年龄偏高,对药物的吸收有所下降,也有可能对其产生了相应的耐药。ALK、KRAS共突变患者并未选择相应的靶向药物治疗,ALK抑制剂价格高昂可能成为患者靶向治疗的阻碍。EGFR、KRAS共突变患者由于KRAS属于EGFR下游,对于EGFR抑制剂疗效不佳。NSCLC患者九驱动基因的联合检测,可以为患者提供更加准确的治疗方案,真正得益于靶向治疗。
