胃腺癌组织中PD-L1与HER-2的表达及临床意义
2020-07-20南鹏飞张冠军
廉 洁,南鹏飞,张冠军,张 昀
胃腺癌是全球最常见且是一类分子水平高度异质的恶性肿瘤。因此有必要对胃腺癌患者相关分子靶向检测指导下的个体化治疗进行更深入的研究。许多研究已证实在恶性肿瘤组织中免疫系统可以通过“免疫调节”来发挥作用,文献报道PD-1/PD-L1相关的免疫治疗靶点在胃腺癌的治疗中可以获益[1]。近年研究发现PD-L1相关的免疫治疗或许可以加强机体对癌细胞的清除作用。PD-L1是PD-1的配体,在许多恶性肿瘤中均有表达,可以抑制细胞因子的分泌和PD-1阳性肿瘤相关的CD4+和CD8+细胞的溶解活性[2],这些属性使得PD-L1可能成为多种恶性肿瘤免疫治疗新的靶点。HER-2是目前胃癌中研究最多的靶向治疗的靶点,随着对机体抗肿瘤免疫反应的不断认识,PD-L1相关的免疫治疗与抗HER-2的靶向治疗是否可以共同参与胃腺癌患者的治疗,两者之间是否有一定的关系尚无定论。本实验探索胃腺癌中PD-L1的表达,分析PD-L1与HER-2表达的相关性及对预后的影响。
1 材料与方法
1.1 一般资料收集西安交通大学医学院第一附属医院2010~2015年存档的临床病理资料完整的胃腺癌手术标本75例,患者术前均未行放、化疗治疗。对患者进行随访,随访方式包括电话、再次住院病历调查。随访期间内75例胃腺癌患者中存活40例,死亡35例,中位生存时间71个月;从死亡原因看,转移至肝脏15例,转移至肺10例,转移至骨4例,原部位复发6例。
1.2 方法所有石蜡组织块4 μm厚切片,PD-L1(Abcam公司,克隆号ab58810)、D2-40、S-100检测采用免疫组化MaxVision快捷法:采用柠檬酸抗原热修复,PD-L1采用正常扁桃体组织作为阳性对照,用PBS代替一抗作为阴性对照。HER-2检测参照《胃癌HER-2检测指南》检测流程先将所有肿瘤切片行免疫组化检测,将HER-2 2+病例行FISH检测[3]。
1.3 结果判定所有免疫组化结果均由三位高年资病理医师进行阅片,PD-L1阳性定位于细胞膜/细胞质,呈棕黄色,细颗粒状。PD-L1判读标准:依据PD-L1 TPS计数方法,肿瘤细胞膜染色≥1%视为阳性,总阳性肿瘤细胞数>5%视为PD-L1阳性。HER-2检测结果:将免疫组化0、1+及2+行FISH检测结果为未扩增的病例判定为HER-2无过表达,将免疫组化3+及免疫组化2+并FISH检测结果为扩增的病例判定为HER-2过表达。HER-2判读评分标准参照《胃癌HER-2检测指南》,将免疫组化为无反应、<10%肿瘤细胞膜染色判定为0,≥10%的肿瘤细胞微弱或隐约可见膜染色或仅有部分细胞膜染色判定为1+,≥10%的肿瘤细胞有弱到中等强度的基底侧膜、侧膜或完全性膜染色判定为2+,≥10%的肿瘤细胞基底侧膜、侧膜或完全性膜强染色判定为3+[3]。
1.4 统计学分析所有数据采用SPSS 22.0软件进行统计学分析。组间对比及HER-2和PD-L1阳性率与胃癌临床病理特征间的关系分别采用χ2和Fisher精确检验,两者之间的相关性采用Spearman相关性检验;采用Kaplan-Meier进行单因素生存分析,行Log-rank检验,采用Cox比例风险模型进行多因素生存分析,P<0.05为差异有统计学意义。
2 结果
2.1 临床病理特征在75例胃腺癌中,男性63例,女性12例;年龄31~86岁,平均62岁;肿瘤位于胃食管交界部23例,胃体部19例,幽门部31例,弥漫型2例;肿瘤直径>3 cm的56例,≤3 cm的19例;Borrmann分型:结节型6例,溃疡局限型50例,浸润溃疡型16例,弥漫浸润型3例;浸润深度T1期2例,T2期11例,T3期25例,T4期37例;组织学WHO分型:乳头状型2例,管状型67例,黏液型5例,低黏附型1例;Lauren分型:弥漫型35例,肠型40例;高分化6例,中分化40例,低分化29例;有脉管浸润者38例;淋巴结转移46例;神经浸润27例;有肿瘤出芽者67例;肿瘤出芽数目≤10个/20 HPF 30例,>10个/20 HPF 45例。
2.2 胃腺癌组织中PD-L1及HER-2的表达本组75例胃腺癌中,PD-L1阳性43例,阳性率为57.3%;对HER-2行免疫组化染色并对HER-2 2+者进行FISH检测,结果HER-2过表达例数占总数的17.3%(13/75),无过表达例数占总数的82.7%(62/75)(图1~3)。
2.3 胃腺癌中PD-L1表达与临床病理特征的关系PD-L1表达与胃腺癌患者年龄、性别、肿瘤部位、大小、浸润深度、Borrmann分型、组织学分型、神经浸润、脉管浸润、Lauren分型、淋巴结转移、是否有肿瘤出芽及出芽数量均无关(P>0.05)。仅与肿瘤分化程度有关(P<0.05,表1),进一步行Spearman相关性分析得出,PD-L1表达与分化程度呈负相关(r=-0.26,P<0.05)。
2.4 胃腺癌中HER-2和PD-L1表达的相关性75例进展期胃腺癌中,13例HER-2过表达病例中有11例PD-L1阳性,占HER-2过表达的85%。进一步行Spearman相关性分析显示:PD-L1表达与HER-2表达呈正相关(r=0.25,P=0.029),差异有统计学意义(表2)。
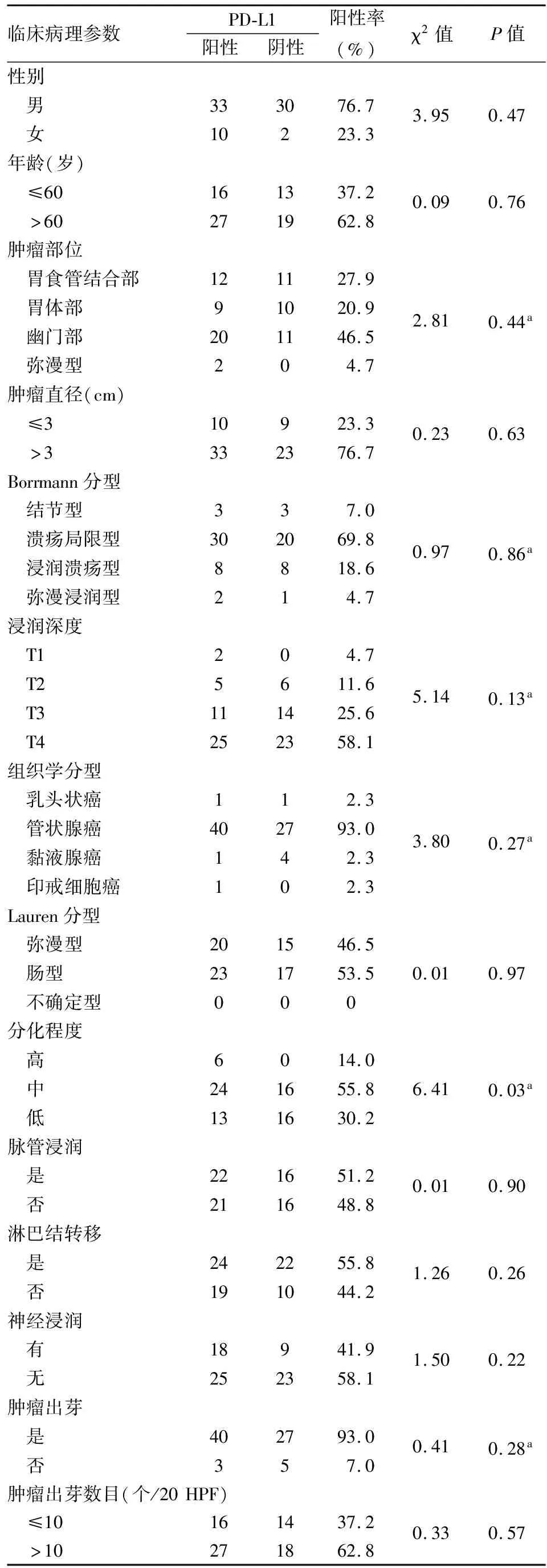
表1 胃腺癌中PD-L1表达与临床病理特征的关系
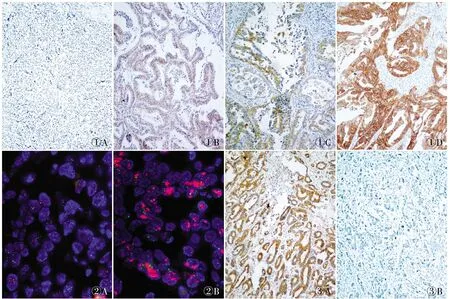
①A①B①C①D②A②B③A③B

表2 胃腺癌中PD-L1与HER-2表达的相关性
2.5 生存分析75例胃腺癌患者随访1~123个月,中位随访时间48个月,3年生存率为61%,5年生存率为52%,中位生存时间71个月。单因素分析结果显示:浸润深度(P=0.006)、脉管浸润(P=0.03)、淋巴结转移(P=0.002)、HER-2表达(P=0.02)、肿瘤出芽数>10个/20 HPF(P=0.001)是影响胃腺癌患者预后的因素(图4)。患者性别、年龄、肿瘤部位、分化程度、大小、Borrmann分型、组织学分型、Lauren分型、神经浸润、PD-L1表达与预后无明显相关性(P>0.05)。HER-2过表达组患者的5年累积生存率低于无HER-2过表达组(P=0.02);PD-L1阳性组患者的5年累积生存率低于阴性组,但差异无统计学意义(图4)。分析胃腺癌中HER-2和PD-L1表达的关系对胃腺癌患者预后的影响,结果显示:不同的HER-2和PD-L1表达组之间,其胃腺癌患者的预后存在差异:HER-2过表达PD-L1阳性组的5年生存率最低,其次是HER-2过表达PD-L1阴性组及HER-2无过表达PD-L1阳性组,胃腺癌患者的5年生存率最高为HER-2无过表达PD-L1阴性组,各组间差异有统计学意义(P=0.03,表3,图4)。

表3 HER-2及PD-L1的单因素预后分析

图4 单因素分析各因素的Kaplan-Meier生存曲线:A.浸润深度;B.PD-L1表达;C.脉管浸润;D.淋巴结转移;E.HER-2表达状态;F.不同HER-2及PD-L1表达组;G.肿瘤出芽数目
2.5 影响预后的多因素Cox分析对所有单因素分析中与预后有影响的危险因素进行Cox逐步回归分析,结果显示仅HER-2表达是影响胃腺癌患者生存期的独立预后因素(P<0.05,表4)。
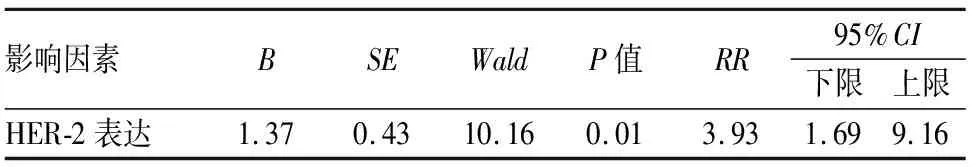
表4 影响胃癌预后的多因素Cox分析
3 讨论
肿瘤细胞若要维持增长就必须要逃避或抑制免疫系统对肿瘤组织的攻击,而机体对抗肿瘤的免疫应答主要是T细胞免疫应答,T细胞在活化的过程中需要APCs-MHC-多肽复合体与T细胞受体之间的作用,还需要共刺激分子的辅助。PD-L1作为负性刺激家族-B7家族中的一员,在肿瘤的发生发展中起到了非常重要的作用,它与肿瘤发生之间可能存在的机制如下:首先,PD-L1阳性的肿瘤组织对机体的免疫反应降低,并且T细胞对肿瘤细胞的应答反应遭到抑制;再次,肿瘤细胞中PD-L1表达可以导致特异性CD8+阳性细胞毒性淋巴细胞凋亡,导致癌组织对机体的免疫逃逸反应的发生[4]。
研究发现,PD-L1表达与胃腺癌淋巴结转移、肿瘤大小、分化程度、肿瘤部位相关[5-6]。本实验PD-L1表达仅与肿瘤分化程度有关,经进一步Spearman分析发现,分化程度越低的胃腺癌组织PD-L1阳性率越高,说明PD-L1表达与胃腺癌恶性程度有关。以往的研究发现,PD-L1与许多肿瘤的预后有关,例如,肾脏恶性肿瘤中PD-L1高表达意味着肿瘤进展速度快且病死率高;在术后复发的泌尿道上皮肿瘤中也发现PD-L1高表达;在胰腺癌中PD-L1阳性患者的生存率低于阴性患者。目前,PD-L1对胃腺癌预后的影响尚不十分明了,研究证实,胃腺癌中PD-L1表达与不良预后有关[7]。目前文献报道胃腺癌中PD-L1的阳性率并没有明确的范围,Wu等[8]的研究中PD-L1在胃腺癌中的阳性率约为42.2%,Jiang等[9]的研究中PD-L1在胃腺癌中的阳性率为43%。可以看出,PD-L1在胃腺癌中的阳性率偏高。同时,Wu等[8]在其研究中还发现生存期小于2年的胃腺癌中PD-L1阳性率为59%,明显高于生存期大于5年的胃腺癌患者(25.5%)。本实验中,75例胃腺癌中43例PD-L1阳性,阳性率为57.3%,比文献报道的PD-L1阳性率略高,这可能与本组样本量偏小有关,需在今后的实验中进一步扩大样本量再加以验证。
本实验对研究对象进行了术后5年以上的随访,结果显示PD-L1阳性病例的5年生存率为53%,低于PD-L1阴性组(59%),这也提示PD-L1阳性患者的预后较差,但差异无统计学意义,这可能与本组样本量偏少有关。
Suh等[10]提出在HER-2过表达的胃腺癌中PD-L1表达也相对高,在PD-L1阳性胃腺癌组织中HER-2过表达约占33%,而在HER-2过表达胃腺癌组织中PD-L1阳性率高达84%。这与本实验中PD-L1阳性中HER-2过表达占26%,HER-2过表达组中PD-L1阳性占85%的结果基本一致,且单因素分析显示当HER-2过表达PD-L1阳性时,患者的5年生存率最低,而HER-2无过表达PD-L1阴性时,患者的5年生存率最高。本实验发现,胃腺癌组织中HER-2表达与PD-L1表达呈正相关(r=0.25,P<0.05),在胃腺癌组织中HER-2过表达率越高,PD-L1阳性率也随之升高。这可能反应了两者共同参与胃腺癌的发生发展机制。提示同时进行抗HER-2及抗PD-L1治疗或许可以提高胃腺癌患者的治疗效果。
现今,有研究表明T细胞依赖的双特异性抗体(T-cell-dependent bispecific antibodies, TDBs)可以激活肿瘤的T细胞效应,表现出很强的抗肿瘤活性,同时可以与HER-2结合。但是同时有研究发现,若肿瘤细胞表面表达PD-L1则TDBs的抗肿瘤效应大大减弱,使用PD-L1抑制剂这种抑制效应则消失。联合使用HER-2和PD-L1的治疗或许可以延缓肿瘤的进展过程[11-13]。胃腺癌治疗中两者可能的作用机制为:(1)抗PD-L1治疗可以降低肿瘤细胞对免疫系统的逃逸作用,加强免疫细胞对胃癌细胞的细胞毒性杀伤作用,从而间接的加强了曲妥珠单抗对胃癌细胞的靶向清除作用;(2)抗HER-2靶向治疗可以通过打破胃癌原癌基因的“成瘾性”来加强抗肿瘤的免疫反应,从而引起胃癌细胞的衰老并促进T细胞的免疫清除效应。因此,抗PD-L1治疗可以巩固曲妥珠单抗的治疗效果,使得曲妥珠单抗对胃腺癌的杀伤性可以持续存在,联合使用抗HER-2和抗PD-L1治疗,或许可以延缓肿瘤的进展过程[14-15]。然而,仅通过本实验还不能明确两者作用于进展期胃癌具体的作用机制,仍需我们进一步进行更深层次的研究。
