胃癌中RNA甲基化酶NSUN2的表达及其临床意义
2020-07-20杨年钊王明海刘银华吴立胜朱志强
沈 成,杨年钊,王明海,刘银华,吴立胜,朱志强
胃癌是最常见的消化系统肿瘤,发病率在我国消化系统的肿瘤中居首位。尽管目前胃癌在临床和实验方面已有大量的研究,但近年来中晚期胃癌患者的5年生存率并未明显的改善。5-甲基胞嘧啶(M5C)RNA甲基化修饰是RNA转录后的一种RNA修饰,已经证实tRNA、rRNA和mRNA中存在这种修饰[1]。甲基化后的胞嘧啶序列仍然保持相同,但发生甲基化基因的表达可能发生显著变化。目前发现的M5C位点主要使用高通量技术结合下一代测序技术(next-generation sequencing, NGS)来证实[2]。多项实验研究了M5C在mRNA上的分布特征[3]。NSUN2(NOP2/Sun domain family member 2)作为mRNA上的M5C催化酶和结合酶,在mRNA、tRNA和microRNA的甲基化修饰中发挥了重要作用,与肿瘤的发生、发展密切相关[4-5]。已发现NSUN2在头颈部鳞状细胞癌[6]和食管鳞状细胞癌[7]等恶性肿瘤中的表达上升,但目前关于NSUN2与胃癌的相关性研究尚未见文献报道。本实验采用免疫组化、qRT-PCR及Western blot法检测NSUN2的mRNA和蛋白在胃癌及对应癌旁组织中的表达差异,分析胃癌中NUSN2表达与临床病理特征以及术后生存时间的相关性并探讨其临床意义。
1 材料与方法
1.1 临床资料收集2010年1月~2014年12月皖南医学院附属第一医院胃肠外科行胃癌根治术(D2/D3切除)并达到R0切除的手术标本109例,其中男性69例,女性40例,以患者年龄和肿瘤直径的平均值界定分组标准。另取距离肿瘤≥5 cm的对应正常胃组织作为对照。TNM分期按照AJCC第7版分期进行[8]。本实验通过医院伦理委员会审核同意并批准对109例患者的生存时间进行随访,每3个月随访1次,记录总生存时间(overall survival, OS)和无瘤生存时间(disease-free survival, DFS),失联患者定义为删失数据。在手术标本中随机挑选20例新鲜胃癌和对应正常胃组织(-80 ℃低温冰箱中保存),用于qRT-PCR和Western blot检测。
1.2 主要试剂BCA试剂盒裂解缓冲液和蛋白酶抑制剂购自中国碧云天公司,DAB显色试剂盒、免疫组化SP试剂盒购自北京中杉金桥公司;NSUN2兔抗人多克隆抗体购自英国Abcam公司,苏木精染色剂购自中国贝索生物公司。
1.3 方法
1.3.1免疫组化 免疫组化采用SP法,所有标本经石蜡切片,二甲苯脱蜡,梯度乙醇脱水柠檬酸缓冲液中孵育20 min后放入3%H2O2中10 min,加入一抗NSUN2(1∶100)4 ℃过夜后用二抗孵育30 min,加DAB显色剂显色,苏木精复染,乙醇脱水,二甲苯透明,风干后镜检拍照记录。每例切片均由三位病理医师独立阅片。NSUN2阳性定位位于细胞核,结果判断参照文献[9],根据阳性着色百分比和染色强度综合评分:阳性细胞数<10%为0分,10%~30%为1分,31%~50%为2分,>50%为3分;无阳性着色为0分,浅黄色为1分,黄色为2分,棕黄色为3分。两项得分结果相乘:<5分为低表达,≥5分为高表达。
1.3.2qRT-PCR Trizol试剂盒提取胃癌及对应癌旁组织总RNA,逆转录合成cDNA,qRT-PCR反应条件:95 ℃ 30 s预变性;5 s后控温60 ℃退火30 s,运行40个循环。NSUN2上游引物5′-GAACTTGCCTG GCACACAAAT-3′,下游引物5′-TGCTAACAGCTTCT TGACGACTA-3′;β-actin上游引物5′-AGCGAGCAT CCCCCAAAGTT-3′,下游引物5′-GGGCACGAAGGC TCATCATT-3′。NSUN2与β-actin内参对照,实验设3个副孔,用2-ΔΔCt方法计算mRNA的相对表达量[9]。
1.3.3Western blot 将胃癌及对应癌旁组织充分研磨后加入裂解液和蛋白酶抑制剂,使用BCA试剂盒测定总蛋白浓度,加入缓冲液煮沸变性蛋白。配制10%的SDS-PAGE,上样蛋白电泳后转膜到PVDF膜上,5%脱脂奶粉封闭膜,加入一抗NSUN2和β-actin(NSUN2 1∶500,β-actin 1∶1 000)4 ℃孵育12 h。加入二抗(1∶5 000)常温孵育60 min。Alpha-Ease FC成像系统(购自美国Alpha Innotech公司)观察。分析NSUN2蛋白与内参蛋白灰度值,计算目标蛋白和内参蛋白灰度值的比值用于分析NSUN2蛋白表达水平。
2 结果
2.1 胃癌及癌旁组织中NUSN2的表达NUSN2主要定位于细胞核中,109例胃癌组织中NUSN2高表达率为65.1%(71/109),而癌旁组织高表达率为15.6%(17/109),差异有统计学意义(P<0.05,图1)。

AB
2.2 胃癌中NUSN2表达与临床病理特征的关系NUSN2表达与淋巴结转移、浸润深度、远端转移、脉管浸润、神经侵犯、临床分级、TNM分期有关(P<0.05);与患者年龄、性别、肿瘤位置和直径无关(P>0.05,表1)。
2.3 胃癌中NUSN2表达与患者生存时间的关系Kaplan-Meier生存曲线显示胃癌中NSUN2高表达患者的OS低于NSUN2低表达患者(P=0.009,图2),NSUN2高表达患者的DFS也低于NSUN2低表达患者(P=0.001,图3)。
2.4 qRT-PCR检测NSUN2 mRNA水平qRT-PCR检测NSUN2 mRNA的表达结果显示,与癌旁组织相比,20对标本中有17对(85%)胃癌组织NSUN2 mRNA的表达显著升高。定量结果表明,NSUN2 mRNA相对表达量在胃癌组织中为0.99±0.52,在癌旁组织中为0.27±0.50,差异有统计学意义(t=4.528,P<0.05,图4)。
2.5 Western blot法检测胃癌及癌旁组织中NSUN2的表达与癌旁组织相比,20对胃癌标本中有16对(80%)的NSUN2蛋白表达水平明显升高(P<0.05,图5)。定量结果显示,NSUN2蛋白的相对表达量在胃癌组织中为1.24±0.36,癌旁组织中为0.69±0.29,差异有统计学意义(t=5.363,P<0.05)。
3 讨论
肿瘤的发生、发展和转移是由遗传基因改变和表观遗传学改变共同决定的。胃癌的遗传基因常发生改变,例如p53、KRAS、PIK3CA、ARID1A、MLL3和MLL突变,以及PIK3CA、C-MET、ERBB4和CD44扩增,提示它们可能是关键的致癌原因,在胃癌发生、发展中发挥关键的作用[10-14]。除遗传基因改变以外,表观遗传学的改变,包括DNA甲基化、组蛋白的翻译后修饰、RNA转录后修饰等也参与了胃癌的发生、发展。NSUN2作为mRNA上的M5C催化酶和结合酶与人类癌症的发展密切相关。Tang等[15]在研究复制性衰老过程中,发现控制细胞周期蛋白依赖性激酶p27KIP1在其mRNA上的5′Untranslated Region(5′UTR)发生M5C甲基化修饰,并且M5C的甲基化在细胞衰老过程中逐渐丧失,荧光素酶报告基因实验发现RNA甲基转移酶NSUN2过表达能抑制p27KIP1表达,而NSUN2敲低后p27KIP1表达升高,这表明NSUN2通过M5C甲基化修饰抑制p27KIP1翻译。相反,细胞周期调节因子CDK1和p21的3′UTR中发生M5C甲基化修饰后,在体外和体内实验发现会促进mRNA的翻译。Alshaker等[16]发现在乳腺癌中NSUN2 mRNA和蛋白的表达水平提高,而正常乳腺上皮细胞和组织中NSUN2的表达水平偏低。敲低NSUN2基因后乳腺癌细胞的生长和迁移能力下降,过表达NSUN2基因后乳腺癌细胞的生长和迁移能力增强[17]。进一步研究NSUN2基因的作用机制,DNA低甲基化过表达NSUN2基因并活化原癌基因MYC,然后NSUN2作为活化的MYC靶基因,诱导细胞增殖[18]。Yang等[19]在对胆囊癌的研究发现NSUN2在正常胆囊组织中低表达,在胆囊癌细胞中高表达。研究发现NSUN2过表达下调核糖体蛋白L6(RPL6)的表达,RPL6低表达减弱了DNA损伤检查点1(MDC1)和H2A组蛋白家族成员X的介体(γH2AX)之间的相互作用,抑制了肿瘤蛋白p53结合蛋白1(TP53BP1)和DNA修复相关蛋白(BRCA1)的表达。RPL6敲低减弱DNA损伤修复,适当的DNA损伤修复对于预防肿瘤发生至关重要[19]。综上所述,NSUN2参与了多种肿瘤的生长和转移。

表1 胃癌中NSUN2表达与临床病理特征的关系

图2 胃癌中NSUN2表达与患者总生存时间关系
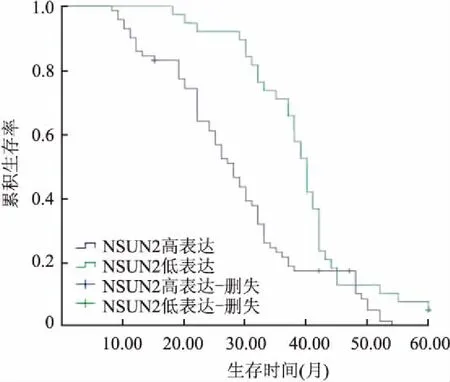
图3 胃癌中NSUN2表达与患者无瘤生存时间的关系
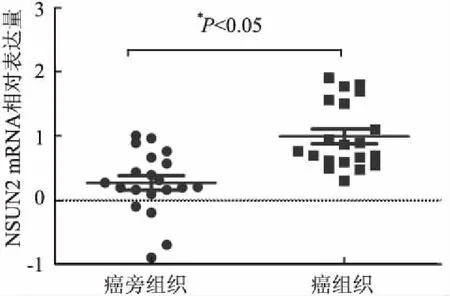
图4 qRT-PCR检测胃癌及对应癌旁组织中NSUN2 mRNA的表达
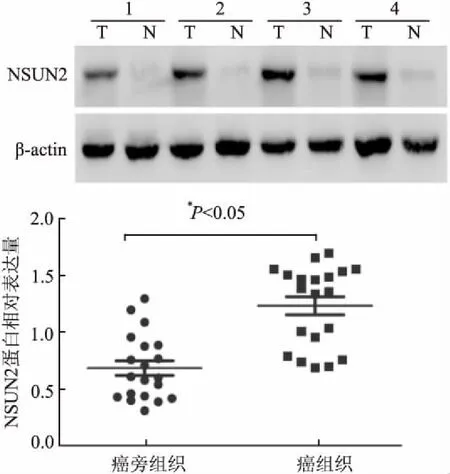
图5 Western blot法检测胃癌及癌旁组织中NSUN2的表达:T.胃癌组织;N.癌旁组织
本实验通过对NSUN2在胃癌及癌旁组织中的表达进行检测,分析NSUN2表达与胃癌临床病理特征以及患者预后的关系。本实验中免疫组化、Western blot及qRT-PCR检测结果均显示与癌旁组织相比,胃癌组织中NSUN2表达量明显上升,NSUN2表达上调与淋巴结转移、浸润深度、远端转移、脉管浸润、神经侵犯、临床分级、TNM分期密切有关;与患者年龄、性别、肿瘤位置及直径无显著相关性。生存分析显示NSUN2高表达患者术后的OS和DFS明显下降,这表明NSUN2表达与胃癌的增殖和侵袭能力相关,NSUN2高表达多提示胃癌较高的恶性程度及更差的预后。qRT-PCR及Western blot法从转录和蛋白表达水平证实NSUN2基因在胃癌和癌旁组织中的表达差异,揭示了NSUN2基因可能在转录后以及蛋白翻译过程中影响胃癌的发展。总之,本实验结果提示NSUN2表达与胃癌TNM分期和侵袭性显著相关,NSUN2表达影响患者预后,通过检测NSUN2表达可以评判胃癌患者病情和预后,未来有希望以调控NSUN2表达为靶点干预胃癌的发展进程和患者的预后。
本实验作为单中心小样本的回顾性分析,不可避免的具有一定的选择偏倚,并且缺少体外体内实验的进一步验证,因此有待进一步扩大样本量和深入的作用机制研究。总之,对NSUN2在胃癌中的工作靶点及具体的调控机制进行基因层面上的深入研究对临床上胃癌的治疗有重要意义,可以为胃癌诊断和治疗提供新思路。
