脑膜瘤组织中HIF-1α、EphA2蛋白的表达及意义
2020-07-20左延卿邢益祥代兴亮
左延卿,崔 明,王 炜,邢益祥,赵 铁,代兴亮
脑膜瘤起源于蛛网膜细胞,发病率高,占中枢神经系统原发性肿瘤30%以上。WHO(2016)中枢神经系统肿瘤分类将脑膜瘤分为3级:Ⅰ级为良性肿瘤,但术后临床上仍有较多复发;Ⅱ级为非典型脑膜瘤;Ⅲ级为恶性,具有强侵袭性和高复发率[1]。肿瘤生长需要营养供应,脑膜瘤快速增长需要其微环境增加供氧量[2]。缺氧诱导因子-1α(hypoxia induc ible factor-1α, HIF-1α)及下游的血管生成有关标志性蛋白上皮细胞激酶A2(epithelial cell kinase A2, EphA2)参与肿瘤的营养供应[3]。研究发现,在高侵袭性黑色素瘤细胞中EphA2高表达[4];EphA2在胃癌组织中的表达明显高于正常胃组织,抑制EphA2蛋白表达,可抑制胃癌细胞的生长[5]。但HIF-1α、EphA2表达与脑膜瘤临床病理分级和复发的关系文献报道较少。本文着重探讨脑膜瘤中HIF-1α、EphA2蛋白表达及其与临床病理特征的关系,为脑膜瘤临床诊疗提供理论基础。
1 材料与方法
1.1 临床资料收集2014年1月~2017年12月安徽医科大学第一附属医院和安徽省铜陵市人民医院存档的68例脑膜瘤组织标本,均为初诊并行手术治疗,68例脑膜瘤患者均为0级Simpson切除,手术完整切除肿块和累及的硬脑膜组织,再切除周围扩大约2 cm的硬脑膜,术后经病理学均证实为脑膜瘤。其中男性27例(占39.7%),女性41例(占60.3%);年龄40~78岁,平均(52.4±13.6)岁;术前患者均未行放、化疗。所有患者均对该项研究知情同意,按照WHO脑膜瘤分级,其中Ⅰ级37例,Ⅱ级18例,Ⅲ级13例。
1.2 方法
1.2.1免疫组化 免疫组化染色采用SP法,手术切除肿瘤组织均经10%中性福尔马林固定,梯度乙醇脱水,二甲苯透明,常规石蜡包埋,连续4 μm厚切片,60 ℃烘箱烤片,二甲苯脱蜡,梯度乙醇水化,柠檬酸钠微波抗原修复,羊血清封闭,按照试剂盒说明书操作,滴加一抗(兔抗人多克隆抗体),4 ℃孵育过夜,滴加酶标羊抗兔抗体,DAB显色,苏木精复染,中性树胶封固,镜下观察。以PBS替代一抗作为阴性对照。兔抗人HIF-1α、EphA2单克隆抗体购于Santa Cruz公司;DAB显色试剂盒、SP试剂盒购于武汉博士德公司。
1.2.2Western blot法 取液氮冻存的手术切除的不同级别脑膜瘤组织,添加RIPA组织蛋白裂解液,研磨、超声破碎,蛋白浓度测定采取BCA法。取30 μg总蛋白上样,SDS-PAGE电泳,分别加入兔抗人HIF-1α和EphA2多克隆抗体(PBS稀释1∶1 500),次日孵育二抗,ECL化学发光、显影,Image J软件分析灰度,以GAPDH为内参(PBS稀释1∶2 000),HIF-1α和EphA2蛋白灰度值和内参照条带灰度值的比值表示蛋白相对表达量,实验重复3次。
1.3 结果判断HIF-1α、EphA2结果判定由3名资深病理科医师独立完成,阳性细胞判定为细胞质、细胞核染色均匀,呈棕黄色或棕褐色;免疫组化染色阳性计分参考文献[6],根据阳性细胞着色强度计分:无阳性着色为0分,浅黄色为1分,黄色为2分,棕褐色为3分;得分0~1分为低表达,2~3分为高表达。
1.4 随访68例脑膜瘤患者术后复发情况采取门诊和电话咨询,随访时间从手术日开始,截至2018年12月,其中4例患者失访,随访时间12~60个月,中位时间36个月,随访中发现脑膜瘤复发者9例,其中Ⅰ级1例,Ⅱ级4例,Ⅲ级4例。

2 结果
2.1 脑膜瘤组织中HIF-1α、EphA2蛋白的表达68例脑膜瘤中,HIF-1α蛋白高表达32例(47.1%),低表达36例(52.9%),阳性主要定位于细胞质和细胞核(图1、2);EphA2蛋白高表达35例(51.5%),低表达33例(48.5%),以细胞质和细胞核呈黄色和棕黄色为阳性(图3、4)。
2.2 不同分级脑膜瘤组织中HIF-1α和EphA2蛋白的表达WHO将脑膜瘤分为Ⅰ级、Ⅱ级和Ⅲ级,本组采用免疫组化染色观察到随着脑膜瘤级别的升高,HIF-1α和EphA2的表达呈升高趋势,不同组间差异有统计学意义(χ2=27.019,30.442,P<0.001,表1)。
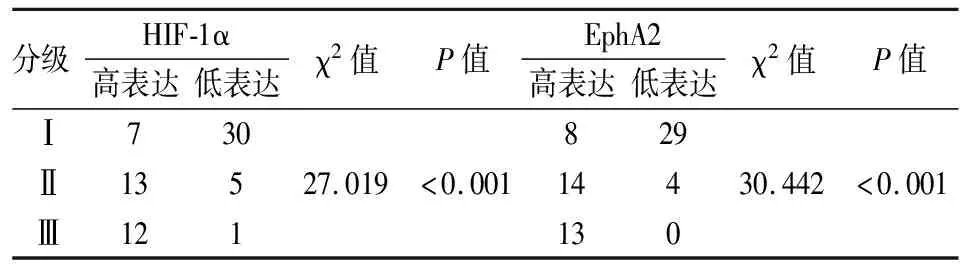
表1 不同级别脑膜瘤组织中HIF-1α与EphA2蛋白的表达
2.3 Western blot法检测脑膜瘤组织中HIF-1α和EphA2蛋白的表达Western blot法检测不同级别脑膜瘤组织中HIF-1α和EphA2蛋白的表达结果显示,与Ⅰ级脑膜瘤组织相比,Ⅱ级和Ⅲ级分化的脑膜瘤组织中HIF-1α和EphA2蛋白表达明显升高,差异有统计学意义(P=0.032,P=0.005;P=0.026,P=0.004,图5)。

①②③④

图5 Western blot法检测HIF-1α和EphA2的蛋白表达:A.Western blot检测结果;B.蛋白表达的半定量统计;*P<0.05,**P<0.01
2.4 脑膜瘤中HIF-1α与EphA2表达与患者复发的关系68例脑膜瘤患者随访12~60个月,中位时间为36个月,4例失访,有9例患者复发:复发者Ⅰ级1例(1/37,2.7%),Ⅱ级4例(4/18,22.2%),Ⅲ级4例(4/13,30.8%)。9例复发病例的HIF-1α蛋白表达免疫组化评分为2.82±1.08,59例非复发病例免疫组化评分为1.51±1.14,复发组较非复发组的评分显著增高(P<0.01)。9例复发病例的EphA2蛋白表达免疫组化评分为2.91±1.15,非复发组免疫组化评分为(1.53±1.18),复发组较非复发组的评分显著增高(P<0.01)。
3 讨论
脑膜瘤是常见的颅内原发肿瘤,手术是目前治疗脑膜瘤主要手段。WHO(2016)将脑膜瘤分为Ⅰ、Ⅱ、Ⅲ级,Ⅰ级虽然多为良性肿瘤,但也会复发和致死[3]。肿瘤切除范围、肿瘤浸润与转移、恶性程度、肿瘤部位等原因是脑膜瘤术后复发的主要原因,复发脑膜瘤治疗目前尚缺乏统一认识。本组68例脑膜瘤患者,即使采用0级Simpson切除,仍有9例(13.2%)复发,与国内外报道结果较一致[1,7],目前脑膜瘤复发的分子机制尚不清楚。
肿瘤在发展进程中,由于其快速增长,必然会出现缺血、缺氧,为增加其微环境中供氧,除血管内皮管网外,常形成自身的管道结构[2]。朱园园等[8]研究表明,HIF-1α在子宫内膜腺癌中的阳性率明显高于增殖期子宫内膜和不典型增生患者,且与子宫内膜腺癌组织学分级、淋巴结转移、临床分期等相关,检测HIF-1α蛋白表达可能为子宫内膜腺癌的诊疗和预后提供依据。朱振华等[9]在胃癌中的研究发现,与癌旁正常组织相比,EphA2在胃癌组织中的阳性率显著升高,且其表达与胃癌TNM分期、浸润程度和淋巴结转移呈正相关。本实验结果同样提示,缺氧诱导因子HIF-1α、EphA2在脑膜瘤组织中表达升高,且与脑膜瘤分级有关。HIF-1α参与机体多种生理、病理过程,是哺乳动物机体在缺氧状态下,具有特异性的活化转录因子,与多条细胞信号转导通路有关,尤其是介导缺氧信号转导,能够调控细胞的生长、增殖和凋亡等过程[10]。跨膜酪氨酸激酶受体EphA2是一种酪氨酸激酶受体超家族成员,可调控肿瘤细胞行为,实体肿瘤的快速生长易致瘤体内部出现缺氧缺血微环境,缺氧相关因子表达失衡,在人和哺乳动物体内常出现HIF-1α表达上调[11]。HIF-1α核定位后,与缺氧应答元素,如血管内皮生长因子和EphA2等目标基因结合,参与肿瘤的侵袭和转移[12]。本组结果证实随着脑膜瘤组织临床级别的升高和肿瘤复发,HIF-1α、EphA2表达呈上升趋势,提示HIF-1α、EphA2参与脑膜瘤的病变。
综上所述,HIF-1α、EphA2可能促进脑膜瘤的浸润和转移,联合检测HIF-1α和EphA2可能作为脑膜瘤预后的指标。
