法舒地尔对变应性鼻炎小鼠鼻黏膜中Th1/Th2、Th17/Treg相关细胞因子的影响
2020-07-20张玉韩佳利
张玉,韩佳利
(中国医科大学附属第一医院耳鼻咽喉科,沈阳 110001)
变应性鼻炎(allergic rhinitis,AR)是常见的上呼吸道慢性炎症[1],常由环境抗原(尘螨、植物花粉和动物蛋白等)刺激导致,是以辅助性T细胞(T helper cell,Th )2细胞因子优势表达、IgE 过度合成、嗜酸性粒细胞选择性浸润为特征的疾病。Th1/Th2[2]、Th17/调节性T细胞(regulatory T cell,Treg)[3]的免疫失衡是目前已知的变应性鼻炎发病的重要机制。Th1、Th2、Th17、Treg 均属于 CD4+T 细胞。干扰素γ(interferon γ,IFN-γ)、白细胞介素4(interlukin-4,IL-4)、IL-17、Foxp3 分别是 Th1、Th2、Th17、Treg 的主要效应因子[4]。AR研究已有数个世纪的历史,对其症状的控制越来越成熟,但彻底治愈AR仍是耳鼻咽喉科的难点问题。AR的发病机制、免疫调控网络体系和治疗方案仍在不断探索中。法舒地尔是Rho激酶抑制剂。已有研究[5-6]表明Rho激酶通过介导气道平滑肌收缩[7]、炎症细胞迁移[8]在哮喘[9]、AR[10]等慢性气道炎症疾病的发生过程中起重要作用[11]。Rho激酶抑制剂可有效抑制和逆转气道高反应性和气道重建,减轻变应性气道炎症和黏液分泌[12]。
本研究建立AR小鼠模型,选用盐酸法舒地尔作为治疗药物,观察小鼠鼻黏膜局部炎症反应,检测小鼠鼻黏膜中Th1/Th2、Th17/Treg分泌的代表性细胞因子 IFN-γ/IL-4、IF-17/Foxp3的mRNA表达情况,旨在探讨法舒地尔在AR中的作用及产生的影响。
1 材料与方法
1.1 实验动物、试剂及分组
6~8周龄C57小鼠24只(中国医科大学药理学实验室提供),雌雄各半,体质量18~22 g;试剂主要包括卵清蛋白(ovalbumin,OVA,美国Sigma公司)、AL(OH)3、盐酸法舒地尔(天津红日药业股份有限公司)。将小鼠随机分为AR组(AR小鼠未给予药物治疗,n=8)、法舒地尔组(AR小鼠给予法舒地尔治疗,n=8)、对照组(正常小鼠,n=8)。
1.2 AR小鼠模型建立
1.2.1 致敏阶段:将100 μg OVA与2 mg AL(OH)3溶于100 μL 生理盐水配制OVA溶液。AR组和法舒地尔组小鼠分别于模型建立0、3、7、10 d腹腔注射OVA溶液(100 μL)。正常对照组小鼠相同时间注射等量生理盐水。
1.2.2 激发阶段:将500 μg OVA溶于10 μL生理盐水配制OVA溶液。AR组和法舒地尔组小鼠于模型建立15~21 d OVA溶液滴鼻,每侧鼻孔10 μL,连续7 d。法舒地尔组小鼠每次OVA溶液滴鼻激发前0.5 h腹腔注射法舒地尔(10 mg/kg),连续7 d。正常对照组处理时间同法舒地尔组,药物均用等量生理盐水替代。
末次鼻腔致敏后30 min 内观察小鼠打喷嚏、挠鼻、抓脸、鼻溢等症状。记分标准[10]:(1)鼻痒,轻搔鼻 1~ 2 次,1 分;剧烈抓挠鼻面不止,3分;介于二者之间,2 分。(2)喷嚏,1~ 3 个,1 分;4~ 10 个,2 分;11 个以上,3 分。(3)流涕,流至前鼻孔,1 分;超出前鼻孔;2 分;涕流满面,3 分。以上各项指标均采用叠加量化记分法。总分>5分表示AR模型建立成功。
1.3 组织切片及染色
各组选取2只小鼠于末次激发后2 h处死,然后取鼻黏膜投入4%多聚甲醛中固定,包埋成蜡块,蜡块切片(厚度5 μm)。HE染色,镜检观察。
1.4 实时荧光定量PCR
末次激发2 h后小鼠脱颈椎处死、断头。迅速打开鼻腔,取出鼻黏膜后立即投入液氮冻融。应用Trizol试剂提取小鼠鼻黏膜组织细胞总RNA,紫外分光光度计测定RNA的质量浓度及鉴定纯度。使用RT试剂盒将0.1 ng~5 μg总RNA逆转录成cDNA。使用ABI7500实时PCR检测。引物序列:IFN-γ,上游引物5’-ATGAACGCTACACACTGCATC-3’;下游引物5’-CCATCCTTTTGCCAGTTCCTC-3’。IL-4,上游引物5’-GGTCTCAACCCCCAGCTAGT-3’;下游引物5’-GCCGATGATCTCTCTCAAGTGAT-3’。IL-17,上游引物5’-TTTAACTCCCTTGGCGCAAAA-3’;下游引物5’-CTTTCCCTCCGCATTGACAC-3’。Foxp3,上游引物5’-CCCATCCCCAGGAGTCTTG-3’;下游引物5’-ACCATGACTAGGGGCACTGTA-3’。β-actin,上游引物5’-GGCTGTATTCCCCTCCATCG-3’;下游引物5’-CCAGTTGGTAACAATGCCATGT-3’。
1.5 统计学分析
采用GraphPad prism 6.0软件进行统计学分析,计量资料以表示,2组比较采用独立样本t检验,3组比较采用单因素方差分析(One-Way ANOVA),P< 0.05为差异有统计学意义。
2 结果
2.1 3组小鼠症状比较
结果显示,与对照组比较,AR组小鼠AR症状明显(P< 0.05);与AR组比较,法舒地尔组AR症状明显减轻(P< 0.05),见表1。
2.2 各组小鼠鼻黏膜HE染色结果
光镜下结果显示,AR组黏膜可见明显肿胀及大量嗜酸性粒细胞浸润。与AR组比较,法舒地尔组鼻黏膜肿胀减轻,嗜酸性粒细胞浸润减少。而对照组未见黏膜肿胀及嗜酸性粒细胞浸润,见图1。
2.3 各组小鼠鼻黏膜中IFN-γ mRNA、IL-4 mRNA、IL-17 mRNA 及Foxp3 mRNA表达
结果显示,与对照组比较,AR组IL-4mRNA、IL-17mRNA表达明显升高,IFN-γmRNA、Foxp3mRNA表达明显降低,差异均有统计学意义(均P< 0.05)。与AR组比较,法舒地尔组IL-4mRNA表达明显降低,IFN-γmRNA、Foxp3mRNA、IL-17mRNA表达明显升高,差异均有统计学意义(均P< 0.05)。见表2。

表1 各组小鼠末次鼻腔致敏后30 min内过敏症状比较Tab.1 Comparison of allergic symptoms within 30 minutes after the last nasal sensitization in each group
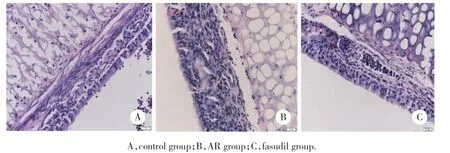
图1 各组小鼠鼻黏膜HE染色结果×40Fig.1 HE staining results of the nasal mucosa in each group × 40
3 讨论
AR是由炎症细胞和免疫细胞参与的变态反应。针对某种变应原的特异性IgE[13]抗体是引起Ⅰ型超敏反应的主要因素。CD4+T细胞分泌的细胞因子调节IgE的表达[14]。
CD4+T细胞包括Th1、Th2、Th17、Treg等。其中Th2在过敏性疾病中起着关键作用[15]。Th1/Th2、Th17/Treg细胞失衡在AR患者的发病中发挥重要作用[16]。Th1、Th2、Th17、Treg及其代表性的细胞因子(IFN-γ、IL-4、IL-7)和转录因子Foxp3之间存在着相互调节关系[17]。本研究结果表明,与对照组比较,AR组IL-4mRNA、IL-17mRNA表达明显升高,IFN-γmRNA、Foxp3mRNA表达降低(均P< 0.05),与以往研究[18-19]结果一致。
Rho/ Rho激酶通路能够调节细胞骨架动力学,影响细胞迁移、运动[20]。Rho激酶抑制剂能阻碍巨噬细胞功能[21]。阻断Rho激酶2活性可显著抑制炎症黏膜中的促炎性细胞因子[22]。本研究发现法舒地尔能够抑制AR小鼠鼻黏膜的炎症反应,猜测可能是由于Rho激酶抑制剂抑制免疫细胞迁移、趋化并对免疫反应进行调节,减少了AR小鼠鼻黏膜中嗜酸性粒细胞浸润所致,与以往研究[23]结果一致。

表2 各组小鼠鼻黏膜中IFN-γ mRNA、IL-4 mRNA、IL-17 mRNA 及Foxp3 mRNA的表达Tab.2 Expression of IFN-γ mRNA,IL-4 mRNA,IL-17 mRNA and Foxp3 mRNA in the nasal mucosa of mice in each group
Rho激酶上游信号Rho-GDP酶激活认为是免疫反应协调的关键事件,阻断Rho激酶2活性能抑制CD4+T细胞分化为Th1和Th17细胞,促进了Treg细胞分化[22]。法舒地尔处理过的小胶质细胞能够显著上调Treg细胞[24]。本研究结果表明法舒地尔对AR小鼠鼻黏膜免疫细胞的细胞因子表达水平均有影响,IL-4表达明显降低,IFN-γ、Foxp3表达明显升高。但本研究中法舒地尔治疗后IL-17mRNA 表达水平却异常升高,造成结果差异性的原因考虑可能和Th17的引物有关。
综上所述,法舒地尔能减轻AR小鼠鼻黏膜的炎症反应,明显降低IL-4表达水平,升高IFN-γ、Foxp3的表达水平,改善鼻黏膜局部Th1/Th2、Th17/Treg免疫失衡。但对于IL-17的影响趋势有待于进一步研究证实。
