长链非编码RNA NEAT1对血管平滑肌细胞增殖和凋亡的影响及作用机制
2020-07-20孙骏肖亮宋健博
孙骏,肖亮,宋健博
(中国医科大学附属第四医院介入科,沈阳 110032)
动脉粥样硬化是冠状动脉粥样硬化性心脏病、脑梗死和周围血管疾病的主要病因[1-2]。动脉粥样硬化的病理基础是脂质代谢紊乱,其特征是内膜和中膜的动脉病变[3]。血管平滑肌细胞(vascular smooth muscle cells,VSMCs)是动脉壁的重要组成部分,其功能变化可能参与动脉粥样硬化[4-5]。VSMCs的功能变化也发生在重要器官(心脏、脑和肾脏[6-7])血管中,可引起局部缺血和坏死(心肌梗死、脑梗死和肾梗死[8])。然而,目前VSMCs促成动脉粥样硬化的具体分子机制尚不完全清楚。
最近,已经充分确信了人类基因组表达的表观遗传调控,特别是长链非编码RNA(long-chain noncoding RNA,lncRNA)的功能[9]。lncRNA已确定与心血管疾病(动脉粥样硬化、心肌纤维化、脂质代谢和血管内皮异常等)有关[10]。在由氧化修饰的低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)诱导的VSMCs中,尿路上皮癌相关1(urothelial carcinoma-associated 1,UCA1)lncRNA通过下调磷酸酶和张力蛋白同源蛋白(phosphatase and tensin homolog,PTEN)来上调表达并拮抗miR-26a,从而调节增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、α-SMA和SM22-α的表达[11]。在ox-LDL处理的人冠状动脉内皮细胞(human coronary artery endothelial cells,HCAECs)中,lncRNA MALAT1表达上调,敲除MALAT1可以通过结合miR -155/SOCS1轴促进ox-LDL处理的HCAECs的细胞因子释放和细胞凋亡[12]。本研究探讨lncRNA NEAT1在VSMCs增殖和凋亡中的作用及其信号传导机制。
1 材料与方法
1.1 材料
人主动脉VSMCs购自美国ATCC细胞库。TRIzol试剂盒购自宝生物工程有限公司。转染试剂LipofectamineTM3000 购自美国Invitrogen 公司,DEME培养基购自美国GE公司,RT-PCR试剂盒购自南京诺唯赞生物工程有限公司。PCR仪为ABI 7500,酶标仪为Thermo FC。β-actin及hnRNPA1抗体购自上海赛信通生物试剂有限公司。
1.2 方法
1.2.1 细胞培养与转染:VSMCs用含10%胎牛血清、100 U/mL 青霉素和100 mg/mL 链霉素的DEME培养基于37 ℃、5%CO2培养,48 h消化传代。为了探究lncRNA NEAT1在动脉粥样硬化环境中的表达是否不同,对VSMCs给予ox-LDL梯度浓度处理,分别在细胞培养液中加入0、25、50、100、150 mg/L的ox-LDL后继续培养VSMCs 48 h。按照试剂说明书要求取处于对数生长期的VSMCs,待细胞生长密度约为70%时经LipofectamineTM3000 进行转染,继续在培养箱内常规培养48 h后收集细胞用于后续实验。
1.2.2 实时定量PCR:使用TRIzol 试剂盒提取细胞总RNA,按照试剂盒说明书要求操作。逆转录反应为 20 μL 反应体系,反应条件 25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min,4 ℃保存。以18 S作为内参,实时PCR反应采用20 μL 反应体系,反应条件为 95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40 个循环。2-△△Ct法分析数据,所有反应均设3个复孔,实验重复3次。NEAT1引物序列:F,5’-CAGTTAGTTTATCAGTTCTC CCATCCA-3’;R,5’-GTTGTTGTCGTCACCTTTCAAC TCT-3’。
1.2.3 CCK-8实验:使用胰酶消化细胞,按照每孔3×103个细胞将细胞添加至96 孔板,每组为5个复孔,于培养箱内继续常规培养,分别于1、2、3、4、5 d在每孔加入10 μL CCK-8溶液,置于培养箱继续培养2 h,使用酶标仪测量各孔的吸光度值。
1.2.4 细胞凋亡实验:VSMCs加入处理因素48 h后进行实验。细胞用不含EDTA胰蛋白酶消化,1 500g离心5 min后收集细胞,预冷的PBS洗涤2次,离心后收集细胞5×105,加入100 μL 1×结合缓冲液重悬细胞,加入5 μL Annexin V-FITC和5 μL PI 染色液,轻轻混匀,室温避光孵育10 min,再加入400 μL 1×结合缓冲液,轻轻混匀。样品在1 h内流式细胞仪检测。
1.2.5 Western blotting检 测VSMCs中hnRNPA1的表达:培养或转染的细胞以RIPA缓冲液裂解,BCA法提取蛋白质定量,使用10%SDS-PAGE分离胶电泳分离蛋白质并转至PVDF膜,使用5%胎牛血清4 ℃封闭膜过夜。分别孵育hnRNPA1及β-actin一抗(1 ∶1 000稀释)及二抗(1 ∶5 000),最后用ECL底物试剂盒检测,实验重复3次。
1.3 统计学分析
2 结果
2.1 lncRNA NEAT1对VSMCs增殖、凋亡的影响
结果显示,使用0、25、50、100、150 mg/L ox-LDL处理后的VSMCs中NEAT1表达分别为1.09±0.08、1.38±0.07、3.13±0.07、5.11±0.10、5.42±0.11。与0、25 mg/L ox-LDL处理组比较,50、100、150 mg/L ox-LDL处理组NEAT1表达明显增高,差异均有统计学意义(均P< 0.05)。
VSMCs与ox-LDL(100 mg/L)一起培养0、6、12、24、48 h,NEAT1的表达分别为1.07±0.11、1.30±0.07、2.15±0.15、3.25±0.25、5.49±0.20。与一起培养0、6、12 h比较,24、48 h时NEAT1的表达增高显著(P<0.05)。可见NEAT1的表达随着处理时间的延长而增加。
将靶向NEAT1的特殊寡核苷酸转染到VSMCs中以沉默NEAT1的表达。CCK-8增殖测定表明,与对照组(siRNA-NC组)比较,si-NEAT1组VSMCs增殖活性显著降低(P< 0.05)。表明NEAT1沉默抑制了VSMCs的增殖活性(图1)。与对照组比较,转染si-NEAT1后VSMCs表现诱导细胞早期凋亡(图2)。
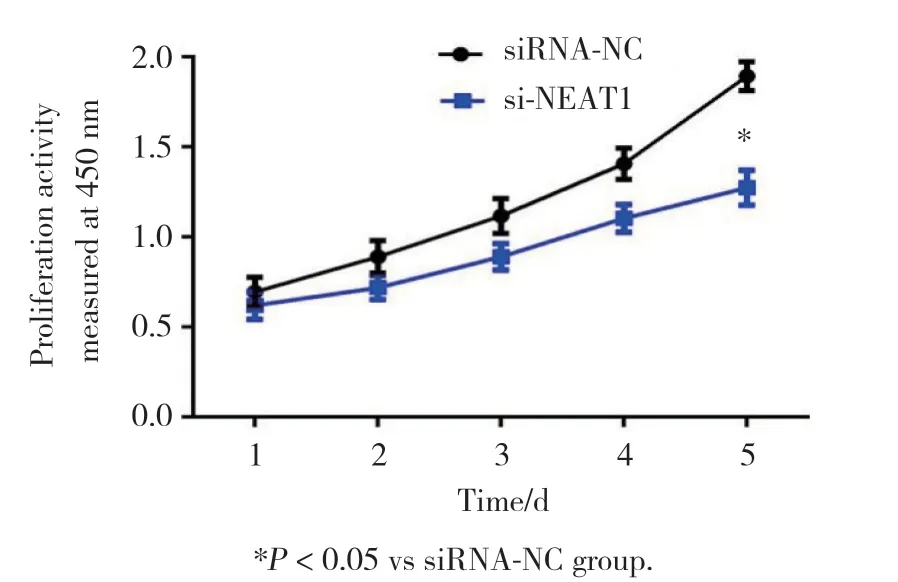
图1 NEAT1沉默对VSMCs增殖的影响Fig.1 Effect of NEAT1 knockdown on the proliferation of VSMCs
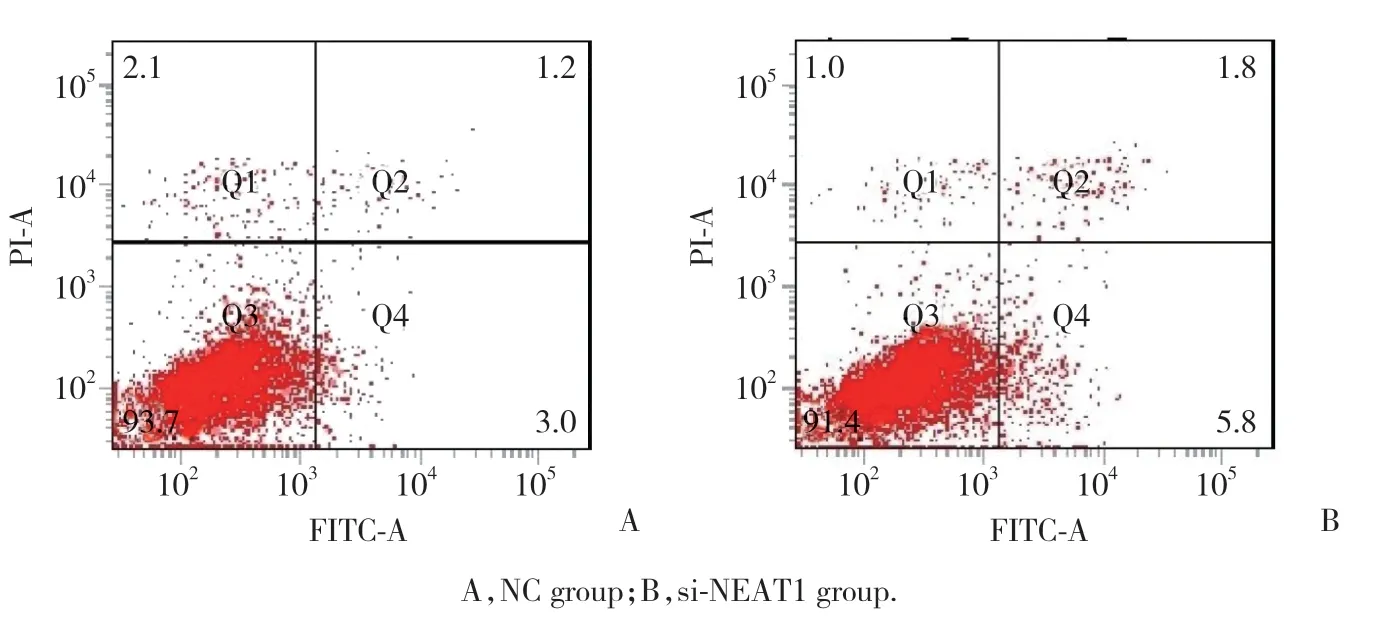
图2 NEAT1沉默对VSMCs凋亡的影响Fig.2 Effect of NEAT1 knockdown on the apoptosis of VSMCs
2.2 miR-490-3p的表达
si-NEAT1转染细胞中miR-490-3p表达检测,结果显示,与si-NEAT1转染前(0.43±0.05)比较,si-NEAT1转染后(1.01±0.07)miR-490-3p表达显著增高(P< 0.05)。然而NEAT1表达在miR-490-3p表达上调前后分别为0.98±0.06、0.97±0.04,差异无统计学意义(P> 0.05),可见miR-490-3p表达上调并不影响NEAT1表达,因此推断miR-490-3p可能是NEAT1的抑制剂靶点。
2.3 starBase V3.0软件预测NEAT1互补结合的下游miRNA及基因
结果显示,NEAT1可与miR-490-3p互补结合;miR-490-3p可与Hnrnp A1mRNA互补结合,见图3 。
2.4 Western blotting检测VSMCs中hnRNPA1表达
结果显示,与si-NC组(1.37±0.04)比较,si-NEAT1转染组(1.11±0.07)hnRNPA1表达显著降低(P< 0.05)。与NC组(1.89±0.07)比较,miR-490-3p过表达组(1.18±0.06)hnRNPA1表达显著降低(P<0.05),见图4。表明NEAT1/miR-490-3p/hnRNPA1信号通路在VSMCs的增殖和凋亡中具有重要作用。
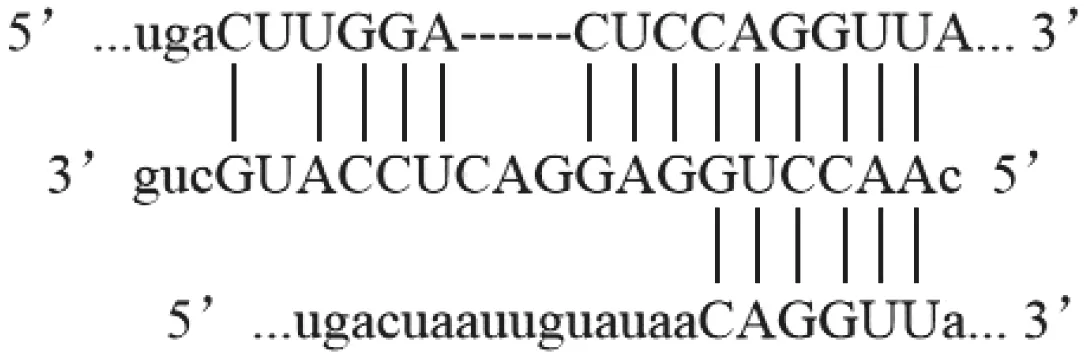
图3 生物信息学软件预测NEAT1互补结合情况Fig.3 Bioinformatics software predicts the sequences complementary to that of NEAT1
3 讨论
已有研究[13]表明lncRNA与血管平滑肌细胞的增殖和侵袭有关。MANG等[14]报道lncRNA NEAT1可以通过调节hnRNPA2的表达促进肝癌细胞的发生发展,且该调控与NEAT1-U2AF65 蛋白复合物有关。SUN等[15]研究发现,NEAT1通过与miRNA-19a-3p结合来上调SMYD2,从而促进心脏肥大的发生和发展。ZOU等[16]报道NEAT1可以通过刺激miR-224-5p促进黑素瘤细胞的增殖和侵袭,这表明NEAT1/miR-224-5p轴可以作为黑素瘤标记物。然而lncRNA NEAT1在VSMCs中的具体作用机制尚不完全清楚。

图4 si-NEAT1转染及miR-490-3p过表达时hnRNPA1的表达情况Fig.4 Expression of hnRNPA1 during si-NEAT1 transfection and miR-490-3p overexpression
本研究结果表明lncRNA NEAT1对VSMCs具有促进增殖作用,在经ox-LDL处理过的细胞中呈高表达,NEAT1沉默能够抑制VSMCs的增殖。lncRNA能够调控miRNA的表达和活性,LI等[17]发现lncRNA NEAT1通过海绵效应吸附miR-23c来促进小鼠肾小球系膜细胞的增殖、纤维化和上皮-间质转化,同时阻止小鼠肾小球系膜细胞凋亡,进而促进糖尿病性肾病的发生和发展,表明NEAT1可作为糖尿病性肾病治疗的有效标志物和潜在治疗靶点。WEI等[18]证明了lncRNA NEAT1通过海绵效应吸附miR-144-3p来调节NF-κB信号传导途径,促进败血症诱导的心肌损伤进展,揭示了NEAT1对脓毒症和脓毒症所致心肌损伤的作用。lncRNA和miRNA在VSMCs中的研究目前鲜有报道,还需要大量实验予以证实。本研究证实了miR-490-3p为NEAT1的抑制靶标,下调NEAT1的表达能够增加miR-490-3p表达,但是miR-490-3p表达增高并不能影响NEAT1表达,因此认为miR-490-3p是NEAT1的直接靶标。
hnRNPA1属于保守的不均一性核糖核蛋白家族。研究[19]显示hnRNPA1主要有影响转录、mRNA剪切、核穿梭、miRNA生物合成4种功能。已有研究[20]表明hnRNPA1改变会影响转录后调控的不同RNA代谢过程,这种改变也参与癌症、神经降解性疾病和阿尔茨海默病。WEN等[21]发现lncRNA ANCR通过抑制hnRNPA1降解和海绵吸附miR-140-3p来上调hnRNPA1的表达,进而促进肝癌细胞转移,表明hnRNPA1可以促进肝癌细胞的增殖和迁移。NISHIKAWA等[22]研究表明hnRNPA1和hnRNPU调节TRA2B转录和外显子2的可变剪接并且在结肠癌细胞的异常增殖中起关键作用。本研究si-NEAT1转染VSMCs中hnRNPA1表达显著降低,同时在miR-490-3p过表达的VSMCs中hnRNPA1表达显著降低。表明过表达lncRNA NEAT1通过使miR-490-3p/hnRNPA1轴海绵化而促进VSMCs增殖。
综上所述,miR-490-3p是NEAT1的抑制靶标,lncRNA NEAT1通过激活miR-490-3p/ hnRNPA1轴促进VSMCs增殖、减少VSMCs早期凋亡。因此认为NEAT1有望成为动脉粥样硬化基因治疗的新靶标。
