红曲霉的分离筛选及初步应用研究
2020-07-20马美荣周林艳李晶晶刘小改王小伟
马美荣,周林艳,李晶晶,刘小改,王小伟,张 坤
(北京红星股份有限公司,北京101400)
红曲霉(Monascus purpureus Went) 别名红曲等,在我国的生产和使用已有1000 多年历史,为真菌门子囊菌纲真子囊菌亚纲红曲霉属。红曲霉具有耐酸和耐高温的特性,且能耐10%vol 乙醇。红曲霉的糖化型β-淀粉酶活性及蛋白酶活性较高,并有较强的酯化力[1]。除此之外,红曲霉还有诸多有益功能:能产生抗菌活性物质,对部分引起人和动物疾病的细菌有较强的抑菌和杀菌作用[2];能够分泌抑制胆固醇合成的活性物质Monacolin K(莫那克林K),能有效降低人体的胆固醇[3]。我国许多名优酒的酿造过程是多种天然微生物参与的生物化学过程,在许多名优酒大曲中分离到红曲霉[4-6]。筛选性状优良的红曲霉菌株制作成红曲,用于白酒酿造对改善白酒的品质具有一定的应用价值。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 菌种
红曲霉、K 氏酵母、生香酵母:北京红星股份有限公司分离保存。
黑曲霉麸曲:北京红星股份有限公司酿造车间提供。
1.1.2 培养基
红曲霉分离、增殖培养基:10~12 °Bx 麦汁培养基。
红曲霉固体培养基:米饭培养基。红曲产酒精培养基:12°Bx玉米糖化液。
酵母液体种子培养基:10°Bx玉米糖化液。
1.1.3 仪器设备
气相色谱仪(HP6890),安捷伦公司;显微镜(BX51),奥林巴斯公司;电子天平(LA230S),赛多利斯公司。
1.2 试验方法
1.2.1 红曲霉的分离
称取约5 g 大曲粉或酒醅于250 mL 三角瓶中,加入约30 mL 无菌水,振摇30 min,制成菌悬液,取菌悬液接种于增殖培养基中,30 ℃、120 r/min 培养24 h,增殖液经适当稀释,涂布分离平板,30 ℃培养5~6 d。选择早期菌落为白色,后期呈红色、橙色或灰色的霉菌菌落转接斜面。对分离的菌株进行划线分离、稀释分离,纯化后转接斜面。
1.2.2 红曲制作
小米以1‰乳酸水浸泡24 h,将水倒出并沥净多余的水。121 ℃灭菌30 min,冷却后将米团轻轻打散,接斜面菌种,于30 ℃下培养,每天摇动三角瓶1~2 次,使米粒吸附瓶壁上的水珠,如此培养8~10 d。
1.2.3 红曲酯化力测定
称取5 g 红曲样品并吸取1 mL 乙酸或己酸,加入100 mL 的15 %vol 酒液中,置于30 ℃酯化5 d。蒸馏后蒸馏液用GC测定其中乙酸乙酯或己酸乙酯的含量。
色谱条件:DM-WX 毛细柱,柱温程序升温,检测器温度240 ℃,汽化室温度230 ℃;载气流速:氮气35 mL/min,氢气40 mL/min,空气400 mL/min。
酯化酶活力=C/m
其中:C——酯化液中乙酸乙酯含量,mg/L;
M——红曲用量,g。
1.2.4 红曲糖化力测定
称取5 g 红曲样品,加入90 mL 水和10 mL 醋酸-醋酸钠缓冲溶液,搅匀。35 ℃水浴1 h,用脱脂棉过滤,弃去最初5 mL,接收其余澄清滤液进行淀粉酶解糖测定,测定方法参照斐林定糖法。
其中:V0——加空白溶液后消耗标准葡萄糖溶液的体积,mL;
V——加红曲糖化液后消耗标准葡萄糖溶液的体积,mL;
C——标准葡萄糖溶液浓度,g/mL。
1.2.5 红曲产酒精性能测定
称取2 g 红曲样品加入200 mL 产酒精培养基中,30 ℃发酵7 d。发酵完毕,蒸馏,以酒精计测定蒸馏液的酒精度。
1.2.6 酵母培养
酵母斜面接种于液体试管中,28 ℃培养24 h,培养好的液体试管转接于液体三角瓶中,28 ℃培养20~24 h(酒精酵母培养20 h,生香酵母培养24 h)。
1.2.7 红曲霉在麸曲酒生产中的应用
按图1所示流程进行试验。
按照糖化发酵剂组成:(1)麸曲8 %、K 氏酵母4 %;(2)麸曲8 %、K 氏酵母4 %、产酯酵母0.5 %;(3)麸曲8 %、K 氏酵母4 %、产酯酵母0.5 %、红曲0.1 %;(4)麸曲8 %、K 氏酵母4 %、红曲0.1 %。按上述配比进行清香型白酒麸曲发酵实验,发酵好的酒醅蒸酒,对酒样进行总酯和乙酸乙酯分析,并对酒样进行品尝。
2 结果与分析
2.1 红曲霉的分离
红曲霉的分离情况见表1。从所采用的酒醅和大曲中均能分离到红曲霉,共分离到8株红曲霉。
2.2 红曲霉筛选研究

表1 红曲霉分离情况
对公司保存的8 株红曲霉分别制备红曲,进行红曲酯化力研究、糖化力研究、产酒精性能研究,从中筛选进一步应用的红曲霉。
2.2.1 红曲酯化力研究
8 份红曲样品的酯化力见表2,从结果来看,红曲霉对己酸的酯化能力远远高于对乙酸的酯化能力,这些红曲中,对己酸酯化能力最强的红曲为E,达到1949.3 mg/g·L,其次为D 的1507.3 mg/g·L;对乙酸酯化能力最强的红曲为D,达到597.9 mg/g·L,其次为E 的578.5 mg/g·L。红曲A、红曲B 的酯化结果低于对照,可能这些红曲的酯分解能力更强,刘宾[7]在研究红曲酯化能力时也出现了这样的现象。
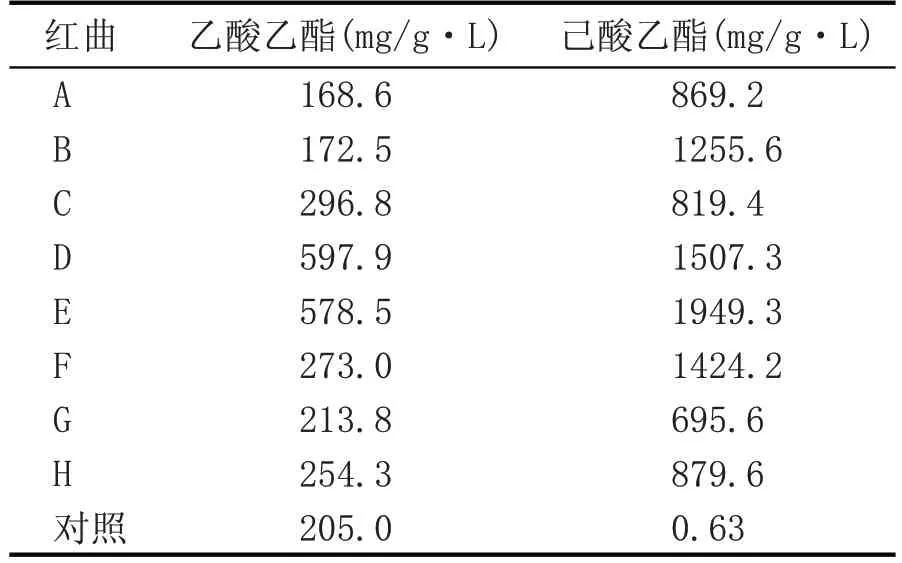
表2 红曲酯化力测定结果
2.2.2 红曲糖化力研究
8 份红曲样品的糖化能力结果见表3,不同的红曲,糖化能力相差很大,红曲D 的糖化力最高,可达1594.22 U/g,红曲E 次之,为1224.99 U/g,红曲B、C、H的糖化力为0。
2.2.3 红曲产酒精能力研究(表4)

表3 红曲糖化力测定结果
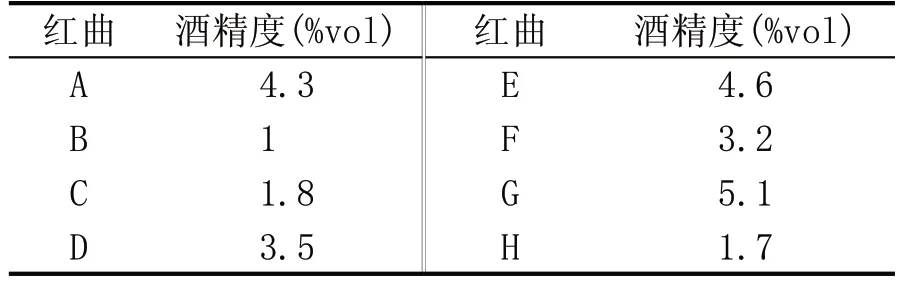
表4 红曲产酒精能力测定结果
由表4 可知,不同的红曲,其产酒精能力差别很大,其中红曲G 的能力最高,达5.1 %vol,红曲E次之,为4.6%vol,红曲B最低,为1.0%vol。
本次研究采用的8 株红曲霉,不同菌株之间的菌落外观及生长特性各不相同,糖化力、酯化力、产酒精能力差异也较大,综合来看,红曲E 有较强的酯化力、糖化力、产酒精能力,因此以红曲霉E 进行应用实验。
2.3 红曲霉在麸曲酒生产中的应用研究
红曲霉具有增酯能力,生香酵母也具有增酯能力,由实验结果可知,与对照相比,白酒发酵体系中加入红曲,酒中的总酯、乙酸乙酯含量均升高(见表5),总酯增加了44.86%,乙酸乙酯增加了87.30%,红曲霉E 确有增酯效果。但红曲霉增酯能力不及生香酵母增酯含量量高,且应用该红曲霉与生香酵母协同增酯效果并不比单纯使用生香酵母进行增酯效果突出。刘桂君等[8]研究表明,6 种红曲、酿酒酵母、生香酵母混合菌种组合在大曲酒生产中,有3个组合强化发酵的基酒中乙酸乙酯含量比普通基酒有较大提高。这说明红曲产酯能力的作用除与红曲霉菌种本身有关外,其与其他微生物的协同作用也有很大关系。结合作者的研究结果与刘桂君等[8]的研究结果来看,红曲霉与酿酒酵母、生香酵母对产酯的协同作用,与不同红曲霉的特性有关。
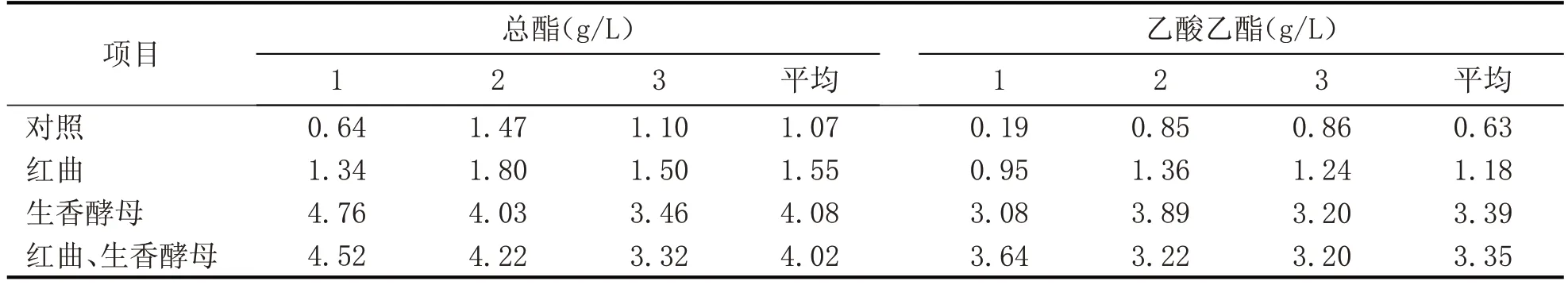
表5 生产应用酒样总酯、乙酸乙酯理化指标
从酒样品尝结果来看,在清香型麸曲白酒发酵过程中应用红曲霉,可改善原酒的口感,提升原酒品质。红曲、生香酵母混合应用,虽然对增酯无协同作用,但对口感改善效果更明显。感官品尝结果见表6。
3 小结
本次研究采用的8 株红曲霉,不同菌株之间的菌落外观及生长特性各不相同,糖化力、酯化力、产酒精能力差异也较大。红曲霉在酿酒中应用具有增酯作用,但效果不如生香酵母,所应用菌种与所使用的生香酵母在白酒增酯方面也无相互促进作用,可进一步优选菌种,进行生产应用研究。
红曲霉具有产生生理活性物质的能力,“健康中国2030”国家战略和消费者消费理念的转变,如何把红曲霉的保健功能与中国白酒相结合,造福消费者,是白酒科技工作者的重要研究课题。
