耐高温酿酒酵母菌的筛选及发酵性能研究
2020-07-20何太波赵国淼张永昌王小艳
刘 辉 ,何太波,赵国淼,张永昌,王小艳,李 凡,佟 毅
(1.中粮生化能源(肇东)有限公司,黑龙江肇东 151100;2.中粮营养健康研究院有限公司,北京 102209;3.吉林中粮生化有限公司,吉林长春 130033)
生物燃料乙醇是指未添加变性剂,以生物质为原料生产的可作为燃料用的乙醇,纯度99.5 %,属于环保型可再生清洁能源。近年来,随着全球环境的恶化及化石能源的日益枯竭,越来越多的国家开始关注可再生清洁能源燃料乙醇的开发和利用[1-4]]。燃料乙醇通常采用酿酒酵母(Saccharomyces cerevisiae)发酵,酿酒酵母最适生长温度为30~32 ℃[5]。然而,在工业生产中随着菌株生产过程中的代谢、机械搅拌等常导致发酵体系温度升高(时常可达35~37 ℃)[6-8]。高温通常会引起酵母细胞内各种成分的理化性质发生变化,影响细胞本身正常的生命活动。高温胁迫使得菌株的生产性能大幅下降,温度越高越容易引起酵母早衰、死亡。然而目前工业生产中一般采用一次水及冷冻水循环对发酵罐进行控温,受季节环境温度变化的影响,很难实现稳定控温,不仅导致生产成本增加,还增加了染菌的风险。而耐高温酿酒酵母的开发及应用可实现在较为宽泛的控温前提下保证燃料乙醇生产的稳定性,避免这部分经济损失[9]。
在长期的进化过程中,微生物细胞的生化反应和代谢途径发生改变,形成了对发酵微环境的适应性[10]。对生长环境条件变化的适应能力,以及能够随着外界环境的变化迅速产生变异,为耐高温酵母的选育提供了基础。田沈等[11]对1株耐高温麦芽糖假丝酵母(Candida maltosa)进行高温驯化,驯化后的菌株在46 ℃条件下同步糖化发酵,乙醇质量浓度达到13.93 g/L,使乙醇转化率达到理论值的88.2 %。徐大鹏等[12]筛选得到1 株在41 ℃可以良好生长的耐高温酵母菌,在41 ℃下发酵24 h,得到44.0 g/L 的乙醇,理论产率的93.0%。Kwon 等[13]在42 ℃条件下发酵甜高粱秆,乙醇得率为90.9 %。刘秀颖等[14]通过诱变和重组方法获得的酿酒酵母突变株在40 ℃和43 ℃发酵时,乙醇产量分别达到91.2 g/L 和69.2 g/L。Dhaliwal 等[15]筛选到1 株耐高温的东方伊萨酵母(Issatchenkio orientalis,Io),在40 ℃条件下以甘蔗汁作为培养基进行发酵,乙醇质量浓度达到71.9 g/L。本实验拟通过ARTP 诱变和温度驯化,筛选出在高温条件下具有较强发酵性能的酿酒酵母菌株,并对菌株的耐温性和产乙醇能力进行了研究。
1 材料与方法
1.1 材料
菌株:酿酒酵母为市售酿酒酵母,该酵母最适生长温度为32 ℃。
主要试剂:酵母粉,Oxoid 公司;蛋白胨,Oxoid公司;氯化钠,北京化工厂;琼脂,Amresco 公司;琼脂糖,西班牙(上海分装);冰醋酸,北京化工厂;山梨醇,Amresco公司;Tris,Sigma公司。
YPD固体培养基:用于酿酒酵母和毕赤酵母的活化、培养及菌种保存,含有1 %酵母提取物,2 %蛋白胨,2 %葡萄糖,15 %琼脂,121 ℃条件下灭菌20 min。
1.2 ARTP诱变与筛选
1.2.1 酿酒酵母生长曲线的测定
将活化好的菌液以5 %的接种量接种到YPD液体培养基中,在28 ℃下培养,每间隔2 h 取1 次样,测量OD600nm吸光值,根据吸光值绘制生长曲线,确定酵母的生长对数期。
1.2.2 ARTP诱变实验
将酿酒酵母发酵液稀释107倍,取100 μL 涂布YPD 固体平板,待长出单菌落后,挑取单菌落接种至YPD 液体培养基中,30 ℃、250 r/min 进行摇瓶培养,培养至OD600值为1.0~1.5,10%转接并培养5 h左右,以0.1 %的转接量用无菌生理盐水稀释并制备悬液。
设置多功能等离子体诱变系统,以氮气作为等离子体的工作气体,设置电源功率300 W,平台高度14 mm,等离子体的温度<35 ℃,湿度>10 %,气体流量12 slpm,分别将制备的50 μL菌悬液滴于无菌金属槽内中心位置进行等离子体照射,处理时间分别为20 s、70 s、120 s、170 s、220 s、270 s、320 s、370 s、420 s。诱变处理完成后以无菌生理盐水对处理完的菌悬液进行梯度稀释,涂布于YPD 固体平板,将平板分别放置于不同温度的生化培养箱中培养。将诱变后生长及发酵性能较好的菌株接种液化醪,37 ℃摇瓶发酵。
1.3 发酵验证
取生产系统液化醪,对ARTP 诱变筛选出的酿酒酵母进一步调整温度进行工业物料小试验证。工艺条件:生产系统液化醪为底物,对照菌株(目前液体燃料乙醇工业生产菌株)干粉35 ℃活化后添加,ARTP 诱变筛选出的S.C HR 接种于种子培养基(YPD液体培养基)中,经过二级培养达到一定的酵母数,按0.125 亿/mL液化醪计算用量,离心、水洗1次,用生理盐水悬浮至2 mL,在1 L 摇瓶中加入350 g 液化醪中。发酵过程测试菌株试验组均进行温度调整(0~16 h、32 ℃,17 h、33 ℃,18 h、34 ℃,19~72 h、35 ℃),并加入对照菌株的空白试验组(不调整温度,一直控温32 ℃)进行对照。
2 结果与讨论
2.1 酵母菌生长曲线的测定
对菌株进行ARTP 诱变时,一般选取对数中后期的菌株,此时菌株代谢活性高、繁殖旺盛,易发生突变且重复性好[16]。出发菌株在种子液培养基中的生长曲线如图1 所示,将酵母菌接入种子液培养基中,前4 h 酵母菌处于迟缓期,微生物的代谢系统需要适应新环境,因此数目增长缓慢[17]。在4~12 h 酵母菌数量增长迅速,处于对数生长期,在14 h 后酵母菌进入稳定期,因此本试验选择在10 h 时对酵母菌进行诱变试验。
2.2 ARTP诱变结果
诱变处理剂量和时间影响致死率和突变效率,一般认为出发菌株稳定时,即当致死率在80 %左右时,有较高的正突变率[15-16],因此试验选择处理时间为240 s,致死率为80 %的诱变菌株。对出发菌株进行ARTP 诱变处理,并绘制致死率曲线(图2)。第一轮诱变当照射时间为240 s 时,致死率为80%左右,筛选到正向突变菌株的可能性最大,选择240 s 为诱变时间。诱变处理完成后以无菌生理盐水对处理完的菌悬液进行梯度稀释,涂布于YPD固体平板,将平板分别放置于40 ℃的生化培养箱中培养24 h,筛选出诱变后生长及发酵性能较好的7个突变菌株。
2.3 摇瓶验证
对筛选出的7 个菌株进行液化醪摇瓶发酵验证。使用生产系统液化醪,37 ℃摇瓶发酵72 h 验证结果。7个菌株37 ℃摇瓶发酵结果见表1。结果显示,其中HR-B19(命名为S.C HR)乙醇产量均显著高于对照菌株,葡萄糖残留、残还原糖、残总糖、乙醇/甘油均优于对照菌株。
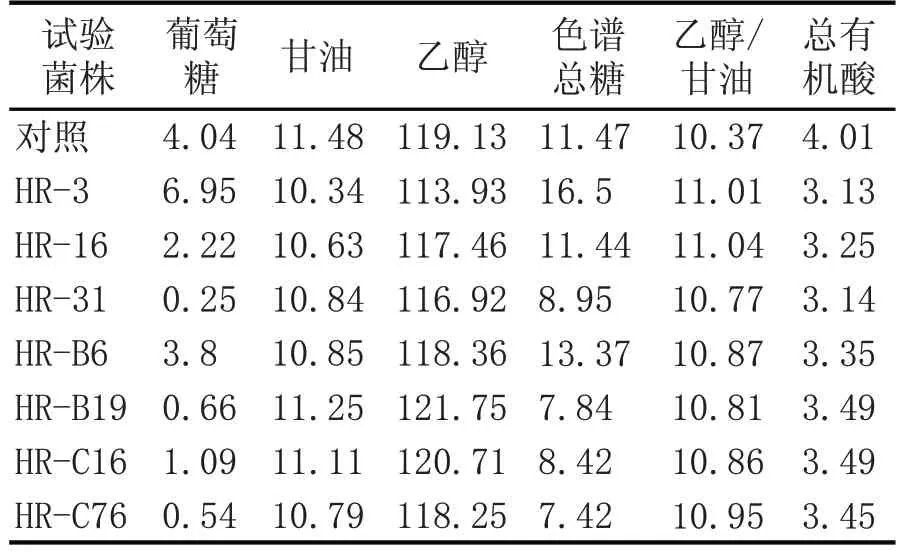
表1 37 ℃发酵成熟醪HPLC检测结果 (g/L)
2.4 工业物料小试验证
取生产系统液化醪为发酵底物,对ARTP 诱变筛选出的耐高温酿酒酵母S.C HR 进行发酵小试验证。以市售酿酒酵母菌株,发酵过程不调整温度为对照组,分为控温(32 ℃)和温度调整(温度调整规律:0~16 h、32 ℃,17 h、33 ℃,18 h、34 ℃,19~72 h、35 ℃);S.C HR(温度调整)为ARTP 诱变筛选菌株,温度调整规律:0~16 h、32 ℃,17 h、33 ℃,18 h、34 ℃,19~72 h。发酵成熟醪酒精度如图3 所示,在不控温的高温情况下(35~37 ℃),工业物料小试验证其同步糖化发酵完成后,S.C HR 乙醇产量为15.03%vol,较出发菌株提升了0.21%vol,残总糖2.38 g/100 mL,较出发菌株降低了0.05 g/100 mL。发酵产物HPLC 检测结果见表2,菌株S.C HR 在高温下的发酵各项指标均达到对照菌株正常控温条件下的发酵性能。
3 结论
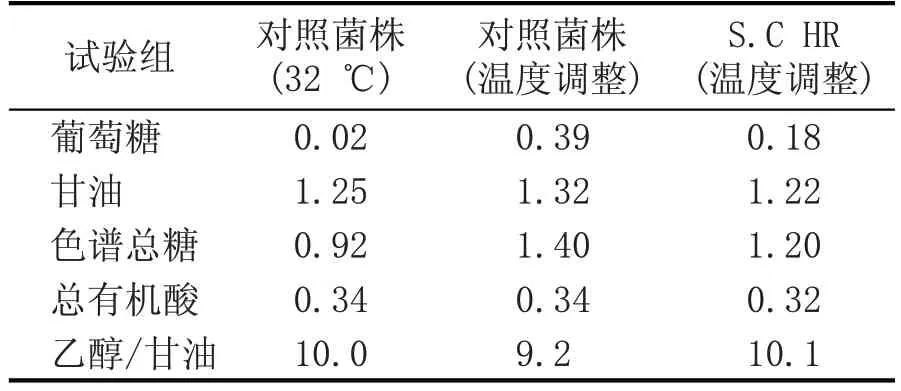
表2 S.C HR菌株与对照菌株发酵HPLC数据(g/100 mL)
与传统的诱变方法相比,ARTP 诱变对生物的遗传物质的损伤机制丰富,突变率高,并易获得遗传稳定性良好的突变株,是非常有效的真核生物诱变方法[18]。在本研究中,以市售酿酒酵母为出发菌株,通过ARTP 诱变、高温筛选和摇瓶验证,最终筛选到1 株酿酒酵母S.C HR。工业物料小试验证结果发现,高温发酵条件下(35~37 ℃),S.C HR 乙醇产量为15.03%vol,较出发菌株提升0.21%vol,残总糖2.38 g/100 mL,较出发菌株降低0.05 g/100 mL。残总糖是酒精发酵后未被发酵而残余的糖分,残糖高低是衡量酒精发酵完全程度的重要指标之一[19]。残糖偏高意味着糖分不能有效地转化为酒精,产酒率偏低,造成原料的损失,控制残糖水平是酒精企业提高出酒率和经济效益的关键。菌株S.C.HR 在高温下的发酵各项指标(残总糖、残还原糖、酒精度)均达到与对照菌株正常控温条件下的发酵性能,葡萄糖残留、残总糖、乙醇/甘油均优于对照菌株。该菌株可在高温条件下(35~37 ℃)保证乙醇生产的稳定性,提高乙醇生产效率,降低生产成本,适合于工业乙醇的大规模生产。
