脾胃虚寒型胃溃疡病证结合大鼠实验模型的建立及评价研究❋
2020-07-17宋厚盼曾梅艳陈小娟陈新怡朱晓彤彭清华
宋厚盼,曾梅艳,陈小娟,陈新怡,杨 焘,朱晓彤,李 亮,蔡 雄,喻 嵘,彭清华
(1. 湖南中医药大学中医诊断学湖南省重点实验室,长沙 410208; 2. 湖南中医药大学 中医学院,长沙 410208; 3. 湖南中医药大学医学院,长沙 410208)
胃溃疡(gastric ulcer, GU)是消化系统的一种常见病、多发病,其典型的临床表现为慢性、周期性、节律性的中上腹疼痛,常伴饱胀嗳气、泛酸、恶心、呕吐等症状[1]。随着现代社会生活节奏加快、工作及外界压力增加、不良生活饮食习惯等都使GU的发病(复发)率呈逐年上升趋势,严重影响人们的身心健康和工作生活状态[2]。GU属于中医学“胃脘痛”“痞满”“嘈杂”等范畴。从病因学角度分析,本病多由饮食不节、情志内伤、外邪犯胃、素体脾虚而致,临床常见证型包括脾胃虚寒、胃阴不足、肝胃不和、肝胃郁热、胃络瘀血等。中医病机理论认为,脾胃虚寒是GU起病和复发的病理基础,脾胃虚寒始终贯穿于GU的病理过程之中[3]。因此,建立脾胃虚寒型GU病证结合实验模型,对于GU疾病的基础和临床研究具有重要意义。
针对当前GU动物模型构建方法混杂,模型评价指标体系不统一,特异性、客观性较差,本研究拟建立符合西医疾病发病特点和中医病因学发病特征的脾胃虚寒型GU病证结合大鼠模型。故采用反证方剂进行验证,从症状与体征、组织、细胞、分子等多个层面对模型进行评价,以期为人类GU的临床研究提供可靠、稳定、可重复的实验动物模型,为临床推广应用中医药治疗和预防GU复发提供科学依据。
1 材料
1.1 实验动物
雄性SPF级SD大鼠,体质量(180±20)g,购于湖南斯莱克景达实验动物有限公司(许可证号SCXK(湘)2016-0002)。正式实验前先适应性喂养7 d,期间自由摄食与饮水,饲养温度18℃~23℃,相对湿度45%~55%,光暗周期12 h。
1.2 药品与试剂
黄芪建中汤(HQJZT)组方药物黄芪、桂枝、白芍、甘草、大枣均购于湖南中医药大学第一附属医院,生姜、饴糖在农贸市场购置;阿司匹林(批号85599356)购于拜耳医药保健有限公司;PBS磷酸盐缓冲液(PH 7.2-7.4,批号1016K022)购于北京索莱宝科技有限公司;丙二醛(MDA)测定试剂盒(批号20180629)、一氧化氮(NO)测定试剂盒(批号20180702)购于南京建成生物工程研究所;前列腺素E(PGE)试剂盒(批号201807)购于上海纪宁生物科技有限公司;TLR-2一抗(批号AH04173651)、MyD88一抗(批号AG07205376)、山羊抗兔二抗(批号AG11091289)均购于北京博奥森生物技术有限公司;DAB显色试剂盒(批号ZLI-9018)、伊红染液(批号150109)均购于北京中杉金桥生物技术有限公司;苏木精(批号P4163)购于山东西亚化学工业有限公司。
1.3 主要仪器
RE-2000B旋转蒸发仪,巩义予华仪器设备有限公司;KD-BM II电脑生物组织包埋机,浙江省金华市科迪仪器设备有限公司;CM1900冷冻切片机,德国LEICA公司;YD-A生物组织摊片机,浙江省金华市益迪医疗设备有限公司;Moticam Pro 205 A三目生物显微镜,麦克奥迪(厦门)医疗诊断系统有限公司; Centrifuge 5810R高速冷冻离心机,德国Eppendorf公司;SmartSpecTMplus核酸蛋白测定仪,美国BIO-RAD公司;Cytation imaging reader,美国BioTek公司;UV-1750紫外可见光光度计,日本岛津公司。
2 方法
2.1 药物制备
黄芪建中汤组成:黄芪5 g,桂枝9 g,甘草6 g,大枣4枚,白芍18 g,生姜9 g,胶饴30 g[4]。按组方比例混合药材饮片(胶饴除外),蒸馏水浸泡1 h(料液体积比1∶8),煎煮2次,每次40 min,纱布过滤,合并2次滤液后兑入胶饴,文火加热溶化,减压浓缩。按人与大鼠体表面积换算给药剂量,以1 mL药液/100 g体质量灌胃。
2.2 脾胃虚寒型GU大鼠模型的建立
36只SD大鼠按随机数字表法分为正常组、模型组、HQJZT组(方药反证组)3组。第1天起大鼠自由饮食饮水,模型组和HQJZT组给予1 g/mL番泻叶水煎剂灌胃,每日定时将模型组、HQJZT组大鼠放入装满常温自来水的水槽中游泳,直至大鼠四肢划动无力,头部没入水中立即捞起,连续造模7 d,由此建立脾胃虚寒证模型。第8天开始,模型组大鼠给予无水乙醇1 mL/200 g体质量灌胃,1 h后再给予200 mg/kg剂量阿司匹林灌胃,连续给药5 d,由此建立GU模型。HQJZT组则在模型组基础上提前2 h预防性给予9.27 g/kg的HQJZT水煎剂,正常大鼠全程仅给予等量蒸馏水灌胃。末次给药后大鼠禁食禁水12 h,麻醉大鼠腹主动脉采血分离血清。取出胃沿胃大弯剪开,清洗胃内容物,拍照记录溃疡情况。
2.3 一般症状与体征
观测各组大鼠的精神状态、整体活动情况、食欲状态、毛发光泽、粪便性状,对舌象、鼻唇、耳廓、爪趾进行重点细致观察。隔天测定1次大鼠的体质量、进食量、饮水量和肛温。
2.4 胃黏膜溃疡指数(ulcer index, UI)测定
参照Guth标准[5]计算胃黏膜损伤积分:正常计0分,病灶长度≤ 1 mm计1分,1 mm <病灶长度≤ 2 mm计2分,2 mm <病灶长度≤ 3 mm计3分,3 mm <病灶长度≤ 4 mm计4分。病灶长度> 4 mm时分段计分,若病灶宽度> 2 mm则分数乘以2。最后以胃黏膜病灶分数总值的均值作为胃黏膜UI。溃疡愈合率=[(模型组UI-药物组UI)/模型组UI]×100%。
2.5 胃黏膜组织形态学观察
摘取大鼠全胃,剪除胃底部分,用生理盐水润洗后以4%多聚甲醛固定,在胃窦至胃体部位取1×1 cm大小的组织,采用乙醇梯度脱水,常规石蜡包埋切片,苏木精-伊红(hematoxylin and eosin, HE)染色,中性树胶封片后于光学显微镜下进行组织形态学观察。
2.6 NO、MDA、PGE检测
采用大鼠NO测定试剂盒、MDA测定试剂盒、PGE ELISA试剂盒,按照操作说明书步骤进行实验,使用BioTek cytation5酶标仪检测PGE和NO含量,使用岛津UV-1750紫外可见光光度计测定MDA含量。PGE在波长450 nm处测定吸光度,作标准曲线方程,根据标准曲线的线性回归方程计算样品中PGE含量。NO和MDA的检测波长分别为550 nm和532 nm。
2.7 免疫组化检测TLR-2、MyD88表达
取胃窦至胃体黏膜损伤部位1 cm×1 cm大小的组织,以4℃生理盐水清洗,4%多聚甲醛固定、脱水、石蜡包埋。将胃黏膜组织石蜡切片脱蜡、水化,每张切片滴加70 μL 3% H2O2室温封闭,修复抗原,以5%胎牛血清封闭非特异性抗原。分别以TLR-2一抗(1∶100)、MyD88一抗(1∶100)4℃孵育过夜,滴加反应增强液,室温反应20 min,PBS冲洗后以Goat anti-rabbit二抗(1∶2000)室温孵育2 h。DAB溶液显色,苏木素复染,盐酸乙醇分色,二甲苯透明,中性树胶封片。每张切片在显微镜下拍摄4个高倍视野,采用Image Pro Plus图像分析软件测定TLR-2、MyD88蛋白表达的光密度(IOD)值。
2.8 统计学方法

3 结果
3.1 一般症状与体征
正常大鼠精神状态良好,动作敏捷,活动自如,体肌健壮,背毛光亮密泽,大便正常;模型大鼠精神萎顿,动作迟缓无力,倦怠扎堆,眯眼,体肌瘦削,体质量减轻,背毛疏散无泽甚至竖立发黄,大便溏泄、肛门污秽;给予HQJZT后大鼠精神状态好转,活动自如,反应灵敏,背毛柔顺亮泽,大便恢复正常。
3.2 大鼠局部外观改变(舌象、鼻唇、耳廓、爪趾)
图1示,正常大鼠舌质红活明润,舌苔薄白,鼻唇淡红微湿润,耳廓红白相间,脉络清晰,爪趾暗红,抓爬有力。模型大鼠舌质青紫,晦黯无光,鼻唇紫暗,耳廓淡白,脉络收缩,爪趾不收,活动无力。给予HQJZT后大鼠舌象、鼻唇、耳廓、爪趾的色泽和形态均有明显改善,与正常大鼠表现相似。

图1 各组大鼠局部外观改变示意图
3.3 大鼠体质量、进食量、饮水量、肛温变化
图2示,模型大鼠在造模第7天起体质量、进食量均明显下降,与正常组比较差异有统计学意义(P<0.05)。给予HQJZT后,大鼠体质量保持稳定增长,进食量明显增加,与模型组比较差异有统计学意义(P<0.05)(图2A、2B)。造模第9天起模型大鼠饮水量呈现减少趋势,给予HQJZT后大鼠饮水量略有增加(图2C)。图2D结果表明,造模第9天起,模型大鼠肛温显著下降,与正常组比较差异有统计学意义(P<0.05)。给予HQJZT治疗后,肛温显著高于模型大鼠(P<0.05)。

注:与正常组比较:*P<0.05;与模型组比较:#P<0.05图2 造模过程大鼠体质量(A)、进食量(B)、饮水量(C)、肛温(D)变化比较示意图
3.4 胃黏膜UI与溃疡愈合率
图3表1示,正常大鼠胃黏膜光整完好,模型大鼠胃黏膜可见明显出血点或出血条带,UI显著高于正常组,差异有统计学意义(P<0.01);给予HQJZT治疗后UI明显降低,与模型组比较差异有统计学意义(P<0.01),溃疡愈合率为78.05%。
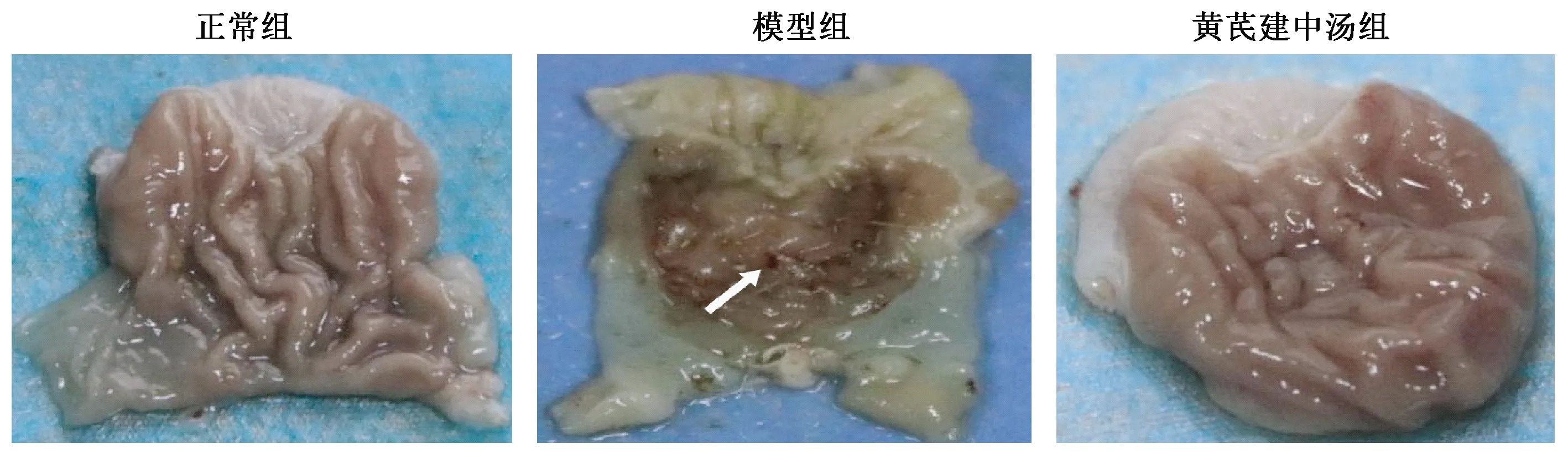
注:箭头表示溃疡部位图3 各组大鼠胃黏膜损伤(溃疡)示意图

注:“*”显示胃黏膜上皮脱落并形成溃疡;箭头显示炎性细胞浸润及黏膜下层增厚图4 各组大鼠胃黏膜损伤病理分析比较(HE染色 ×100和200)

表1 各组大鼠UI和溃疡愈合率比较
3.5 胃黏膜病理组织切片观察
图4示,正常大鼠胃组织层次分明,结构完整,上皮细胞排列整齐,未见损伤、脱落,黏膜表面胃小凹清晰可见,固有腺体排列规则紧密,未见明显充血及炎细胞浸润。模型大鼠胃黏膜出现明显损伤,大量上皮细胞变性、糜烂、脱落;胃小凹结构破坏,腺体结构紊乱;黏膜肌层可见不同程度的水肿及炎性细胞浸润,黏膜下层增厚。给予HQJZT后大鼠胃黏膜恢复完整,未见上皮脱落和腺体损伤,少见炎性细胞浸润。
3.6 胃黏膜PGE、MDA、NO含量改变
表2示,与正常组比较,模型组PGE、NO含量显著下降(均P<0.01);给予HQJZT后,PGE、NO含量明显增加,与模型组比较差异有统计学意义(P<0.01)。模型大鼠胃黏膜MDA含量显著高于正常组(P<0.01),给予HQJZT后MDA含量明显减少,与模型组比较差异有统计学意义(P<0.01)。
3.7 胃黏膜TLR-2及MyD88蛋白表达
图5表2示,模型大鼠胃黏膜TLR-2及MyD88蛋白表达量均显著高于正常大鼠(P<0.01)。给予HQJZT后TLR-2及MyD88蛋白表达均显著下调,与模型组比较差异有统计学意义(P<0.01)。
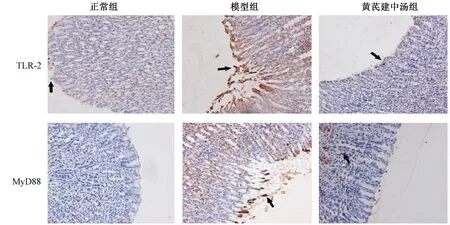
注:箭头所示为TLR-2和MyD88阳性表达部位图5 大鼠胃黏膜TLR-2及MyD88表达示意图(免疫组化染色,× 200)

4 讨论
动物模型是现代医学研究的重要实验方法与手段。随着中医药研究发展的需求,各种类型的动物模型已被广泛应用于中医药领域,在中药复方药效机制研究、中药新药开发等方面均发挥着举足轻重的作用。病证结合动物模型是指在中医药理论指导下,在结合现代医学理论与实验动物科学知识基础上,通过临床调查研究,选择有密切联系的疾病和证候,分别(或同时)采用现代医学病因复制疾病动物模型和采用传统中医学病因复制证候动物模型,使该模型同时具备疾病和证候的特征[8]。
中医病机理论认为,脾胃虚寒是GU发生的根本内因,脾胃虚寒始终贯穿于GU的病理过程中。有学者对3422例GU辨证治疗的临床研究文献进行统计分析,发现脾胃虚寒和肝胃不和是本病最常见的证型[9]。《消化性溃疡中医诊疗专家共识意见(2017年)》[10]和《消化性溃疡中西医结合诊疗共识意见(2017年)》[11]均建议,以HQJZT加减治疗脾胃虚寒型GU。本研究采用“苦寒泻下+劳倦过度”复合中医病因造模法构建脾胃虚寒证候模型,采用“无水乙醇+阿司匹林”诱导GU模型,并从宏观症状与体征、组织形态、细胞、分子层面,根据“有是证用是方”理论,引入反证方剂HQJZT对所建模型进行客观评价。
病证结合动物模型建立成功与否,其评判标准如何是一个极具价值的关键问题。此前有研究者采用饮食失节与改良Okabe法制备脾胃虚寒型GU动物模型,以溃疡发生率、耐寒性(游泳时间)、溃疡面积及血清胃泌素(GAS)含量变化作为模型评价指标[12];另有研究者采用隔日喂饲猪油和白菜联合醋酸涂抹胃壁造模法构建脾胃虚寒型GU动物模型,以UI、血清及胃黏膜中超氧化物歧化酶(SOD)、MDA水平作为模型评价指标[13]。
本研究以中医学病因病机、藏象理论为指导,以人体规范化证候为基础,首先从整体症状和体征对模型进行评价。经过中医病因学造模和西医病因学造模,模型大鼠出现明显的症状和体征病理改变(图1)。给予HQJZT治疗后,大鼠整体状态好转,这些结果从宏观症状体征层面和方药反证角度初步揭示了脾胃虚寒证候模型构建成功。GU发病机制的现代理念认为,胃黏膜屏障健康就不会形成溃疡,溃疡的发生是黏膜屏障被破坏的结果[14]。肉眼观察结果显示,正常大鼠胃黏膜光整完好,模型大鼠胃黏膜充血、水肿,可见明显出血点或条带(图3)。给予HQJZT后黏膜损伤明显好转,UI显著降低。胃黏膜病理组织切片观察结果亦表明,黄芪建中汤可修复模型大鼠损伤的黏膜组织,使炎性细胞数量明显减少(图4)。以上结果从组织形态学层面和方药反证角度提示,本研究所构建的实验模型为脾胃虚寒型GU病证结合模型。
PGE是一种生物效应很强的内源性细胞因子,它可抑制胃酸分泌,增加黏膜血流量,刺激胃黏液和碳酸氢盐分泌,保护胃黏膜屏障[15]。MDA是氧自由基引起脂质过氧化反应的终产物,其含量的高低可反映机体脂质过氧化程度及溃疡损伤的程度[16]。NO是一种内源性的血管舒张因子,可扩张胃黏膜血管,增加黏膜血流量,在促进溃疡修复过程中发挥重要作用[17]。本文(表2)结果表明,给予HQJZT治疗可使模型大鼠PGE、NO含量明显提高,MDA含量显著减少。以上结果从细胞因子层面和方药反证角度提示,本研究所构建的模型为脾胃虚寒型GU病证结合实验模型。
TLR-2为广泛表达于胃肠黏膜组织的天然免疫受体,髓样分化因子88(MyD88)是TLR-2胞内结构域的重要接头蛋白,参与TLR-2介导的信号传导[18]。众多研究表明,GU发病过程中,TLR-2/MyD88信号可被立即激活,阻断TLR-2/MyD88信号则可促进黏膜损伤修复,加速溃疡愈合[6-7]。本文研究结果表明,模型大鼠胃黏膜TLR-2及MyD88蛋白表达显著增加,给予HQJZT后TLR-2及MyD88蛋白表达显著降低(图5表2)。以上结果从分子层面和方药反证的角度进一步提示,本研究所建立的模型为脾胃虚寒型GU病证结合实验模型。
基于本文所有实验结果,脾胃虚寒型GU病证结合大鼠模型成功的标准,可概况为大鼠的总体活动状态、局部外观改变(舌象、鼻唇、耳廓、爪趾)、一般体征(体质量、进食量、饮水量、肛温)均符合脾胃虚寒证候的特征;肉眼观察胃黏膜可见明显的溃疡损伤,HE染色检测胃黏膜呈现明显病理改变;胃黏膜组织保护因子(PGE、NO)含量降低,攻击因子(MDA)含量增加;抑制胃黏膜天然免疫的信号分子TLR-2/MyD88表达显著上调。综上所述,本研究建立了一种可靠、稳定、重现性好的脾胃虚寒型GU大鼠病证结合实验模型。该模型的成功构建可望为溃疡病的中西医结合诊疗提供参考,为中医药在临床治疗溃疡性疾病的推广应用提供科学依据,亦有助于中医药抗溃疡作用机制及新药开发的研究。
