响应面法优化鸡胸肉肌原纤维蛋白抗氧化肽的制备及其二级结构研究
2020-07-17曲金萍陈金玉张坤生任云霞
曲金萍,陈金玉,张坤生,任云霞
(天津商业大学生物技术与食品科学学院天津市食品生物技术重点实验室,天津300134)
鸡肉是一种物美价廉的肉制品,更是人们日常生活中不可或缺的食品。相对于猪肉和牛羊肉来说,鸡肉具有“一高三低”的优势,即高蛋白、低脂肪、低热量、低胆固醇[1]。近年来我国鸡肉产量占肉类总产量的比重持续增高,但从世界范围来看,我国肉鸡行业仍存在较大的发展空间[2]。鸡肉中的肌原纤维蛋白是一类具有重要生物学功能特性的盐溶性结构蛋白群,其约占总蛋白含量的50%~55%,主要由肌球蛋白、肌动蛋白、肌动球蛋白等组成[3]。其作用除了参与肌肉的收缩、影响肌肉的嫩度还与肌肉食品的流变学等特性有着密切的关系[4]。
水解是利用化学法或生物法将大分子蛋白质降解成大小不同的多肽分子以提高蛋白适口性和贮藏稳定性的一种手段[5]。有研究表明,鸡肉蛋白经过酶水解制备的多肽可以有效地改善鸡肉在人体的消化吸收率和总利用率等[6];还有研究表明通过酶解动物蛋白得到了抗氧化活性较好的多肽,Rajapakse等[7]通过酶解大鱿鱼肉制备了具有清除自由基活性的肽,其氨基酸序列为Asn-Ala-Asp-Phe-Gly-Leu-Asn-Gly-Leu-Glu-Gly-Leu-Ala和Asn-Gly-Leu-Glu-Gly-Leu-Lys,且它们的抗氧化活性高于2,6-二叔丁基-4-甲基苯酚;Hattori及Jeom等[8-9]酶解沙丁鱼蛋白、酪蛋白和不溶性弹性蛋白制备了抗氧化活性肽。
本文通过对肌原纤维蛋白酶解,利用响应面法以抗氧化活性为指标,进行抗氧化肽的制备,通过DPPH自由基清除能力、还原能力的测定、ABTS+自由基清除能力以及氧自由基吸收能力(oxygen radical absorption capacity,ORAC)的测定等对筛选结果进行鉴定,进而确定抗氧化活性最高的水解条件;最后通过傅里叶红外光谱法对得到的多肽进行二级结构的鉴定。
1 材料与方法
1.1 材料与仪器
鸡胸肉:天津市红桥区华润万家超市西青道店;牛血清蛋白(bovine serum albumin,BSA)、DPPH:Sigma试剂公司;胃蛋白酶(>3 000 U/mg)、胰蛋白酶(250 U/mg)、碱性蛋白酶(200 U/mg)、ABTS、2,2'-偶氮二异丁基脒二盐酸盐[2,2′-Azobis(2-methylpropionamidine)dihydrochloride,AAPH]、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox):上海麦克林生化科技有限公司;以上化学试剂均为分析纯。
电子天平(A2004A):上海精天仪器有限公司;高速组织匀浆机(PT 2100):宝创科技股份有限公司;高效离心机(Avanti J-E):美国贝克曼库尔特有限公司;比例光束分光光度计(U-5100):日立高新技术公司;实验室pH计(EL20):梅特勒-托利多仪器有限公司;傅里叶红外光谱仪(Nicolet):美国尼高力仪器公司;酶标仪(Spark-10M):帝肯上海贸易有限公司。
1.2 试验方法
1.2.1 预处理及(myofibrillar protein,MP)提取
参照Peak等[10]和Zhang等[11]的方法并改进,鸡胸肉剔除可见的脂肪结缔组织,用刀斩碎成肉糜,加入4倍体积的蛋白提取液(0.1 mol/L NaCl、0.002 mol/L MgCl2、0.001 mol/L EDTA·2Na、0.1 mol/L NaH2PO4/Na2HPO4pH=7.0),均质 25s,高速冷冻离心(5000r/min、15min、4 ℃),弃上清液留沉淀,再加入蛋白提取液重复上述操作两次得粗蛋白,将所得粗蛋白与4倍体积的0.1 mol/L NaCl溶液混合,用均质机高速匀浆20 s,高速冷冻离心(5 000 r/min、15 min、4℃),弃上清液留沉淀,再加入上述NaCl溶液重复上述操作两次,最后所得膏状沉淀即为鸡胸肉MP,提取的MP保存于4℃,并于24 h内用完。
1.2.2 抗氧化肽制备工艺流程
称取肌原纤维蛋白10 g→溶于100 mL 0.5 mol/L NaCl溶液,匀浆30 s→调节pH值→加入一定量酶→恒温水浴锅酶解→沸水浴灭酶→冷却至室温25℃→8 000 r/min 4℃离心15 min→取上清液→真空冷冻干燥→-20℃保存备用。
1.2.3 水解酶的选择
分别采用胃蛋白酶、胰蛋白酶和碱性蛋白酶对提取的肌原纤维蛋白进行酶解,调节酶解条件至各酶的最适条件,以抗氧化活性为检测指标筛选最适用酶。
1.3 单因素试验
1.3.1 pH值对酶解产物抗氧化活性的影响
采取控制变量法进行单因素试验设计。以1.2.3中筛选的最适酶进行水解,加酶量为酶∶底物1∶50(质量比),调节反应体系pH值分别为2、2.25、2.5、2.75、3,各反应体系的水解温度为最适酶所需温度,水解时间为4 h,对所得的多肽进行抗氧化活性分析。
1.3.2 温度对酶解产物抗氧化活性的影响
以1.3.1中筛选的最佳pH值酶解条件下,分别调节反应体系的温度为20、30、37.5、45、50℃,对各反应体系进行4 h的酶解,对所得的多肽进行抗氧化活性分析。
1.3.3 水解时间对酶解产物抗氧化活性的影响
以1.3.1和1.3.2中筛选的最优条件对酶解体系进行水解时间的筛选,分别调节水解体系水解时间为1、2、2.5、3、3.5、4 h,对所得的多肽进行抗氧化活性分析。
1.4 响应面试验设计
在单因素试验的基础上,根据Box-Behnken设计原理,以肌原纤维蛋白酶解多肽的抗氧化活性IC50值为响应指标,选取pH值、水解温度和水解时间为响应因子,进行三因素三水平响应面试验设计,确定抗氧化肽制备的最佳工艺条件。试验因素水平表见表1。
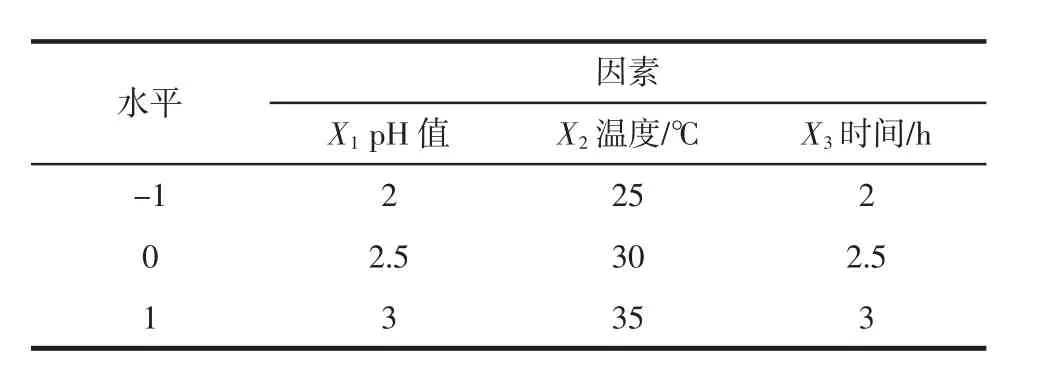
表1 响应面试验因素水平编码表Table 1 Factors and levels of response surface experiment
1.5 抗氧化能力的测定
1.5.1 DPPH自由基清除能力
参考Zheng等[12]的方法并稍作修改以测定DPPH自由基清除能力,取2 mL 0.2 mol/L DPPH乙醇溶液与2 mL样品待测液,混匀避光反应30 min后在517 nm处测吸光度值。空白组选用乙醇代替DPPH乙醇溶液;对照组为无水乙醇代替样品与DPPH乙醇溶液反应。计算公式如下:

式中:A1为试验组的吸光度;A2为空白组的吸光度;A3为对照组的吸光度。
1.5.2 还原能力的测定
取待测样品溶液,加入2.5 mL pH6.6浓度0.01 mol/L的磷酸盐缓冲液和3.0 mL 1%(质量比)铁氰化钾溶液,50℃水浴20 min,加入2.5 mL 10%(质量比)三氯乙酸溶液,3 500 r/min离心10 min,取上清3 mL,再加入蒸馏水3 mL混合后加入0.5 mL 0.1%(质量比)的FeCl3溶液,混匀室温25℃静置15 min,以等量去离子水代替样品溶液调零,在700nm波长下测定吸光度A[13]。
1.5.3 ABTS+自由基清除能力
采用Wang等[14]的方法测定样品清除ABTS+自由基的能力。将10 mL的7 mmol/L ABTS溶液与176 μL的140 mmol/L过硫酸钾溶液在室温25℃下避光反应16 h,形成ABTS+自由基储备液,室温25℃避光保存。使用前用无水乙醇稀释成在室温25℃、734 nm波长下的吸光度值为0.70±0.05的工作液。分别取不同浓度的样品0.2 mL于试管中,加入3.8 mL的ABTS工作液,室温25℃避光反应6 min后,立即于734 nm处测定吸光值。清除率计算公式为:

式中:A0、AI、AJ分别表示未加样品的 ABTS 溶液吸光值、样品与ABTS溶液反应后的吸光值和样品自身的吸光值。
1.5.4 氧自由基吸收能力(ORAC)的测定
参考Huang等[15]的方法,配置浓度为75 mmol/L的磷酸盐缓冲液(pH 7.4)1L,备用。取荧光素钠80 mg,用磷酸盐缓冲液定容到50 mL,作为母液。取其1 mL,继续用磷酸盐缓冲液定容到50 mL,终浓度为8×10-5mmol/L。取414 mg的AAPH,用磷酸盐缓冲液定容到10 mL,终浓度为153 mmol/L,需现配现用,避光保存。制备 100、50、25、12.5、6.25 μmol/L 的 Trolox 标准液。待测样品的浓度为 10、25、50、100、200 μg/mL。取50 μL 的待测液、100 μL 的荧光素钠溶液和 50 μL 的AAPH溶液,放置于四面不透光,仅底部透光的96孔板中。在37℃、485 nm激发波长、530 nm发射波长条件下,每隔3 min检测一次荧光强度减弱的情况,共持续120 min,绘制出时间和荧光强度变化的曲线。荧光衰退曲线下的净面积(area under curve,AUC)采用近似积分法计算,如下:

式中:空白组以蒸馏水代替样品;f0和fi分别代表0 min和i min时的荧光强度。
1.6 二级结构的测定
根据史晓霞等[16]的方法用红外光谱仪测定样品的二级结构,具体操作如下:冻干样品与光谱纯KBr按质量比范围为1∶50~1∶200置于玛瑙研钵中研磨混合成细粉,混合均匀后于压模器加压制成近透明的圆形晶片,然后打开EZ OMNIC软件进行扫描,参数扫描波长范围为 400 cm-1~4 000 cm-1、分辨率 0.09 cm-1、扫描16次。将采集后的样品谱图在EZ OMNIC软件中傅里叶去卷积后经Peakfit V4.12软件进行二阶求导,经多次曲线拟合后使残差值最小,确定各子峰与二级结构的对应关系后(酰胺Ⅰ带中:波数范围1 610 cm-1~1 640 cm-1为特征 β-折叠;1 640 cm-1~1 650 cm-1为特征无规则卷曲;1 650 cm-1~1 658 cm-1为特征 α-螺旋的含量,1 660 cm-1~1 700 cm-1为特征β-转角[17-18]),可根据其积分面积计算各二级结构的相对百分含量。
1.7 统计分析
所有试验均重复3次,采用Excel 2007对试验数据计算平均值及标准差,Origin 9.0对数据进行绘图,采用SPSS(p<0.05)比较平均值之间的差异性并进行差异性分析。
2 结果与分析
2.1 水解酶的选择
不同酶水解产物的抗氧化活性见图1。

图1 不同酶水解产物的抗氧化活性Fig.1 Antioxidant activity of the corresponding products of each enzyme hydrolysis
IC50值表示清除50%自由基所需要的样品浓度,试验中采取DPPH自由基清除率计算IC50值。由图1可见,胃蛋白酶的水解产物IC50值最低,其值为8.69 mg/mL;碱性蛋白酶的IC50值最高为17.73 mg/mL。IC50值越低说明其自由基清除能力越好,越高则相反。胃蛋白酶的DPPH自由基清除能力要优于另外两种酶,可能的原因是每种酶的切割位点不同,导致水解后产生多肽的氨基酸序列不同。胃蛋白酶作用于肽键两端是芳香族氨基酸的肽键[6],使产生的多肽两端带有芳香族氨基酸,可能这种芳香族氨基酸在抗氧化方面具有明显的优势。
2.2 单因素试验
2.2.1 pH值的确定
不同pH值水解产物的抗氧化活性见图2。

图2 不同pH值对水解产物抗氧化活性的影响Fig.2 Effect of different pH value on antioxidant activity of hydrolysate
由图2可以看出,当pH值为2.5时肌原纤维蛋白水解物的IC50值最低,为4.981 mg/mL,即pH值为2.5时清除50%DPPH所需的样品浓度最低,说明其抗氧化活性最好。反应pH值由2升至3.5时出现了先增大后降低而后又升高的趋势。可能的原因是在pH值从2到2.25的过程中,还未达到胃蛋白酶的最适pH值使其不能最大限度水解,致使反应产物的抗氧化活性较低;而pH2.5时反应产物具有最高的抗氧化活性,可能是胃蛋白酶在该pH值时的活性最高,从而使酶解反应进行较顺利;在pH值高于2.5以后,由于反应体系酸度不够使酶的活性受到影响导致反应不能完全进行从而影响产物的抗氧化活性。pH值的改变会使酶和底物的解离状态以及酶的活性中心的构象受到影响,影响最终水解产物的抗氧化活性[19]。
2.2.2 温度的确定
不同温度水解产物的抗氧化活性见图3。
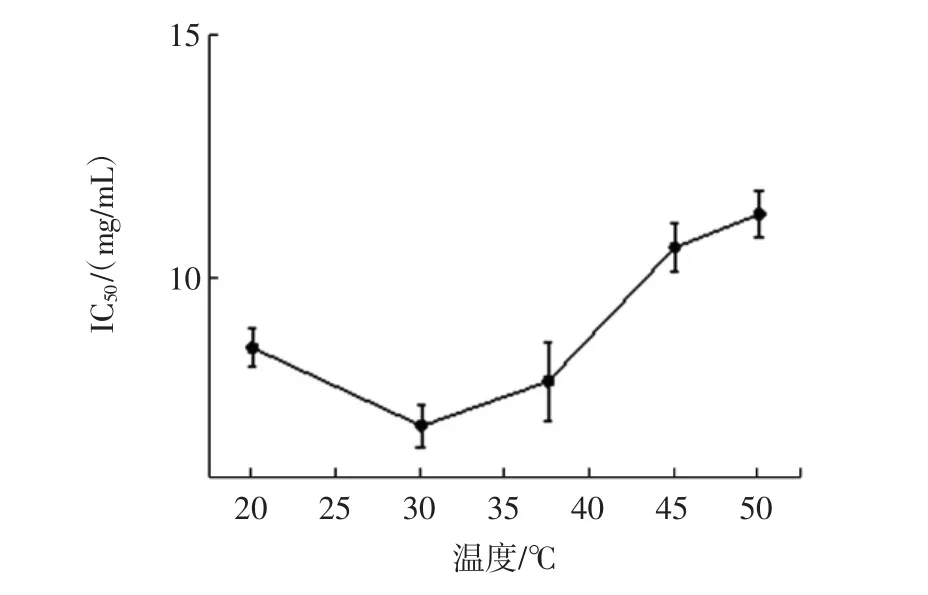
图3 不同温度对水解产物抗氧化活性的影响Fig.3 Effect of different temperature on antioxidant activity of hydrolysate
温度对于酶解反应也是一个比较重要的因素,可以直接影响反应能否顺利进行。由图3可以看出,水解产物的IC50值随着温度升高的过程中呈现先降低后升高的趋势,这表明水解产物的DPPH自由基清除能力先升高后降低,即产物的抗氧化活性先升高后降低。这可能是因为30℃是胃蛋白酶的最适酶解温度(IC50值为7.044 mg/mL),在该值时胃蛋白酶可以发挥最大的活力,从而使水解反应较完全进行,使底物最大限度的酶解,在20℃~30℃过程中,体系温度逐渐靠近胃蛋白酶的最适温度,从而使酶能最大限度的发挥活力;在30℃以后的升温过程中由于温度升高使酶的活力受到影响,不能更好的与底物反应,导致产物的抗氧化活性受到影响[20]。
2.2.3 时间的确定
不同时间水解产物的抗氧化活性见图4。

图4 不同时间对水解产物抗氧化活性的影响Fig.4 Effect of different time on antioxidant activity of hydrolysate
由图4可知,在水解时间为2.5 h时反应产物的IC50值最低为13.095 mg/mL,说明水解2.5 h的反应产物抗氧化活性最好。在时间为2 h~4 h的过程中,IC50值表现出先降低后升高的趋势,这可能是因为在2.5 h之前,由于时间较短反应还没有完全完成,部分底物未被完全分解,水解度较低,大量的还原性多肽端点未被水解出,导致酶解反应初期抗氧化活性较低;而2.5 h之后,由于前期酶解反应的顺利进行使大量的产物生成,产物的累积会抑制酶的活力,水解时间过长导致原本产生的某些抗氧化能力强的多肽被进一步水解成更小的肽片段,甚至会水解成一些游离氨基酸,从而导致产物抗氧化能力降低[20-21]。
2.3 响应面试验设计
鸡胸肉肌原纤维蛋白的酶解工艺优化根据Box-Behnken试验设计了17组试验,5组为中心点重复试验。本试验以IC50值作为响应值,利用Design-Expert 8.0.6.1软件对IC50值Y进行多元回归拟合。得到二次多项式拟合方程为:Y=10.96+3.82X1-3.26X2-0.34X3-2.85X1X2-0.48X1X3-0.6X2X3+2.11X12+1.41X22-1.58X32。
响应面试验设计及结果见表2。
回归模型的显著性检验和方差分析见表3。
由表3可知,该模型的F值为13.29,p<0.01,表明模型显著。失拟项的F值为4.41,p=0.092 9>0.05,故失拟项不显著,模型选择合适。回归模型系数R2=0.944 7,矫正决定系数R2Adj=0.873 6,说明回归方程可以较好地描述各因素与响应值之间的真实关系,可以通过该回归方程确定鸡胸肉MP酶解的最佳工艺条件。

表2 Box-Behnken试验设计及结果Table 2 Design and results of the response surface experiments
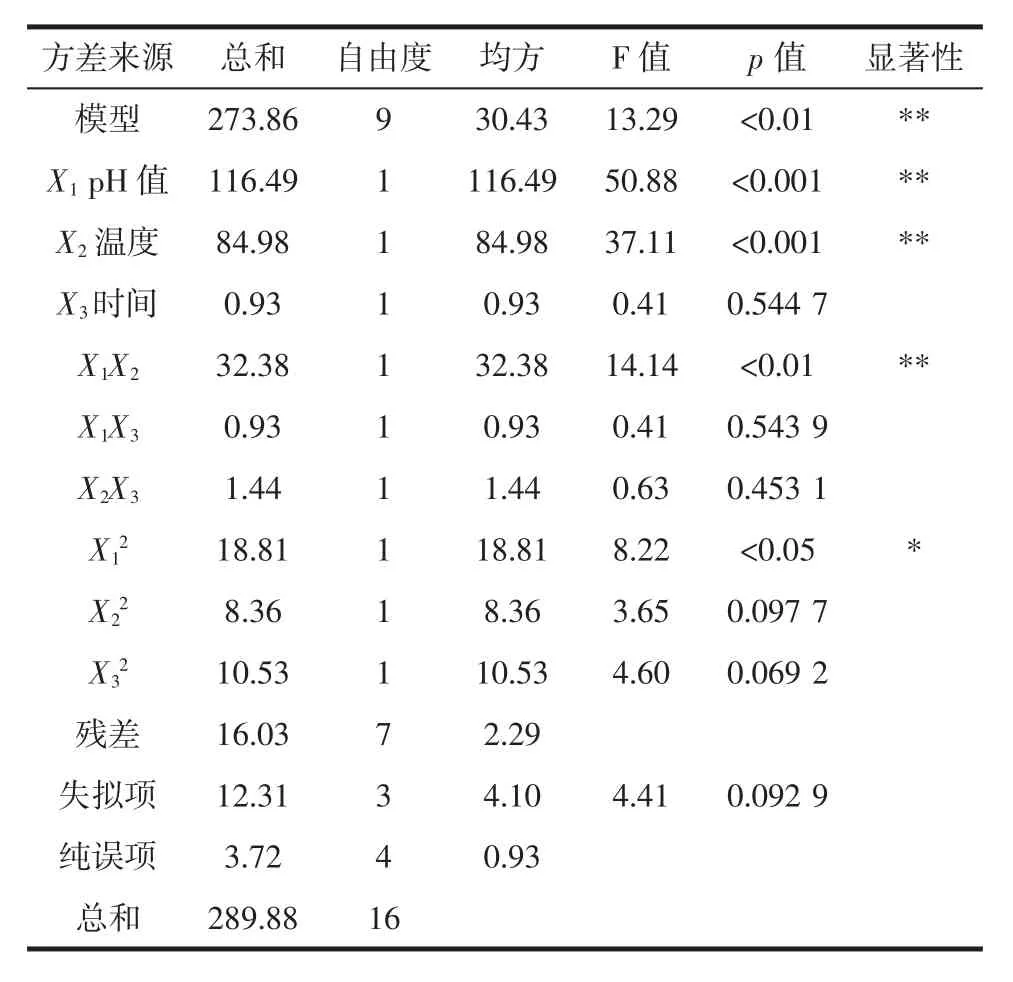
表3 回归模型方差分析表Table 3 Analysis of variance for the fitted quadratic response surface regression model
方差分析表明,pH值和温度对肌原纤维蛋白酶解产物抗氧化活性的影响极显著,时间对酶解产物抗氧化活性的影响不显著,根据各变量显著性检验p值的大小,可以看出肌原纤维蛋白酶解的各因素按影响大小排序依次为pH值>温度>时间。
根据回归方程做出三维曲面图及等高线图,如图5、图 6、图 7 所示。

图5 pH值和温度的响应面和等高线图Fig.5 Responsive surfaces and contour of the combined effects of pH value and temperature

图6 pH值和时间的响应面和等高线图Fig.6 Responsive surfaces and contour of the combined effects of pH value and time
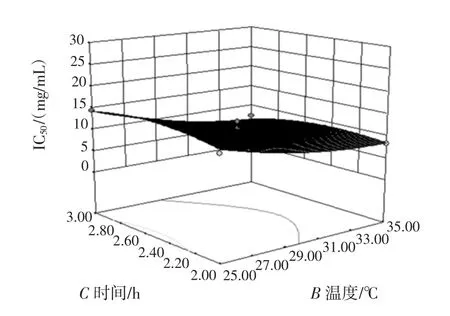
图7 温度和时间的响应面和等高线图Fig.7 Responsive surfaces and contour of the combined effects of temperature and time
在响应曲面图上可以根据图的坡度来反映各酶解因素对IC50值的影响大小。三维曲面的倾斜程度越大说明该因素对指标的影响越显著,反之倾斜度越小则说明对指标的影响越不显著[22]。由图5、图6、图7可以看出,较时间因素而言,pH值和温度的坡度较陡,说明pH值和温度对IC50值的影响较大,而时间对IC50的影响较小,这与前面的回归方程结果相吻合。
2.4 验证试验结果
2.4.1 DPPH自由基清除能力、ABTS+自由基清除能力和还原能力
DPPH自由基清除能力、ABTS+自由基清除能力和还原能力如图8所示。

图8 抗氧化活性Fig.8 Antioxidant activity
由图8可以看出,在响应面最优组合的条件下,样品的DPPH自由基清除能力最高可以达到84.76%,说明清除DPPH自由基效果很好;而还原能力方面最高浓度的样品的吸光度达到0.537,即样品的还原能力也较好;在ABTS+自由基清除率方面,样品浓度最高时ABTS+自由基清除率达到62.17%,通过以上3种试验结果说明在最优组合条件下肌原纤维蛋白水解物的抗氧化活性较好。这也与响应面设计结果相吻合。
2.4.2 氧自由基吸收能力测定
不同Trolox浓度的标准曲线如图9。
不同浓度样品的荧光衰减曲线如图10。

图9 不同浓度Trolox的标准曲线Fig.9 Standard curve line of different concentrations of Trolox

图10 不同浓度样品的荧光衰减曲线Fig.10 Fluorescence decay curves of samples at different concentrations
研究表明ORAC法对抗氧化性的测定特异性较高,且灵敏度、重现性都较好,抗氧化剂作用下的荧光衰减曲线面积与无抗氧化剂(有AAPH)时的荧光衰减曲线下面积之差,即为抗氧化剂的保护面积[23]。图9是不同浓度标准品Trolox的净AUC随时间的变化,从图9可以看出,该线趋势较好,标准曲线方程为y=0.010 1x+0.661 7,相关系数R2=0.992 5,可以较好地反应标准品荧光强度随浓度的变化。图10是不同浓度的样品荧光强度随时间衰减的变化,从图中可以看出,样品浓度越大,其曲线下面积越大,荧光强度衰减的越慢。说明样品的浓度越大,越可以减弱自由基AAPH对荧光素钠的攻击从而保护荧光强度不易减小,即样品浓度越大其抗氧化能力越好[24]。
2.5 抗氧化肽的二级结构分析
抗氧化肽的二级结构分析如图11所示。
在肌原纤维蛋白水解物的红外光谱中1 600 cm-1~1700cm-1的扫描波长范围内为一宽峰,其中1620cm-1~1 700 cm-1的范围为酰胺I谱带位置。经过去卷积处理后,酰胺I谱带可以分出15个峰,再对光谱进行二阶求导、高斯曲线进行谱带拟合,对峰位、峰高、半峰宽等进行曲线拟合,可以确定每个峰的面积,进而求得每种结构的百分比。每个峰信息如表4所示。
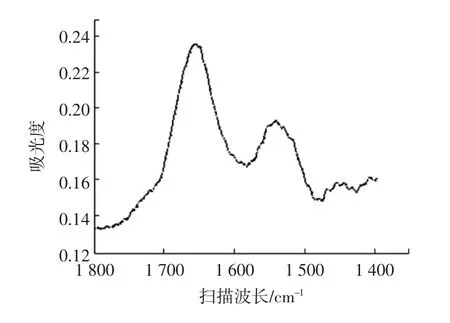
图11 水解产物的红外光谱扫描曲线Fig.11 Infrared spectrum scan curve of hydrolysate

表4 MP水解物酰胺I带峰的位置和相对强度Table 4 Peak positions and relative intensities of the amide I component bands of MP hydrolysate

续表4 MP水解物酰胺I带峰的位置和相对强度Continue table 4 Peak positions and relative intensities of the amide I component bands of MP hydrolysate
本试验采用Peakfit软件对样品红外谱图进行分析,通过分峰处理以及曲线拟合等操作,最终结果显示MP水解物的二级结构分别为α-螺旋占15.36%,β-折叠占20.22%,β-转角占39.03%,无规卷曲占25.39%。
3 结论
本试验以鸡胸肉为原料,对鸡胸肉中提取的肌原纤维蛋白进行酶解,通过筛选水解产物的抗氧化活性从而确定最优酶为胃蛋白酶;研究不同提取条件对水解产物抗氧化活性的影响,在单因素的基础上,通过响应面试验设计,最终确定的最优提取条件为pH2.5、温度35℃、水解时间3 h,该提取条件下DPPH自由基清除率的IC50值为6.674 mg/mL,ABTS+自由基清除率的IC50值为313.276 μg/mL,还原能力样品的最大吸光度为0.537,ORAC试验显示样品的抗氧化能力随样品浓度的增大而增大,且具有较强的抗氧化能力;通过红外光谱可知,MP水解物的出峰位置与蛋白肽的特征峰位置相吻合。因此,本试验以抗氧化活性为指标,通过响应面试验优化制备MP抗氧化肽具有一定的可行性,可以为进一步研究MP抗氧化肽的其他抗氧化活性提供一定的理论依据。
