乙醇浓度对枇杷叶主要功能成分提取效果研究
2020-07-17徐久婷韩晓婷杨培华鲁周民
徐久婷,韩晓婷,杨培华,鲁周民
(西北农林科技大学林学院,陕西咸阳712100)
枇杷[Eriobotrya japonica(Thunb.)Lindl.]是一种观赏树木,属于蔷薇科,四季常绿同时造型美观。我国栽培枇杷至今已有两千多年[1],最早由原生种经过多年进化后形成栽培品种,我国长江以南省份适宜种植枇杷,且有着大面积的种植[2],从营养价值来看,其中所包含的营养成分能够满足人体的多方面需求,具有非常高的医药价值,枇杷的叶、果实、种子以及花等都可以作为药材[3]。枇杷干燥叶是我国一味中药,功效为止咳、消炎[4-5],也可以对全身性荨麻疹、关节炎等疾病治疗[6]。目前已经从枇杷叶中提取出了黄酮、多糖、总酚等化学物质,黄酮具有抗氧化、降血脂、增强免疫力等功效[7-9],多酚则有着抑菌、清除自由基等功效[10-12],多糖有着降血糖以及抗辐射等方面的功效[13-15]。因此,对枇杷叶主要功能成分的开发利用,具有重要的经济和社会效益。
目前,在枇杷叶有效成分的提取中,大多采用某一种乙醇浓度进行提取,多集中于60%、70%浓度的乙醇[5,9,16],而对于不同乙醇浓度条件下提取枇杷叶主要功能成分的效果差异以及对于某种具体成分的提取适宜浓度的研究还未见报道。
本文以水提取作为对照,通过设置不同浓度的乙醇提取液,研究不同乙醇浸提浓度对多糖、总酚、黄酮的提取效果及对抗氧化性指标的影响,探讨乙醇浓度对枇杷叶主要功能成分的提取规律以及适于不同成分的提取浓度,为优化枇杷叶主要功能成分提取方法提供技术参考,从而达到最大的经济和社会效益。
1 材料与方法
1.1 材料与试剂
新鲜成熟枇杷叶:于2018年9月,采自西北农林科技大学南校区的枇杷园。
芦丁标准品、Trolox标准品、二硫代苏糖醇、ABTS、蒽酮标准品、DPPH:上海蓝季生物科技有限公司;福林酚:上海荔达生物科技有限公司;氯化铁、氯化钾、过硫酸钾、氯化钠:国药集团化学试剂公司;没食子酸、碳酸钠、乙醇、氢氧化钠、磷酸二氢钠、磷酸二氢钾:广东光华科技股份有限公司;盐酸、醋酸钠:天津光复精细化工研究所。以上试剂均为分析纯。
1.2 仪器与设备
数控超声波清洗器(KH-500DE型):昆山禾创超声仪器有限公司;粉碎机(JYL-C002E):九阳股份有限公司;双杰系列电子天平(JJ200B):美国双节集团有限公司;电热恒温水浴锅(DK-S24型)、电热恒温鼓风干燥箱(DGG-9140A型):上海森信实验仪器有限公司;医用离心机(H1850):湖南湘仪实验室仪器开发有限公司。
1.3 试验方法
采摘新鲜枇杷叶清洗干净后,在65℃条件下进行烘干,直到质量不再发生变动,然后进行粉碎,使用60目筛过滤,筛后的干粉放置在干燥器内备用。
准确称取8份于65℃条件下烘干样品干粉各0.5g,加入50 mL的离心管内,依次加入浓度分别为30%、40%、50%、60%、70%、80%、90%的 30 mL乙醇溶液,以蒸馏水作为对照,密封摇匀后超声浸提,功率100 Hz、温度30℃,浸泡时间为10 min,并浸提2次经过离心处理后得到上清液,放在-4℃冰箱里作为备用,重复上述3次处理流程。
1.4 指标测定方法
1.4.1 总酚的测定
采用Folin-Ciocalteu方式测定总酚[17-18],在待测液中提取0.1 mL溶液放入25 mL具塞试管,加入水稀释到1 mL,再添加20%1.5 mL的Na2CO3溶液与0.5 mL的福林酚溶液,定容到15 mL,充分摇匀静置1 h,放置在760 nm处对吸光值测量。
选择的标准品为没食子酸,绘制在0~0.012 mg/mL区间内的标准曲线,求得线性回归方程,为y=74.679x+0.010 5,R2=0.999 2。
1.4.2 多糖的测定
采用蒽酮比色法[19]测定多糖含量,取出0.1 mL的待测样品并加入到试管中,并加入蒽酮显色剂5 mL,然后进行沸水浴,持续10 min的时间将其冷却,并置于625 nm测定吸光值。
处于0~0.12 mg/mL区间内,选取葡萄糖溶液标准品,然后进行标准曲线的绘制。根据上述操作测定吸光值,回归方程为y=7.617 9x+0.018 6,R2=0.997 5。
1.4.3 黄酮的测定
黄酮的测定采用NaNO2-Al(NO3)3法[20-23],取400μL样品浸提液,取已经两倍稀释的溶液200 μL,将其加入试管,之后则在试管中加入NaNO2溶液600 μL,摇匀,并静置5 min,之后取Al(NO3)3溶液600 μL加入试管,然后静置6 min,取4%的NaOH溶液1.8 mL,并在加入后静置15 min,在进行吸光值测量时,以510 nm为测定位置来测定。
以芦丁为标准品,选定0~2.0 mg/mL范围,并进行标准曲线的绘制。就能够得到对应的线性回归方程,可表示为 y=0.394 7x+0.011 4,R2=0.993 3。
1.4.4 DPPH法测自由基清除能力
DPPH法测自由基清除能力参照文献[1,24-26],调整用量后取0.1 mL已稀释10倍的样品浸提液,加入无水乙醇使之达到4 mL,选择DPPH溶液,测定其浓度为0.1 mmol/L,摇匀后避光0.5 h进行化学反应,选择在510 nm处进行测定其吸光值(A1)。然后测定0.1 mL溶液与4 mL DPPH溶液混合液的吸光值(A0),对其清除率(K)以下列公式来计算得到:
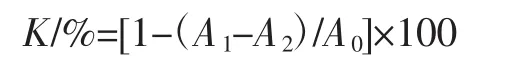
选择0~800 μmol/mL的浓度Trolox溶液作为本试验的标准品,进行标准曲线的绘制。最终计算得到了以下的线性回归方程:y=0.000 6x+0.005,R2=0.998 9。
1.4.5 FRAP法测总还原力
FRAP法测总还原力参照文献[27],取600 μL稀释100倍后样品浸提液于试管中,添加4.5 mL的FRAP工作液,升高温度至37℃,工作液中有着三类溶液,分别为 10 mmol/LTPTZ、20 mmmol/L FeCl3和醋酸盐缓冲液300 mmol,其体积比为1∶1∶10,将混合液放在37℃的环境下,维持10 min的反应时间,在593 nm处进行其吸光值的测定。
选择标准品为Trolox溶液,选取浓度在0~400 μmol/L区间内绘制相应标准曲线,即可得到线性回归方程,表示为y=0.003 8x+0.048 6,R2=0.993 6。
1.4.6 ABTS法测定自由基清除能力
以ABTS法进行测定自由基的清除能力[25,27-28],稍加改动使用量,取出相同体积的2.45 mmol/L K2S2O8溶液与7 mmol/L的ABTS溶液,相互反应12 h~16 h后即可获得ABTS+储备液,使用10 mmol/L磷酸缓冲盐溶液对其稀释40倍后得到ABTS+反应液,并在734 nm处对吸光值(A0)测量。提取100 μL样品浸提液,将其浓度稀释100倍后放置在试管内,然后将ABTS+反应液3.9 mL加入其中,并置于37℃的水浴环境下,维持10 min,选择在734 nm处进行对应的吸光值(A1)的测定。采用下列公式求解ABTS+·清除率(K)值:

选择的标准品溶液为Trolox,并绘制浓度为0~800 μmol/L区间内的标准曲线。得到线性回归方程为y=0.000 9x-0.012 1,R2=0.996 7。
1.5 数据统计分析
通过Excel2010与SPSS23.0进行统计分析、相关性分析以及差异性分析已提取的数据。
2 结果与分析
2.1 乙醇浓度对主要功能指标影响分析
2.1.1 总酚含量随乙醇浓度变化分析
通过不同乙醇浓度对总酚的提取效果研究,结果见图1。
随着乙醇浓度的增加,总酚含量呈现先上升后下降的趋势,在乙醇浓度50%时达到最大值,提取含量为(0.004 5±5.57×10-5)mg/mL,结果显示与其他组相比较高(P<0.05)。70%乙醇浸提液中总酚量小于50%浸提液含量,为(0.003 8±2.89×10-5)mg/mL,对照组水提取的总酚含量最低,为(0.001 7±8.78×10-5)mg/mL。
2.1.2 多糖含量随乙醇浓度变化分析
多糖含量随乙醇浓度变化见图2。
在提取液中,多糖含量随着乙醇浓度的增加呈先升高后下降的变化趋势,与总酚含量变化大致相同。在乙醇浓度为50%的浸提液多糖含量最高,达(0.046±4.97×10-4)mg/mL,显著高于其他组(P<0.05)。而水提取的多糖含量最小,为(0.019±7.91×10-4)mg/mL。
2.1.3 黄酮含量随乙醇浓度变化分析
图3表示改变乙醇浓度后,提取液内黄酮含量变化趋势。
由图3可得,乙醇浓度升高后黄酮含量变化趋势出现先增加然后降低,70%浓度乙醇浸提效果为最高水平,含量为(0.859±0.004)mg/mL,50%处的含量为(0.809±0.008)mg/mL,二者差异显著且均高于其他组(P<0.05)。
2.2 乙醇浓度对抗氧化性能指标影响分析
2.2.1 DPPH自由基清除率随乙醇浓度变化分析
通过不同乙醇浓度对DPPH法测自由基清除率效果研究,结果见图4。
随着乙醇浓度的增加,自由基清除率呈现先上升后下降的趋势,70%浓度的乙醇浸提液自由基清除率最高,为(18.77±0.22)%,显著高于其他组(P<0.05),即70%乙醇浸提液抗氧化性能最强。水浸提液的抗氧化性能最差,自由基清除率为(5.84±1.22)%。
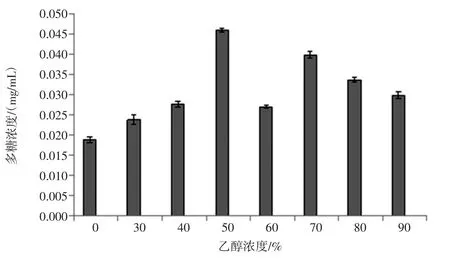
图2 多糖含量随乙醇浓度变化Fig.2 Polysaccharide content changes with ethanol concentration

图3 黄酮含量随乙醇浓度变化Fig.3 Flavonoid content changes with ethanol concentration
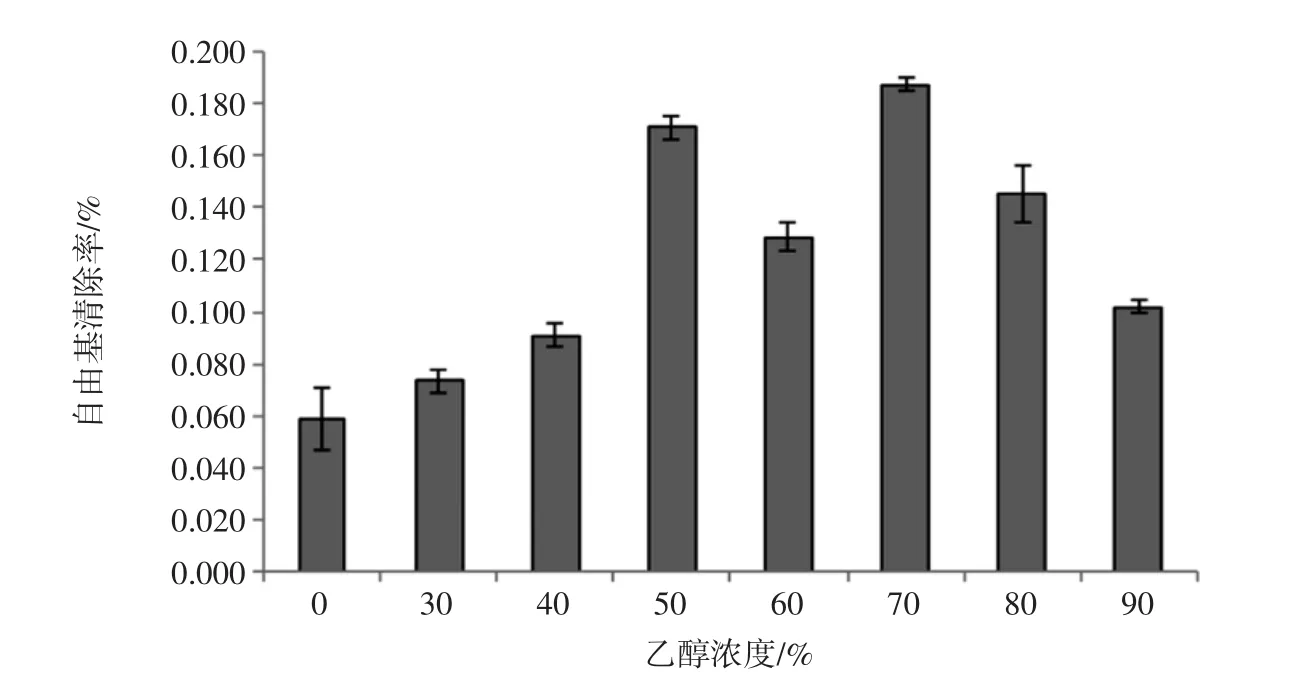
图4 DPPH法测定自由基清除率随乙醇浓度变化Fig.4 Free radical scavenging rate changes with ethanol concentration by DPPH method
2.2.2 FRAP法测抗氧化活性随乙醇浓度变化分析
FRAP法测定的抗氧化活性用Torlox含量表示,具体结果见图5。
由图5可得,水浸出液抗氧化活性最低,为(50.632±3.974)μmolTEAC/g,随着乙醇浓度的增加抗氧化活性呈先上升后下降的趋势,在50%处达到最大值,为(301.684±6.381)μmolTEAC/g,70%乙醇浸出液抗氧化活性稍低于 50%,含量为(239.053±9.604)μmolTEAC/g,二者差异显著(P<0.05)。
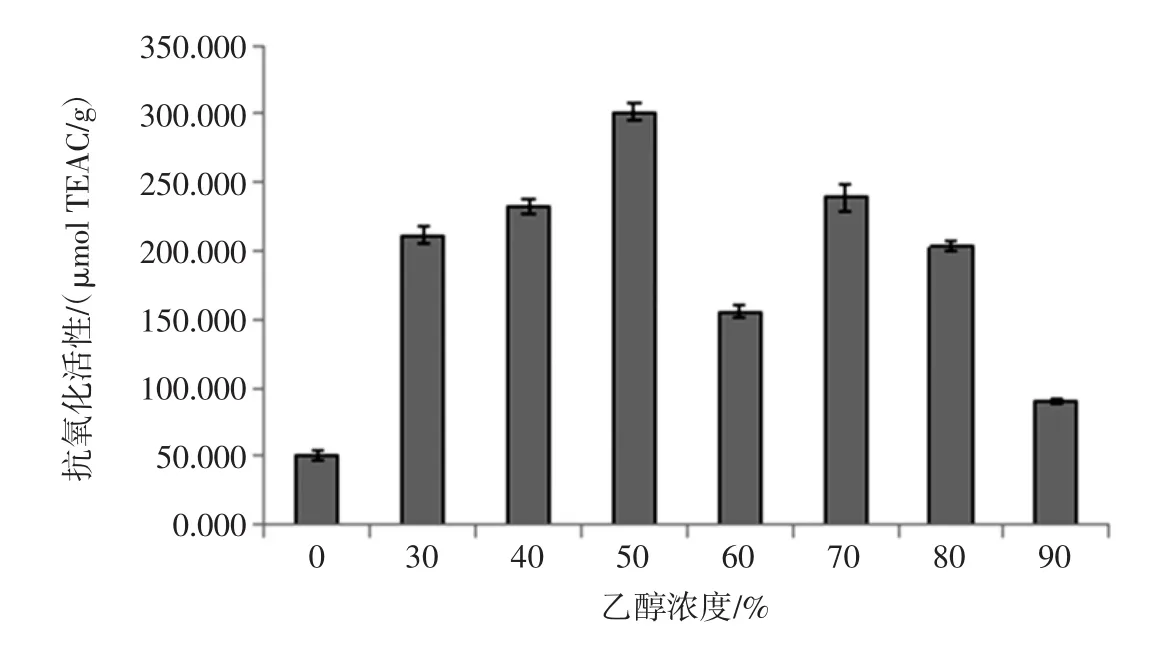
图5 FRAP法测抗氧化活性随乙醇浓度变化Fig.5 Antioxidant activity changes with ethanol concentration by FRAP method
2.2.3 ABTS法测自由基清除率随乙醇浓度变化分析
ABTS法测定自由基清除率随乙醇浓度变化见图6。
从图6中可以看出,ABTS法测定自由基清除率总体趋势与FRAP法测定结果相似,自由基清除率随乙醇浓度呈现先上升后下降的趋势。自由基清除率最大值在50%处,为(8.31±0.51)%,显著高于其他组(P<0.05)。水浸出液抗氧化活性最低,为(3.07±0.45)%。
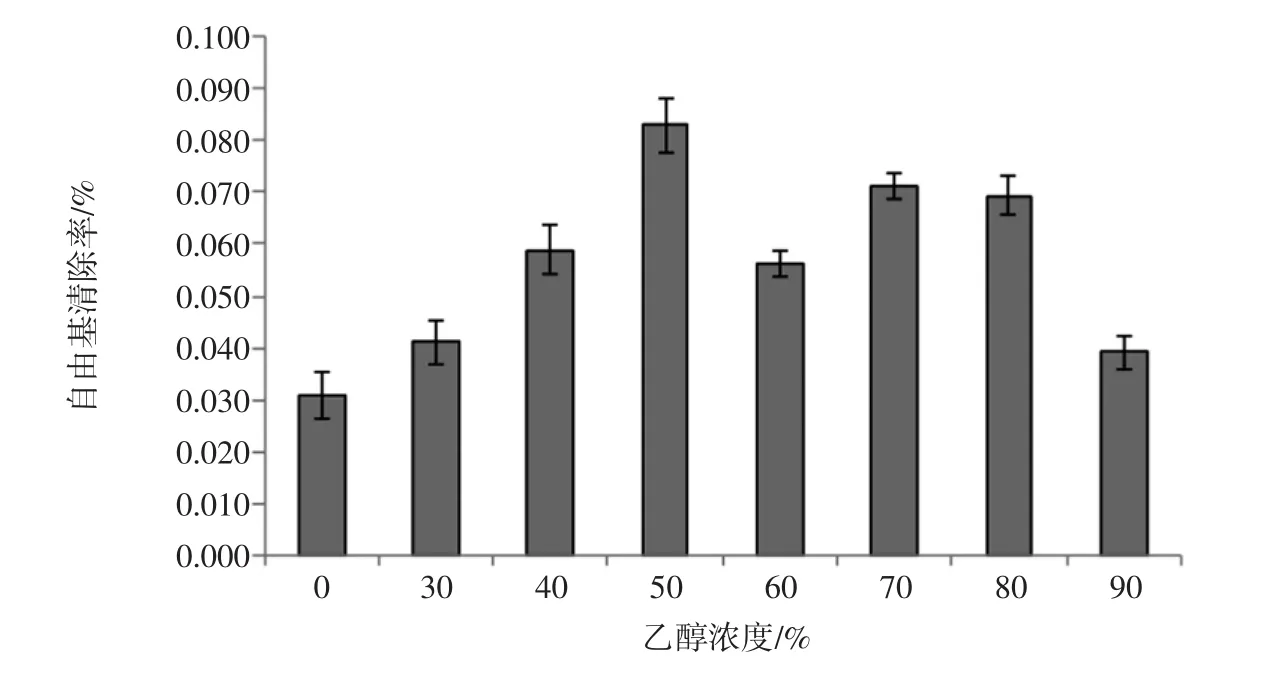
图6 ABTS法测定自由基清除率随乙醇浓度变化Fig.6 Free radical scavenging rate changes with ethanol concentration by ABTS method
2.3 试验指标的相关性分析
表1为试验指标之间的相关性研究,其中主要功能成分含量及抗氧化性能指标的数据均为各平行试验的平均值。

表1 试验指标之间相关性Table 1 Correlation analysis between text indexes
由表1可得,对于同一类指标来说,主要功能成分中,总酚和黄酮含量具有较高的相关性,得出0.893的相关性系数;由抗氧化性能指标分析,ABTS+自由基清除率与DPPH自由基清除率间相关性系数值为0.890;对功能成分比指标与抗氧化性能指标之间的相关性来说,总酚含量与ABTS抗氧化活性间相关性较高,得出相关系数为0.963,多糖含量与DPPH自由基清除率、ABTS抗氧化活性均存在一定的相关性,相关系数分别为0.913、0.900。表明总酚、多糖、黄酮均为枇杷叶抗氧化活性的重要成分。
3 结论
对枇杷叶主要功能成分含量的研究中发现,总体上50%和70%乙醇浸提效果最优。其中50%乙醇提取总酚、多糖效果最佳,而70%乙醇提取黄酮含量最多。同样,对枇杷叶抗氧化活性的分析得出,50%乙醇浸提液和70%乙醇浸提液的抗氧化性能较好。采用DPPH法测自由基清除率时,70%乙醇提取液抗氧化性能最佳,而采用ABTS法与FRAP法时,50%乙醇提取液较佳。因此,提取应用的成分为多糖与总酚时,选取的溶剂为50%乙醇,该浓度溶液提取效果最佳,且投入成本最低。选取黄酮当作提取应用的成分时,提取效果最好的乙醇浓度为70%。试验研究中,采用60%乙醇浓度的提取结果都表现不佳,对这一结果原因,还需要进一步深入研究。
分析与研究枇杷叶黄酮、总酚、多糖含量与抗氧化活性间的相关性可得,黄酮、多糖含量以及总酚与抗氧化活性间表现出一定相关性,结果显示黄酮、总酚和多糖均具有抗氧化性能,与吴媛琳等研究结果相似[5],其中多糖与抗氧化活性的相关性最高。在实际生产中为枇杷叶资源化利用提供理论指导,成为后期研究枇杷叶的关键。
