多因素所致IgA肾病模型大鼠血清炎症因子水平和肾组织免疫相关蛋白表达的变化
2020-07-17刘剑刚崔瑞昭徐羽柔苏庆民
刘剑刚 崔瑞昭 徐羽柔 苏庆民
100091 北京,中国中医科学院西苑医院/国家中医心血管病临床医学研究中心(刘剑刚,崔瑞昭);300270 天津,天津医科大学临床医学院(徐羽柔);100700 北京,中国中医科学院中医药发展研究中心(崔瑞昭,苏庆民)
IgA肾病(IgA nephropathy,IgAN)的发病原因有免疫、遗传、基因和环境等多种因素,其病理机制是以肾小球系膜免疫球蛋白A(immunoglobulin A,IgA)为主的免疫复合物沉淀和肾小球系膜增生为主要病理特征的一种常见原发性肾小球疾病[1]。其临床表现主要为血尿,可伴有不同程度的蛋白尿、高血压和肾功能受损,是导致终末期肾病的常见原发性肾小球疾病之一。IgAN的发病原因及机制目前仍不十分明确,治疗上仍无法从根本上阻止IgA沉积或将IgA移出系膜区[2]。
美国肾脏病基金会管理下的改善全球肾脏病预后组织(Kidney Disease:Improving Global Outcomes,KDIGO)协会推荐的临床治疗指南,强调采用控制血压、减少尿蛋白、强化免疫抑制治疗的方案对IgAN的患者进行干预[3],可见免疫损伤、尿蛋白和血压波动仍是目前治疗的靶点。因此,国内外学者大多采用免疫诱导结合继发性病变的方法多因素制作IgAN动物模型,模拟人类IgAN的发病特点。应用口服牛血清白蛋白(bovine serum albumin,BSA)+注射脂多糖(lipopolysaccharide,LPS)+皮下注射蓖麻油和四氯化碳(carbon tetrachloride,CCl4)多因素方法建立的实验性大鼠模型是目前较为成熟且应用广泛的IgAN模型。现有文献对IgAN模型大鼠肾组织的病理结构、炎症因子和肾功能演变规律的进行了较多研究,但对于IgA沉积于肾小球的荧光表达和肾脏组织中炎症表达的研究较少[4],本文从肾脏转化生长因子β1(transforming growth factor-β1,TGF-β1)和T细胞免疫球蛋白黏蛋白-1(T cell immune globulin sticky protein 1,TIM-1)相关蛋白表达,探讨IgAN的炎症免疫机制,为临床药物应用提供治疗依据。
材料与方法
一、实验动物与试剂
1.实验动物 健康SPF级Sprague-Dauley(SD)大鼠,20只,雄性,体质量160~180 g,购于斯贝福(北京)生物技术有限公司,动物合格证:SCXK(京)2015-0015,质量合格证号:NO.11401500017003。饲养于中国中医医科学院西苑医院屏障系统环境动物室,温度控制在24~26 ℃,相对湿度55%~75%,以标准饲料喂养,动物自由摄食及饮水,适应性喂养后7 d进行实验。
2.实验试剂与药品 牛血清白蛋白(bovine serum albumin,BSA/V组分)(批号:20181022A)购于北京克尔慧科技有限公司;LPS(批号:181102N)购于默克生命科学(Sigma,上海)有限公司;蓖麻油(化学纯)(批号:2018091212)购于北京化工厂;N-乙酰-β-D-氨基葡萄糖苷酶(N-acetyl-β-D-glucosaminidase,NAG)试剂盒(批号:20181112)购于南京建成生物工程研究所;β2-微球蛋白ELISA试剂盒(批号:20181102)购于北京华英生物技术研究所;α1微球蛋白ELISA试剂盒(批号:20181106)购于北京华英生物技术研究所;白细胞介素-4(interleukin-4,IL-4)ELISA试剂盒(批号:20180910)、白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒(批号:20180816)、干扰素-γ(interferon-γ,IFN-γ)ELISA试剂盒(批号:20180709)购于北京欣博盛生物科技有限公司。TGF-β1抗体、TIM-1抗体购于艾博抗(Abcam,上海)贸易有限公司。
二、方法
1.模型制备及分组 将20只大鼠采用随机数字表分为模型组和空白对照组。其中,模型组参照高明等[5]造模方法进行改良,采用“BSA+LPS+CCl4”复合法制作实验性IgAN大鼠模型。从实验开始之日起,模型组大鼠予以BSA溶液(400 mg/kg,1 mL/100g)隔日灌胃,持续6周,皮下注射蓖麻油0.5 mL+四氯化碳溶液0.1 mL,每周1次,持续9周,并联合运用LPS溶液(0.05 mg/只),分别于第6、8周尾静脉注射,共2次,造模时间为10周。空白对照组,从实验开始之日起,以4 mL/kg纯化水隔天灌胃,共持续8周;皮下注射0.9%氯化钠溶液0.4 mL/只,每周1次,持续9周,于第6、8周尾静脉注射0.9%氯化钠溶液0.2 mL/只,持续时间为10周。第10周末,大鼠空腹12 h(正常饮水),腹腔麻醉(4%水合氯醛,0.9 mL/100g体质量,)腹主动脉取血,然后取大鼠肾组织做病理检测及免疫组化检测,按照实验动物伦理要求进行安死术,实验过程符合国家动物福利伦理规范和北京市实验动物伦理规定的要求。
2.标本采集及检测
(1)尿液样本采集及检测:在实验开始和第10周末,将两组大鼠分别放入代谢笼中,收集实验大鼠24 h尿液,记录24 h尿量,收集后取适量(约10 mL)待检。第10周末采用免疫比浊法检测尿微量白蛋白(micro-albumin,mALB),采用免疫比浊法检测24 h尿蛋白。
(2)血清样本采集及检测:第10周末,两组大鼠禁食不禁水12 h,腹腔麻醉后腹主动脉采血,将血液注入真空管中,室温放置一段时间后,采用低温离心机3 000 r/min,离心15 min(3-18G型高速冷冻离心机,SIGMA(美国)公司生产),取上清液,分为3份,置于-70 ℃冰箱保存,待测。
(3)肝肾功能检测:应用比色法(A6型半自动生化仪,北京松上技术有限公司)进行检测血清NAG含量;采用ELISA法(DR-200BS型全自动酶标分析仪,无锡华卫德朗仪器有限公司)测定血清β2-微球蛋白(β2-microglobulin,β2-MG)和α1-微球蛋白(α1-microglobulin,α1-MG)含量。
(4)细胞因子检测:采用ELISA法测定血清中IL-4、IL-6、IFN-γ含量。
(5)免疫指标检测:用比色法测定血清中IgA含量,IgA与相应特异性抗体在溶液中反应,形成的抗原-抗体复合物,并产生一定的浊度,根据浊度高低和血清中IgA的水平成正比的原理进行测定。
(6)肾组织病理检测:麻醉后的大鼠取双肾组织,分别置于液氮罐中(左肾5只)转存于-70 ℃冰箱和10%多聚甲醛固定液中(右肾5只)做冰冻切片(LEICA AUTO STAINER-XL型自动染色封片工作站,徕卡(LEICA)显微系统(上海)贸易有限公司)和石蜡切片(RM2245型半自动石蜡切片机,徕卡(LEICA)显微系统(上海)贸易有限公司),进行IgA免疫荧光检测和HE染色病理组织检测。
对肾组织IgA免疫荧光进行检测。冰冻切片(30 μm),常规操作,然后一抗(IgA抗体)4 ℃孵育,PBS缓冲液3次冲洗,荧光二抗37 ℃孵育,30 min,PBS缓冲液3次冲洗,二氨基联苯胺(DAB)显色,10 min,使用含有异硫氰酸(fluorescein isothiocyanate,FITC)荧光剂的封片剂封片,荧光显微镜读片。免疫荧光强度分级半定量标准参照文献[4]中的5级法:低倍镜(BH-2型,日本OLYMPUS株式会社生产)下不能显示,高倍镜下似乎可见,为-;低倍镜下似乎可见,高倍镜下可见,为+;低倍镜下可见,高倍镜下清晰可见,为++;低倍镜下清晰可见,高倍镜下耀眼,为+++;高倍镜下刺眼,为++++。
(7)肾脏组织TGF-β1、TIM-1表达的检测:免疫组织化学染色,石蜡切片(5 μm),常规操作,然后直接滴加一抗,依据预实验确定的浓度(TGF-β1为1∶500,TIM-1为1∶800)滴加,4 ℃过夜。滴加二抗生物素化山羊抗小鼠IgG,37 ℃,30 min,滴加SABC复合物,PBS溶液冲洗,封片,显微镜观察。计算机图像采集系统(DP-200型,丹麦DpxView Pro公司生产)观察肾组织免疫组化染色,肾组织免疫组化半定量分析,每个标本切片随机观察至少3个不重叠的视野进行观察(计15个视野),以肾小球内的染色为棕褐色为阳性标志,采用Imagepro-Plus 6.0图像分析系统测定每只大鼠肾脏组的积分光密度(integral opical density,IOD)值,根据累积IOD值的结果进行比较,比较阳性物质的表达量。
三、统计学处理

结 果
一、大鼠一般情况和肾组织病理比较
动物造模后,第6周后出现不同程度的毛色灰暗、不光泽、活动减少、精神萎靡等,提示大鼠自我清洁能力和活动能力减弱。其次出现便溏、体质量略有减轻等,反映大鼠出现应激状态体质减弱。空白组大鼠在整个实验过程中一般状态良好,体质量增长明显,二便正常,且反应灵敏,毛色光泽,活动能力自如。
第10周末,镜下观察,模型组大鼠肾组织的肾小球增生、沉积、肿胀(图1中箭头所示),基底系膜增生和系膜基质增宽,出现了不同程度的系膜细胞和毛细血管内皮细胞增生,且肾小管间质纤维化明显,肾小管萎缩,间质纤维化。空白对照组大鼠的肾小球和肾小管形态结构正常,系膜和基底没有增生,细胞形态和结构正常。(图1)
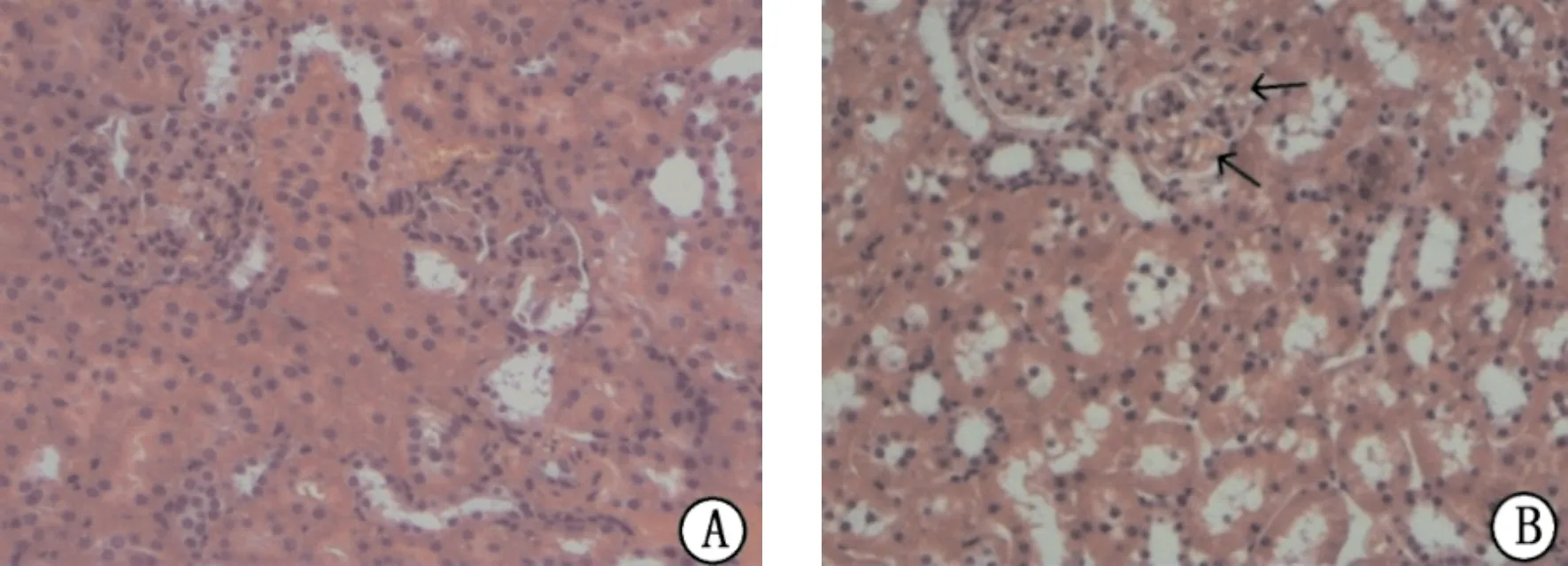
注:A.空白对照组;B.模型组图1 两组大鼠肾组织病理HE染色比较(HE,×150)
二、两组大鼠肾组织IgA免疫荧光比较
多因素造模后,模型组大鼠肾小球IgA荧光染色,可见有团块状或颗粒状绿色荧光,荧光强度(++)~(+++),空白对照组大鼠肾小球组织无荧光反应,IgA免疫荧光极弱(图2)。模型组高荧光强度的大鼠个数显著多于空白对照组(P<0.05)。(表1)

注:A.空白对照组;B.模型组图2 两组大鼠肾组织IgA免疫荧光染色的比较(×400)

表1 两组大鼠肾脏组织IgA免疫荧光染色的比较(只)
注:与空白对照组比较,aP<0.05
三、两组大鼠的尿微量白蛋白和24 h尿蛋白定量比较
大鼠造模第10周末,尿微量白蛋白比较,模型组显著高于空白对照组(P<0.05),24 h尿蛋白定量比较,模型组显著高于空白组(P<0.01)。(表2)

表2 两组大鼠尿微量白蛋白和24 h尿蛋白定量比较
注:与空白对照组比较,aP<0.05,bP<0.01
四、两组大鼠血清NAG、β2-MG和α1-MG含量比较
造模后,与空白对照组比较,模型组大鼠血清NAG、β2-MG、α1-MG均显著升高(均P<0.05)。(表3)

表3 两组大鼠血清的NAG、β2-MG和α1-MG含量比较
注:与空白对照组比较,aP<0.05,bP<0.01
五、两组大鼠血清IFN-γ、IL-4、IL-6水平和IgA含量的比较
造模后,与空白对照组比较,模型组大鼠血清IL-4、IL-6、IgA含量水平显著升高(P<0.05),模型组大鼠血清IFN-γ有一定程度的降低,差异无统计学意义(P>0.05)。(表4)

表4 两组大鼠血清的炎性因子水平和IgA含量的比较
注:与空白对照组比较,aP<0.05
六、两组大鼠肾脏组织中TGF-β1和TIM-1表达比较
造模后,空白对照组大鼠肾小球及基膜组织有少量的TGF-β1和TIM-1阳性表达,大多分布在肾小管上皮细胞上。模型组大鼠肾小球及基膜上TGF-β1和TIM-1的阳性表达明显增加,大多分布在肾小球部位(图3)。与空白对照组比较,模型组TGF-β1和TIM-1的表达均有显著升高(P<0.01)。(表4)

表4 两组肾组织 TGF-β1和TIM-1的免疫组化IOD值比较
注:与空白对照组比较,aP<0.05
讨 论
目前,有关IgAN的发病原因及机制仍不明确,也是目前临床治疗和基础研究面临的重要课题。利用动物模型探索IgAN的发病机制、病情进展及药物干预是研究热点。采用多种因素联合制造IgAN动物模型,仍然是国内学者大多采用的方法,此类方法可以提高动物患病率,减少制作模型的时间,接近人类IgAN的发病特点。早期汤颖等[5]对以往IgAN模型的制作方法进行改良,建立了一种新的造模方法:隔日口服BSA 400 mg/kg,持续6周,皮下注射蓖麻油0.5 mL+四氯化碳溶液0.1 mL,每周1次,持续9周,并分别于第6、8周运用LPS 0.05 mg/只尾静脉注射。陆慧瑜等[6]在汤颖文献的基础上,进一步改良:将隔日口服BSA延长到8周,蓖麻油改为0.3 mL,取消第8周LPS尾静脉注射,此方法考虑到口服免疫原BSA安全,为了增强免疫原性,延长了两周。孙红旭等[17]在前人文献的基础上加以改进,采用口服BSA(600 mg/kg,隔天1次灌胃)+皮下注射蓖麻油0.3 mL+四氯化碳溶液0.10 mL(每周1次持续8周)+LPS尾静脉注射,肾脏病理形态学改变明显,肾组织IgA免疫荧光染色增强,荧光阳性面积和平均光密度值升高。
本课题在多因素造模的基础上加以改进,造模时间延长至10周。结果表明,肾脏组织病理学改变明显,肾组织IgA免疫荧光染色显著增强。IgAN发病的重要因素之一就是多种细胞因子的分泌异常,T细胞亚群分化异常在多种自身免疫疾病发病中被阐明证实。IgAN患者血清和肾组织活检中可检出抗BSA多克隆基因型抗体,因此,口服BSA异体蛋白造成机体免疫系统的损伤,Th1/Th2失衡与IgAN的相关性逐渐被人们所接受,Nogaki等[8]由此提出Th1/Th2失衡与IgA的分泌水平相关,当Th2占据主导地位时,它可以分泌过量的IL-4、IL-6等细胞因子,而且IL-4、IL-6不仅能使Th2过度分化,还同时使B细胞活化,增殖分泌抗体。IFN-γ由Th1分泌,研究表明,IgAN患者中外周血中IFN-γ减少,而IL-4、IL-6升高[9],证实了IgAN患者存在着Th1/Th2失衡向Th2偏倚的现象。本实验的动物模型结果显示,IgAN大鼠中血清中IL-4、IL-6含量升高,IFN-γ含量明显减少。
LPS为细菌壁成分,是一种免疫佐剂,可诱导IgA及C3在肾小球系膜区的沉积,早期研究证实其不易对动物机体造成损害[10-11]。蛋白尿是促进肾脏疾病进展的独立危险因子之一,大量蛋白尿可导致肾小球硬化及肾间质纤维化。本实验大鼠经过造模后出现了蛋白尿,24 h尿蛋白也显著升高。整个实验造模过程中无大鼠死亡,光镜下的肾组织病理显示肾小球系膜基质增生和系膜基质增厚,免疫荧光显示肾小球有较强的IgA沉积。国内文献大多报道的IgAN动物模型制作是否成功,大多以血尿、蛋白尿、血肌酐等指标,结合病理免疫检查为诊断依据,缺少疾病的早期诊断和机制探讨。因此,本研究选用了血清NAG、β2-MG和α1-MG指标早期预测肝肾功能的损伤变化,结果显示IgA模型大鼠这些指标都明显升高,说明在IgAN模型中这些指标的异常更能反映肝肾功能早期的损伤变化。
TGF-β1是调节细胞生长和分化的TGF-β家族蛋白之一,近年来发现TGF-β1对细胞的生长、分化和免疫功能都有重要的调节作用。而TIM-1由Mcintire等[12]在分析人类染色体5q23-35基因与哮喘的易感性时首次发现并命名,1998年,Chimura等[13]又将其命名为肾损伤分子-1(kidney injury molecule-1,KIM-1),因在缺血再灌注大鼠模型中确定该分子的高度表达与肾小管损伤程度相关。近年来,有研究表明TIM-1可调节多种效应性T细胞的表达,影响Th1/Th2细胞的平衡[14],而Th1/Th2失衡,Th0分化向Th2偏倚,在调节Th2中起重要作用。系膜区的IgA1免疫复合物沉积大致通过以下3种机制导致肾损伤[2]:(1)首先是IgA1对系膜细胞的损伤,异常糖基化IgA1免疫复合物被特异性识别后在系膜区沉积后引起促炎症细胞因子,呈现为系膜细胞和系膜基质的增生,肾小管间质炎症细胞浸润,导致肾小管间质纤维化,最终出现肾衰竭;(2)其次是IgAN足细胞损伤机制,系膜细胞与足细胞之间通过细胞因子进行“交互对话”,介导足细胞凋亡的发生,足细胞的凋亡是导致肾脏疾病的重要原因;(3)第三是IgAN肾小管间质损伤机制,IgAN患者系膜细胞产生的TGF-β1通过肾小球滤过和血液运输到肾小管间质,刺激肾小管上皮细胞局部炎症反应并呈现级联式放大,引起肾小管上皮细胞损伤和细胞外基质成分的过度生成,导致纤维化和肾衰竭[15]。本次实验结果显示,IgAN模型大鼠肾组织中TGF-β1表达明显增强,肾小管的TIM-1表达亦显著增加,可能是导致纤维化和肾功能不全的潜在信号。
综上所述,BSA灌胃结合皮下注射蓖麻油与四氯化碳溶液和尾静脉注射LPS多因素所致IgAN大鼠模型能够较好体现IgAN患者的临床和病理体征,血清中NAG、β2-MG和α1-MG的早期检测更能反映肝肾功能的损伤程度,血清中IL-4、IL-6水平升高以及肾组织TGF-β1、TIM-1表达上调提示免疫和炎症参与IgAN发病机制。
