携载FGF2基因的改性壳聚糖微球促进兔桡骨骨缺损修复的研究
2020-07-17陈胤贤蒋健一赵宇孙军
陈胤贤 蒋健一 赵宇 孙军
感染、创伤、肿瘤等造成的大范围骨缺损是临床的一大难题。常见的修复方法,如自体骨移植、异体骨移植、人工材料等,存在创伤大、供体骨有限、费用高等缺点,组织工程技术为解决这一难题提供了新的可能。
碱性成纤维细胞生长因子(FGF2)因可在体外促进BMSCs增殖及成骨分化,被广泛应用于骨缺损研究[1-2]。但是,骨缺损的修复用时较长,局部加入FGF2易被代谢,无法长时间维持生物活性。因此,基因治疗被用于骨缺损修复,而合适的基因载体尤为重要[3-4]。我们的前期工作证实,壳聚糖具有极好的生物相容性和低细胞毒性,且经过改性后制成巯基烷基化壳聚糖(Thiolated N-alkylated chitosan,TACS)和羟丁基壳聚糖(Hydroxylbutyl chitosan,HBC),可先后通过正负电荷作用包裹基因,形成以TACS为核、HBC为壳的纳米粒子,该粒子可在体内缓慢降解,释放目的基因转染细胞表达蛋白,从而发挥生物活性[5]。
本研究旨在探究改性壳聚糖携载FGF2基因在体内促进兔桡骨临界骨缺损愈合过程中的作用,以期为临床骨缺损的修复提供新思路。
1 材料与方法
1.1 实验动物与材料
实验动物:共使用15只3月龄新西兰兔(安徽医科大学动物实验中心),体质量约3.0 Kg,雌雄不限。
实验材料:兔BMSCs(赛业生物科技有限公司); HBC和TACS(中国科学技术大学材料与化学研究实验室馈赠);pFGF2基因过表达载体(上海吉凯基因科技有限公司);质粒大量提取试剂盒(天根生物科技有限公司);DMEM培养基(美国Gibco公司);CCK8试剂(日本同仁公司);PCR试剂盒、引物(上海锐博生物科技有限公司);兔抗兔FGF2抗体、HRP标志的山羊抗兔IgG(美国Sigma公司)。
1.2 HBC@TACS-pFGF2基因载体微球的制备
体外扩增培养基因过表达菌株,用质粒大量提取试剂盒收集菌体提取质粒,Nano Drop2000测定质粒浓度,标记浓度后置于-20 ℃保存。参照前期研究方法,壳聚糖与质粒的氮磷比为20∶1(氮元素代表壳聚糖的相对分子质量,磷元素代表质粒的相对分子质量),在无菌条件下将TACS与pFGF2质粒于PBS缓冲液中混匀、涡旋震荡30 s后室温静置30 min形成TACS-pFGF2,然后再向溶液中加入与TACS等量的HBC,涡旋震荡30 s,混匀后室温静置30 min,制备成HBC@TACS-pFGF2基因载体微球,置于-20 ℃备用[5]。
1.3 HBC@TACS-pFGF2与BMSCs共培养
1.3.1体外转染BMSCs
将BMSCs按5 000个/孔接种于6孔板中,每孔加入2 mL完全培养基,于培养箱中培养过夜,待细胞贴壁后加入质粒含量为5 μg的HBC@TACS-pFGF2基因载体微球,继续培养1、3、7 d后弃去培养基,PBS冲洗2遍后加入RIPA裂解液,冰上30 min裂解细胞,12 000 r/min、4 ℃离心15 min,吸去上清液,提取蛋白。用BCA蛋白定量试剂盒进行蛋白定量,每孔上样量30 μg。转膜后FGF2抗体以1∶1 000进行稀释,孵育过夜,二抗以1∶5 000进行稀释。ECL法曝光获得图像。Image J软件分析条带灰度,以目的蛋白与内参蛋白GAPDH(甘油醛-3-磷酸脱氢酶)的比值判断蛋白表达的相对含量。
1.3.2细胞活力检测
用含10%FBS的DMEM培养基培养兔BMSCs,待细胞融合至80%~90%时进行消化传代,取第3~6代细胞用于实验。
取生长状态良好的细胞进行消化,离心,重悬细胞,调整细胞数目,按2 000个/孔的密度将细胞接种于96孔板,每孔加入100 μL含10%FBS的DMEM完全培养基,37 ℃、5%CO2细胞培养箱中培养过夜,待细胞贴壁后吸去培养基,向孔板中加入含有不同浓度pFGF2质粒(25 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL、300 μg/mL)的HBC@TACS-pFGF2基因载体微球。不加HBC@TACS-pFGF2基因载体微球的孔板设为对照。将细胞继续置于培养箱中培养72 h后吸去培养基,每孔加入100 μL完全培养基和10 μL的CCK8溶液,37 ℃孵育4 h,测量450 nm处吸光度(OD值),计算细胞增殖率。
1.3.3RT-PCR检测成骨相关基因和成血管相关基因的表达
将BMSCs按照5 000个/孔接种于6孔板中,每孔加入2 mL完全培养基,置培养箱培养过夜,待细胞贴壁后加入含HBC@TACS-pFGF2基因载体微球的DMEM,其中pFGF2质粒浓度为100 μg/mL。分别培养3 d、7 d后弃去培养基,PBS冲洗2遍TRIzol裂解细胞,提取RNA。用PrimeScript RT Enzyme Mix I将RNA逆转录合成cDNA。用荧光SYBR Green QPCR Master Mix(TakaRa)进行PCR(表1)。应用Applied Biosystem7300/7500和StepOnePlus Real-Time PCR System 进行实验。PCR反应预变性温度:95 ℃,30 s,1个循环。循环反应温度:95 ℃,5 s;60 ℃,30 s,40个循环。扩增结果用 QuantStudio Real-Time PCR Software进行分析。

表1 实时定量RT-PCT引物Table 1 Quantitative realtime RT-PCR primer sets
1.4 兔桡骨骨缺损修复实验
无菌条件下将明胶海绵切割成18 mm×20 mm大小[6],将pFGF2质粒浓度为100 μg/mL的HBC@TACS-pFGF2缓慢滴加到明胶海绵中。无菌条件下将明胶海绵冻干,防止手术过程中因挤压造成基因载体丢失。将明胶海绵压缩,卷成18 mm长的柱状备用。
新西兰兔麻醉后仰卧位,无菌条件下切开皮肤,暴露桡骨,去除中段包括骨膜在内的长18 mm的桡骨,制备双侧桡骨临界骨缺损模型,左侧植入明胶海绵和HBC@TACS-pFGF2微球(实验组,n=15),右侧不作植入(对照组,n=15)。缝合后消毒包扎,并用3 M软石膏将兔前肢固定。术后分笼饲养,术后3 d皮下注射青霉素防止术后感染。移植术后第4周、8周、12周分别取材,行X线检查、大体观察,骨标本经10%EDTA脱钙后切片,行Masson染色,观察新生骨组织的矿化情况。
1.5 统计方法
2 结果
2.1 Western-blot检测FGF2蛋白表达情况
HBC@TACSpFGF2基因载体微球与BMSCs体外共培养后可成功表达FGF2蛋白,且随时间增长FGF2蛋白的表达水平有增高趋势(图1)。
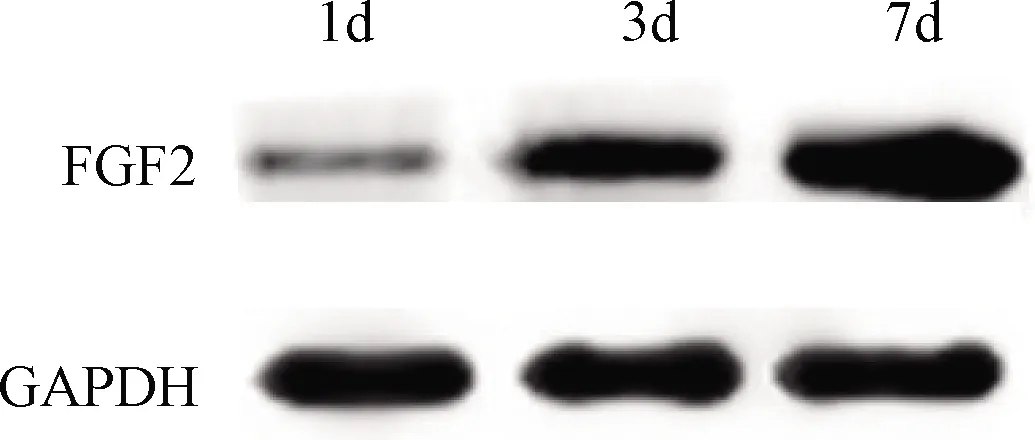
图1 共培养第1、3、7天后western-blot检测FGF2蛋白表达情况Fig. 1 The expression of FGF2 protein detected by western-blot after 1, 3 and 7 days of co-culture
2.2 细胞活力检测
与对照组相比(对照组细胞活性以100%表示),不同TACS@HBC-pFGF2浓度条件下,BMSCs的相对增殖率分别为111.6%±7.59%、136.9%±3.127%、154.2%±5.34%、84.9%±3.20%、14.1%±1.96%。随着pFGF2质粒浓度的提高,BMSCs的增殖率逐渐增高,当pFGF2质粒浓度达到100 μg/mL时细胞增殖率最高,当pFGF2质粒浓度为200 μg/mL、300 μg/mL时细胞增殖率骤降。说明体外培养时适当添加pFGF2质粒可促进BMSCs增殖,但是pFGF2质粒浓度过高可对细胞产生毒性。因此,后续实验选取100 μg/mL作为pFGF2质粒的浓度(图2)。
2.3 ALP mRNA和CD31 mRNA的表达情况
BMSCs在体外与pFGF2质粒浓度为100 μg/mL的TACS@HBC-pFGF2共培养后,其成骨相关基因碱性磷酸酶ALP mRNA和成血管相关基因CD31 mRNA的表达量随时间推移逐渐增高,且在第7天时其表达量与对照组相比具有明显差异(图3)。
2.4 大体标本观察
对照组在第4~8周时缺损断端骨痂形成不明显,缺损长度仍为18 mm,术后第8~12周时对照组的骨缺损断端开始形成较多骨痂,并可见缺损逐渐变小,但是在第12周时骨缺损依旧存在,断端未连续。实验组在第4周时即可观察到明显的骨痂形成并伴有纤维组织将断端连接,在第8周时骨痂已将缺损填充,第12周时骨缺损基本修复,桡骨连续性好(图4)。

图3 HBC@TACS-pFGF2与BMSCs共培养3 d、7 d后ALP mRNA和CD31 mRNA的表达情况 (*: 与对照组相比,P<0.05;**: 与对照组相比,P<0.01)Fig. 3 The levels of ALP mRNA and CD31 mRNA of BMSCs co-cultured with HBC@TACS-pFGF2 for 3 and 7 days (*: compared with control group, P<0.05; **: compared with control group, P<0.01)

A:对照组;B:实验组 A: Control group; B: Experimental group图4 术后不同时间点桡骨标本大体观察Fig. 4 Gross observation of radius at different time points after surgery
2.5 影像学检查
对照组在第4周时未见明显骨痂形成,缺损处由软组织填充,术后第8周时可见骨缺损断端骨痂形成向缺损处延伸,第12周时少量骨痂连续,缺损范围变小,但骨缺损依旧存在。实验组在第4周时即可观察到明显骨痂形成,骨缺损部位已由新生骨痂填充,骨密度明显增高,第8周时骨痂重塑,缺损部位骨痂密度进一步增高,第12周时骨缺损已完全修复,并可见桡骨髓腔已再通(图5)。
2.6 组织学检查
对照组在移植术后第4周、8周、12周时骨缺损未能完成修复,骨缺损断端可见大量蓝染的纤维组织形成,随时间推移,第12周时对照组可见少量新生骨组织矿化。实验组骨缺损部位随时间推移纤维组织逐渐被新生骨组织代替,相较于对照组可见到更多矿化的新生骨,第12周时实验组骨缺损已完全修复,Masson染色可见大片红色深染的已矿化的新生骨组织(图6)。
3 讨论
FGF2可以在体外促进BMSCs的增殖、软骨分化和成骨分化,参与骨组织的形成和重塑[7]。研究证明,10 ng/mL的FGF2可在体外促进BMSCs增殖,并且在共培养7 d后ALP mRNA和Runx2 mRNA的表达显著增高[1-2]。另有研究表明,FGF2对多种参与血管生成的细胞具有很强的促增殖作用。但FGF2的临床应用受到半衰期短、快速稀释和代谢、重复注射的潜在毒性及免疫原性等的限制[3]。因此,我们设想利用基因治疗的方法将FGF2应用于骨缺损修复。基因载体需要满足转染效率高、细胞毒性低等条件[4,8-9]。壳聚糖是广泛存在于自然界中的一种甲壳素脱乙酰基衍生物,具有良好的生物相容性。壳聚糖及各种改性壳聚糖作为药物缓释载体已被广泛研究[10-12]。我们前期研究发现,壳聚糖经化学改性后可作为基因载体,当壳聚糖中的氮元素与基因中的磷元素分子量比值为20∶1时,改性壳聚糖TACS可通过正负电荷作用将基因进行包裹,表面电荷为正电荷,易被细胞内吞进行后续转染[13]。另外,在该结构外面继续包裹与TACS等质量的HBC制成核壳结构后,可以达到缓慢释放TACS-pFGF2粒子进行转染的目的[5]。

A:对照组;B:实验组 A: control group; B: experimental group图5 术后不同时间点桡骨X线图片Fig. 5 X-ray images of radius at different time points after surgery

A:对照组;B:实验组 A: control group; B: experimental group图6 术后不同时间点骨缺损处Masson染色(标尺=100 μm)Fig. 6 Masson staining of the bone defect at different time points after surgery (scale=100 μm)
前期实验中确定了HBC@TACS-pEGFP在体外的释放动力学。在37 ℃的TE缓冲溶液中HBC和TACS缓慢降解生成水和二氧化碳,逐渐释放出pEGFP,在第7天时约15%的pEGFP被释放,第15天时释放率约50%,第30天时释放率约70%[5]。本研究首先选用了低剂量的HBC@TACS-pFGF2在体外与BMSCs共培养,Western-blot证实了共培养后BMSCs可成功表达FGF2蛋白,并且随时间推移蛋白表达量有增高趋势。
细胞毒性实验证实HBC@TACS-pFGF2可在体外促进BMSCs增殖,而且随着pFGF2质粒浓度的提高,BMSCs的增殖率逐渐增高,在pFGF2质粒浓度为100 μg时BMSC增殖率可达到对照组的(154.2%±5.34%),但是继续提高浓度后BMSCs增殖率开始下降,这可能与过多的质粒存在细胞毒性有关。
另外,Liu等[14]研究表明,FGF可以在体外通过BMP/Smad信号通路促进BMSCs增殖分化。本研究利用PCR检测了HBC@TACS-pFGF2与BMSCs共培养后相关成骨基因与成血管基因的mRNA表达情况,证实HBC@TACS-pFGF2可提高ALP和CD31基因的表达。因此,我们大胆猜测,HBC@TACS-pFGF2可以在体内骨缺损部位转染BMSCs提高成骨基因、成血管相关基因的表达,以促进骨缺损的修复过程。
本研究建立兔双侧桡骨18 mm缺损模型,实验组植入明胶海绵和HBC@TACS-pFGF2微球,对照组不作植入。移植术后第4周、8周、12周收集标本分别进行大体观察、X线检查、Masson染色等。结果发现,术后4周、8周、12周时,实验组兔桡骨缺损处的骨缺损断端桥接情况、骨密度以及新生骨矿化程度均优于对照组。值得注意的是,兔桡骨与尺骨在解剖上存在连续,因此在制备桡骨缺损模型后兔前肢的承重可由尺骨承担,桡骨在此期间可不参与负重,这与人体在骨缺损后的愈合过程可能存在不同。另外,兔的18 mm的骨缺损临界值与人的骨缺损临界值存在差异。
综上所述,HBC@TACS-pFGF2应用于骨缺损部位可以缩短骨缺损的愈合时间。实验中pFGF2质粒浓度为100 μg/mL,骨缺损修复的过程与pFGF2质粒的剂量有无关系,以及多种基因联合应用于骨缺损的修复效果如何,仍有待研究。另外,本实验采用明胶海绵作为缓释基因载体的负载材料,可用于非承重骨缺损的修复,应用于承重骨缺损处则存在一定缺陷。
