积雪草酸葡糖胺盐凝胶通过调节巨噬细胞迁移和极化促进创面愈合及表皮再生
2020-07-17刘冰滢王文波黄佳高振武晓莉刘伟
刘冰滢 王文波 黄佳 高振 武晓莉 刘伟
创面愈合是皮肤组织损伤后的正常过程,涉及炎症、细胞增殖、基质产生、组织重塑和再生等阶段[1]。每个阶段的顺利进行对于确保创面的正常愈合,以及皮肤修复和功能恢复至关重要[2-3]。
炎症阶段在正常的创面愈合过程中发挥了重要作用,因为炎症将巨噬细胞和其他炎症细胞募集到创面处,以清除细胞碎片并产生细胞因子和生长因子[4-5],进而促进基质的产生和沉积,促进新生组织填补创面缺损[6]。病理情况下,缺乏适当的炎症细胞,如糖尿病患者的创面,将导致创面难以愈合。
巨噬细胞可分为Ⅰ型(M1)和Ⅱ型(M2),前者对于创面清创和生长因子、基质的产生起了重要作用,后者则促进组织重塑和再生[7-8]。因此,M2表型极化对促进创面愈合和再生具有重要作用[9]。
积雪草酸是一种植物提取物,具有多种功能,例如抗氧化[10]、抗微生物[11]、抗凋亡[12]、抗癌活性[13]等。其在创面愈合过程中发挥双重功能,即抑制病理性瘢痕中细胞增殖和胶原蛋白的生成,同时还可促进正常的创面愈合和胶原蛋白生成[14-16]。但是,传统积雪草酸具有较低的生物利用度,水溶性差。因此,本研究采用水溶性的积雪草酸葡萄糖胺盐(AAGS)作为新的药物形式[17],并探索其对促进大鼠皮肤创面愈合的作用和机制。
1 材料与方法
1.1 实验试剂与仪器
胎牛血清 FBS(ScienCell,美国),RPMI1640培养液、磷酸盐缓冲液(Hyclone,美国),青霉素、链霉素、两性霉素B(Gibco,美国),二甲亚砜(上海沪试化工有限公司),凝胶敷料(清得佳)(Smith & Nephew,美国),AMV 逆转录试剂盒(Promega,美国),CD86抗体(ab53004,Abcam,美国),CD163抗体(GB11340-1,Servicebio,美国),二抗(GB23303,Servicebio,美国)。
酶联免疫检测仪(Thermo,美国),PCR仪(Biometra,德国)。
1.2 实验动物
共14只5周龄雄性SD大鼠,平均体质量150 g(上海交通大学医学院附属第九人民医院SPF实验室),并在安静、通风、恒温的环境下饲养,相对湿度(50%±10%),12 h光暗交替。独笼饲养,自由进水,喂食大鼠专用饲料,定时更换垫料。本研究经第九人民医院伦理委员会审核、批准。
1.3 建立大鼠背部皮肤创面模型及实验分组
大鼠麻醉后,背部备皮消毒后,用活检打孔器(直径0.8 cm)在大鼠背部两侧制作两个全层皮肤切除创面(每侧脊柱旁1 cm),采用硅胶圈固定以防创面张开。一侧设为实验组(Exp),一侧设为对照组(Ctrl)。实验组每天外用AAGS凝胶(30 mg/mL溶于PBS);对照组每天外用凝胶敷料(清得佳)。分别在第0、3、7、10和14天对创面行大体观察并拍照,并分别在第3天(n=4)、第7天(n=4)和第14天(n=6)取材。
1.4 小鼠巨噬细胞(RAW 264.7)的复苏与培养
将装有RAW264.7细胞的冻存管从液氮中取出,快速复苏。离心后加入RPMI1640培养液重悬细胞,细胞计数,调整细胞密度至2×106个/孔,种入6孔板中,37 ℃温箱内培养。每24小时换液,分别加入0 μg/mL、2.5 μg/mL、5 μg/mL、10 μg/mL AAGS培养48 h。
1.5 检测指标
1.5.1大鼠创面面积的测定
第0、3、7、10和14天拍摄的创面大体照片使用Image-ProPlus(6.0版,Media Cybernetics,Silver Spring,美国)进行创面面积的测量。
1.5.2表皮厚度和表皮嵴数的测定
第3、7和14天取材的创面组织,4%多聚甲醛4 ℃固定过夜、石蜡包埋、切片(5 μm),HE染色,测定表皮厚度和表皮嵴数量。取第14天的组织切片(每组各6张),选择表皮下方中间区域(40×),分别从图像的左侧、中部和右侧三处测量表皮厚度。此外,将每张图片(40×)的表皮区域均匀划分为5个区域,6张组织切片共30个区域,每个区域有表皮嵴则计数为1,没有表皮嵴则计数为0,30个区域相加得出各组的表皮嵴总数。
1.5.3炎症细胞的半定量分析
取第3天HE染色切片,于每张切片的表皮下方中间及两侧位置分别选择一张放大的图片(400×),每张图片手工计数蓝色深染的炎性细胞(单个核,圆形细胞),综合3张图片获得炎性细胞数的平均值。同样方法得到第7天(n=4)和第14天(n=6)各组的炎症细胞数平均值。
1.5.4免疫组织化学分析
取第14天组织切片(n=6),采用CD86(1∶200)和CD163(1∶200)抗体4 ℃孵育过夜,PBS洗涤2次,二抗(1∶300)室温孵育30 min,最后用3,30-二氨基联苯胺显色剂染色辅以少量苏木精衬染,并采用积分光密度(IOD)/面积值来测定蛋白质的表达量。
1.5.5定量RT-PCR 检测小鼠巨噬细胞M1和M2型的表达
将不同浓度AAGS培养的RAW264.7细胞悬液接种到6孔板上,培养48 h后提取细胞RNA,紫外分光光度计核算纯度,A260/A280比值为1.8~2.0。每个标本以1.5 μg总RNA为模板,按AMV逆转录试剂盒配制20 μL反应体系:5×Buffer 4 μL,10 mmol/L dNTP 2 μL,200 ng/μL Oligo dT-Adaptor Primer 1 μL,40 U/μL RNase抑制剂0.5 μL,5 U/μL AMV逆转录酶0.5 μL,反应体系加水配平至20 μL。反应条件:30 ℃ 10 min,42 ℃ 60 min,99 ℃ 5 min,5 ℃ 5 min。
cDNA在qPCR仪中扩增,反应体系:ddH2O 7 μL,MIX 10 μL,cDNA 1 μL,前引物1 μL,后引物1 μL。反应条件:95 ℃ 5 min、95 ℃ 30 s、58 ℃ 30 s、72 ℃ 45 s、72 ℃ 10 min为一个循环,共40个循环。GAPDH为内参照(表1)。

表1 引物序列Table 1 Primer Sequence
1.6 统计学分析
2 结果
2.1 AAGS对大鼠创面愈合的影响
第0、3、7、10和14天大体观可见实验组创面愈合相对较快,定量分析显示在第10天实验组创面面积明显小于对照组(P<0.05)(图1A、B)。
组织学观察可见,第3天两组创面均见明显的组织缺损;第7天实验组创面新生肉芽组织明显多于对照组,上皮化过程明显加快;第14天两组创面完全被新生组织填充,并完全上皮化,实验组创面可见表皮嵴结构,但对照组罕见(图1C)。
2.2 AAGS对于大鼠创面表皮重塑和再生的影响
组织学观察:对照组表皮较厚且缺少表皮脊结构,而实验组表皮较薄,可见明显表皮脊结构。定量分析:对照组创面表皮厚度为(76.43±21.63)μm,明显大于实验组(57.92±14.96)μm,差异显著(P<0.05)。半定量分析:实验组30个区域中有27区域出现表皮脊结构,而对照组仅有8个区域出现表皮脊结构,差异显著(P<0.05)(图2)。
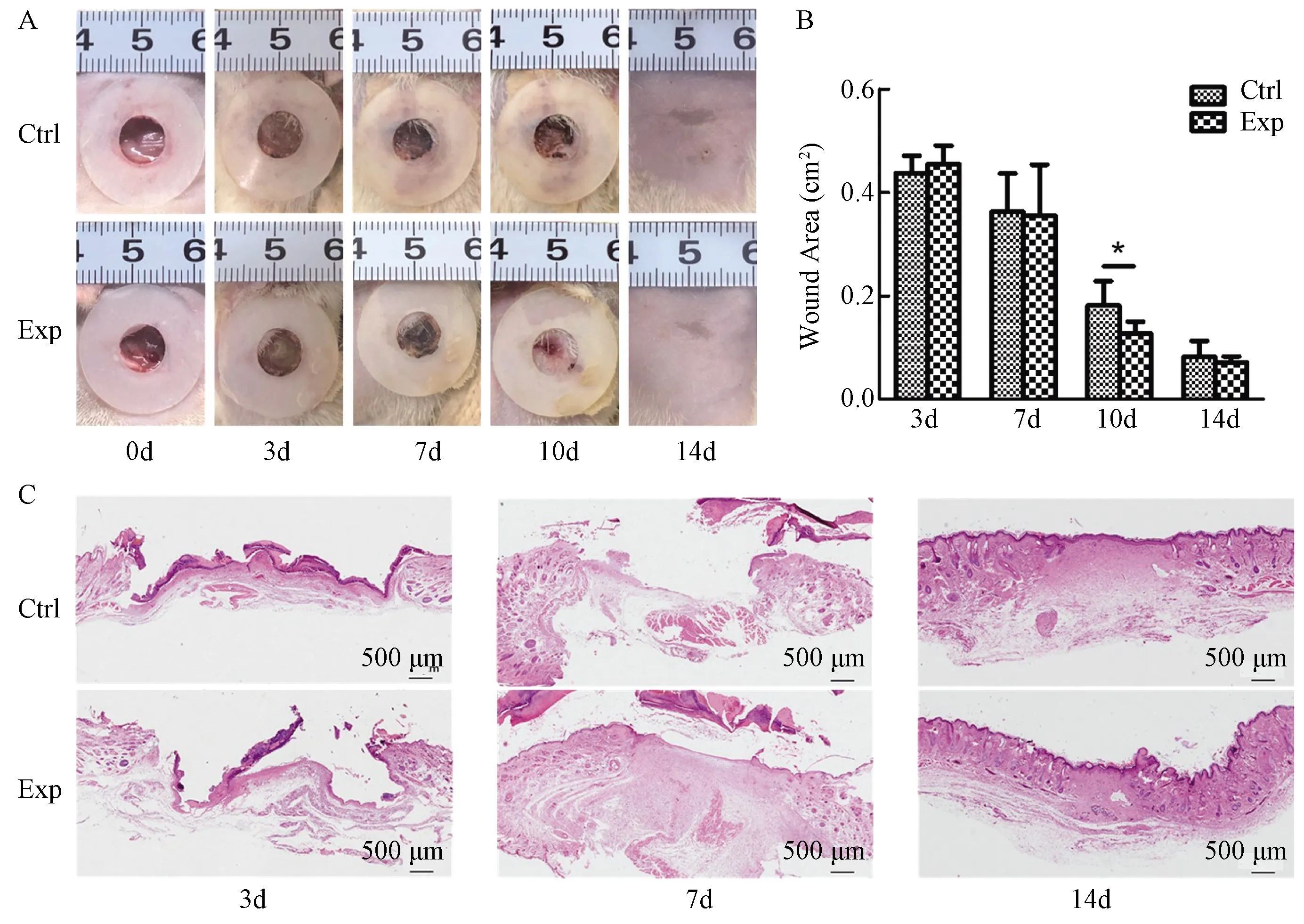
A:大体观;B:创面面积(*: P<0.05);C:组织学观察(比例尺=500 μm) A: Gross observation; B: Wound area (*: P<0.05); C: Histological observation (scale=500 μm)图1 各时间点两组创面大体观及组织学观察Fig. 1 Gross and histological observation of the two groups at each time point

A:组织学观察(比例尺=200 μm);B:表皮厚度(**: P<0.01);C:表皮嵴数(***: P<0.001) A: Histological observation (scale=200 μm); B: Epidermal thickness (**: P<0.01); C: Number of epidermal ridge (***: P<0.001)图2 两组表皮厚度和表皮嵴数的测定Fig. 2 Measurement of epidermal thickness and epidermal ridge number of the two groups
2.3 AAGS对创面炎性细胞的影响
组织学观察可见,在第3天和第7天,实验组创面可观察到更多的炎性细胞(单个核、原型细胞),但在第14天,两组炎性细胞数量相似。半定量分析显示,实验组、对照组在第3天的炎症细胞数分别为(171.33±14.81)和(118.83±14.25)(P<0.05),第7天分别为(83.42±13.78)和(57.69±13.42)(P<0.05),第14天分别为(60.08±15.48)和(53.25±9.35)(P>0.05)(图3)。

A、B、C:组织学观察(比例尺=50 μm);D:炎性细胞数量(*: P<0.05) A, B, C: Histological observation (scale=50 μm); D: Number of inflammatory cells (*: P<0.05)图3 各时间点两组炎症细胞的半定量分析Fig. 3 Semi-quantitative analysis of inflammatory cells of the two groups at various time points
2.4 AAGS在体内对巨噬细胞极化方向的影响
免疫组织化学染色显示,实验组创面中的M1细胞(CD68阳性细胞)比对照组略多,而实验组创面中的M2细胞明显多于对照组。半定量分析显示,实验组创面中的M1和M2细胞数均显著高于对照组(P<0.05)(图4)。

A、B:组织学观察(比例尺=50 μm);C:CD86 IOD值(*: P<0.05);D:CD163 IOD值(***: P<0.001) A, B: Histological observation (scale=50 μm); C: CD86 IOD value (*: P<0.05); D: CD163 IOD value (***: P<0.001)图4 两组免疫组织化学分析结果Fig. 4 Immunohistochemical analysis of the two groups
2.5 AAGS在体外对巨噬细胞极化方向的影响
小鼠巨噬细胞体外实验结果显示,在高剂量药物处理后,M1标记物IL-1、IL-6和INOS的基因表达相对增强。但是,M2标记基因(CD206和KLF4)的表达呈现出剂量依赖性诱导效应(P<0.05),验证了AAGS可以诱导M2极化(图5)。

A:M1型分化相关mRNA的表达;B:M2型分化相关mRNA的表达 A: M1-type differentiation-related mRNA expression; B: M2-type differentiation-related mRNA expression 图5 AAGS对小鼠巨噬细胞相关mRNA表达的影响(*: P<0.05;**: P<0.01;***: P<0.001)Fig. 5 Effect of AAGS on mouse macrophage-related mRNA expression (*: P<0.05; **: P<0.01; ***: P<0.001)
3 讨论
创面愈合是治愈皮肤损伤的正常过程,由内源性因素完成该过程,如巨噬细胞[17]、生长因子[18]和细胞因子[19-20]等。特别是当创面内伴随大块组织缺损时,快速肉芽组织形成和随后的上皮形成是创面愈合的关键步骤[21-22]。
新生毛细血管的生成和炎症细胞分泌的生长因子是诱导创面愈合过程的关键因素,依赖已形成的血块内的血小板和创面炎症细胞释放生物活性因子,以促进创面愈合[23]。然而,在难愈性、慢性创面(如糖尿病或老年人)愈合中,经常可观察到这些创面缺乏适当的炎症过程和血管生成[24-25],此时需要药物和其他手段的干预[26]。
积雪草酸是一种植物提取物,可通过促进成纤维细胞的增殖和胶原蛋白在体外[27]或体内的生成[28-30]来促进创面愈合。传统的积雪草酸具有较低的水溶性, AAGS(积雪草酸葡糖胺盐)则具有较高的水溶性[17]。更重要的是,AAGS在PBS中经过超声震荡处理后,以高于30 mg/mL的浓度自发形成水凝胶,成为创面局部治疗的理想形式[17]。
大体和组织学观察显示,AAGS处理后创面总体愈合加快。其可能的机制是药物诱导了早期的炎症反应,以增加炎症因子和生长因子的分泌[31]。半定量分析发现,实验组早期(第3天和第7天)的炎症细胞数量明显多于对照组。
此外,AAGS可加速愈合组织的重塑和再生。本研究结果显示,实验组创面上皮成熟更快(第7天),且较对照组表皮更薄,差异显著(P<0.05)。表皮增厚被认为是一种病理性改变,通常可于异常瘢痕(如瘢痕疙瘩)中观察到[32]。AAGS处理可使得愈合创面表皮变薄,表明AAGS可重塑表皮结构。更为重要的是,经AAGS处理的创面中出现了表皮脊结构(皮肤发育过程中成熟表皮的特征[33]),而对照组罕见(该现象通常在异常瘢痕形成中缺乏[34]),两组存在显著差异(P<0.05)。这一结果表明,AAGS可能有助于再生表皮结构,从而更好地恢复表皮功能。
巨噬细胞一项很重要的功能是诱导炎症和组织再生,前者由M1型巨噬细胞执行,而后者由M2型巨噬细胞执行[35]。本研究结果显示,第14天的创面组织中,实验组的M2细胞明显多于对照组。相比之下,实验组创面中仅发现了少量的M1细胞增加。这些结果提示,AAGS可能在创面早期诱导M1巨噬细胞形成,通过促进炎症因子和生长因子的分泌而促进成纤维细胞活化、增殖和基质分泌,从而形成新生肉芽组织填充创面,然后巨噬细胞转换为主要的M2表型,从而促进皮肤再生。这一假设也得到体外细胞学实验结果的支持。
AAGS由于采用了积雪草酸与氨基葡萄糖之间的化学键合,大大提高了生物利用度,提高了水溶性,达到一定浓度(>30 mg/mL)后可制成水凝胶,便于临床局部治疗的使用。本研究为积雪草酸葡糖胺盐的临床应用提供了良好的实验研究基础。
