胺碘酮诱发甲状腺功能异常敏感性的遗传特征研究
2020-07-16卢一苇谭龙张锦香常文露赵萍张万起
卢一苇,谭龙,张锦香,常文露,赵萍,张万起
(1.天津医科大学公共卫生学院营养与食品卫生学系,天津300070;2.天津市胸科医院营养科,天津300051)
胺碘酮(aiodarone,AMD)用作抗心律失常药物已30 余年,可用作治疗房性和室性心律失常。因AMD 是高碘化合物,每日常规维持量200 mg,其中含碘75 mg,在体内可代谢成6 mg 无机碘,为每天推荐碘摄入量的50~100 倍,可引起甲状腺功能异常等不良反应[1]。高碘暴露是AMD 引起甲状腺功能异常的主要机制。前期研究显示,甲状腺功能异常与基因多态性有一定的关联性。Lisette 等[2]的全基因组关联研究(genome-wide association studies,GWAS)揭示了PDE8B 基因附近遗传区域与甲状腺功能的关联性。随后基于GWAS,Yang 等[3]研究揭示了PDE8B 基因的相关位点与亚临床甲状腺功能减退症的关联性。Bari 等[4]证实了PDE8B 的某些基因位点与促甲状腺激素水平相关。Soto-Pedre 等[5]揭示了PDE8B、CCBE1、VAV3 等基因的12 个SNP 位点可以解释近7%的促甲状腺激素(TSH)水平的变化。Jyt 等[6]也发现了VAV3-rs4915077 为与甲状腺功能减退症相关的遗传位点。本课题组前期研究了从西方高加索人群中发现的甲状腺功能相关阳性突变位点在黄色人种分布的差异[7-9],结果发现SLC5A5、PTPN22、TG 等基因的某些位点与甲状腺功能异常具有关联性,提示这些基因的相关位点可能为影响甲状腺功能异常敏感位点。本研究综合以上研究选取与甲状腺功能相关的基因位点进行研究,探索与甲状腺功能对碘暴露敏感性相关的SNP 位点,以期为高碘暴露致甲状腺功能异常的敏感人群提供筛查和防治的科学依据。
1 资料与方法
1.1 研究对象 本研究所选对象为2016年9月至2018年2月天津市胸科医院确诊心律失常服用AMD 的114例患者。采用EDTA 抗凝管采集研究对象外周血样5 mL,保存于-80 ℃冰箱。所有被试人群均无血缘关系且服药前甲状腺激素水平均正常。服药后激素水平正常的人群为对照组,激素水平有一项或多项异常的为病例组。
1.2 SNP 分型检测实验方法 采用MassARRAY技术进行基因分型。整理SNP 序列信息成标准格式,进行SNP 位点引物设计,确定目的位点,合成引物,确定样本检测定量,384 孔PCR 反应,384 孔PCR纯化反应,384 孔单碱基延伸反应,树脂纯化,上机检测,收集数据。
1.3 SNP 位点的选择 通过参考前期工作和查阅国内外相关文献,选取其报道过的甲状腺异常易感位点。验证从SLC5A5、PTPN22、TG、TTF1、PDE8B、DIO1、PAX8、VAV3、CCBE1、DFNB31 选取的15 个候选SNP 位点。位点均经过Hardy-Weinberg 遗传平衡度检验。
1.4 统计学方法 采用SPSS 18.0 进行数据分析,正态分布资料(年龄、T3、T4、FT3、FT4、TSH)采用±s表示,两样本均数比较采用t 检验。非正态分布资料(服药时间)采用中位数(M)和四分位数间(P25~P75)表示,比较采用秩和检验,分类变量(性别)比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 调查对象的一般情况 病例组与对照组人群年龄、服药时间、性别的比较差异均无统计学意义(表1)。基础激素数值(T3、T4、FT3、FT4、TSH)经t 检验后无统计学意义(表2)。服药后的激素水平(T3、T4、FT3、FT4、TSH)经t 检验后T3(P=0.003)、TSH(P=0.004)有统计学意义(表3)。
表2 病例组与对照组服药前的甲状腺激素水平比较(±s)Tab 2 Comparison of thyroid hormone levels between case group and control group before taking medication(±s)
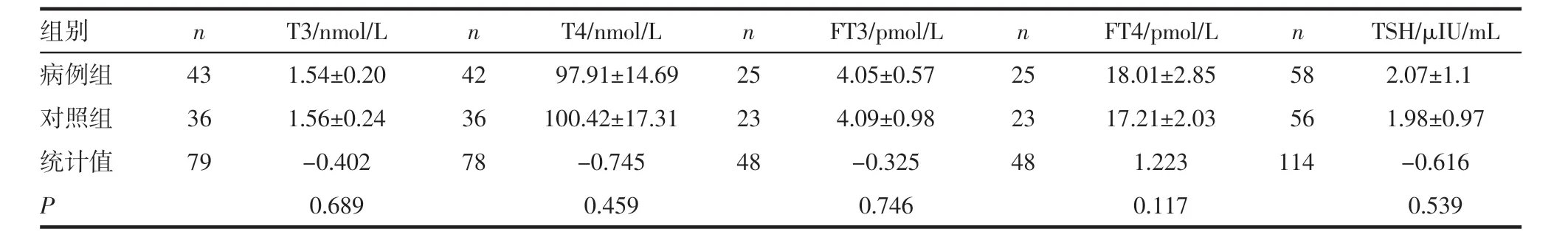
表2 病例组与对照组服药前的甲状腺激素水平比较(±s)Tab 2 Comparison of thyroid hormone levels between case group and control group before taking medication(±s)
组别 n T3/nmol/L n T4/nmol/L n FT3/pmol/L n FT4/pmol/L n TSH/μIU/mL病例组 43 1.54±0.20 42 97.91±14.69 25 4.05±0.57 25 18.01±2.85 58 2.07±1.1对照组 36 1.56±0.24 36 100.42±17.31 23 4.09±0.98 23 17.21±2.03 56 1.98±0.97统计值 79 -0.402 78 -0.745 48 -0.325 48 1.223 114 -0.616 P 0.689 0.459 0.746 0.117 0.539
表3 病例组与对照组服药后的甲状腺激素水平比较(±s)Tab 3 Comparison of thyroid hormone levels between case group and control group after taking medication(±s)
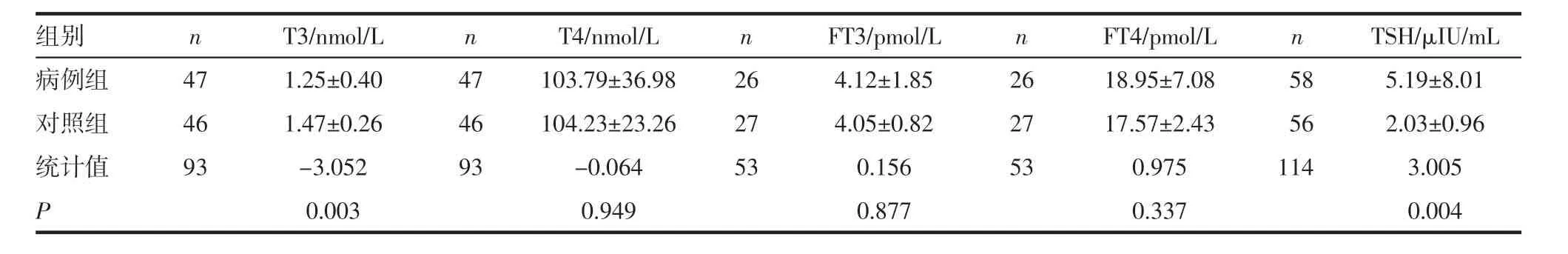
表3 病例组与对照组服药后的甲状腺激素水平比较(±s)Tab 3 Comparison of thyroid hormone levels between case group and control group after taking medication(±s)
组别 n T3/nmol/L n T4/nmol/L n FT3/pmol/L n FT4/pmol/L n TSH/μIU/mL病例组 47 1.25±0.40 47 103.79±36.98 26 4.12±1.85 26 18.95±7.08 58 5.19±8.01对照组 46 1.47±0.26 46 104.23±23.26 27 4.05±0.82 27 17.57±2.43 56 2.03±0.96统计值 93 -3.052 93 -0.064 53 0.156 53 0.975 114 3.005 P 0.003 0.949 0.877 0.337 0.004
2.2 Hardy-Weinberg 遗传平衡度检验 这15 个位点通过使用Haploview4.0 进行χ2检验[10],哈温平衡的P 值均大于0.05,且最小等位基因频率(minor allele frequency,MAF)均大于0.05(表4)。说明这15个SNP 位点均经过Hardy-Weinberg 遗传平衡度检验,表明具有群体代表性,可进行下一步分析。
2.3 单个SNP 位点的病例对照分析
2.3.1 SNP 的等位基因在病例组和对照组间的比较 应用χ2检验对以下15 个SNP 基因位点进行分析(表5),比较病例组和对照组之间的等位基因频率,结果显示:在高碘暴露下,SLC5A5-rs11672428等位基因C 和T 在病例组和对照组之间的频数分布为16/96、28/84,该位点为野生型等位基因T 时,甲状腺疾病患病风险明显升高[OR=0.500(0.253~0.987);P=0.043]。PDE8B-rs4704397 等位基因A和G 在病例组和对照组之间的频数分布为95/19、104/8,该位点为突变等位基因G 时,甲状腺疾病患病风险明显升高[OR=0.385(0.161~0.920);P=0.027]。PDE8B-rs6885099 等位基因A 和G 在病例组和对照组之间的频数分布为19/97、8/104,该位点为突变等位基因A 时,甲状腺疾病患病风险明显升高[OR=2.547(1.066~6.085);P=0.031]。
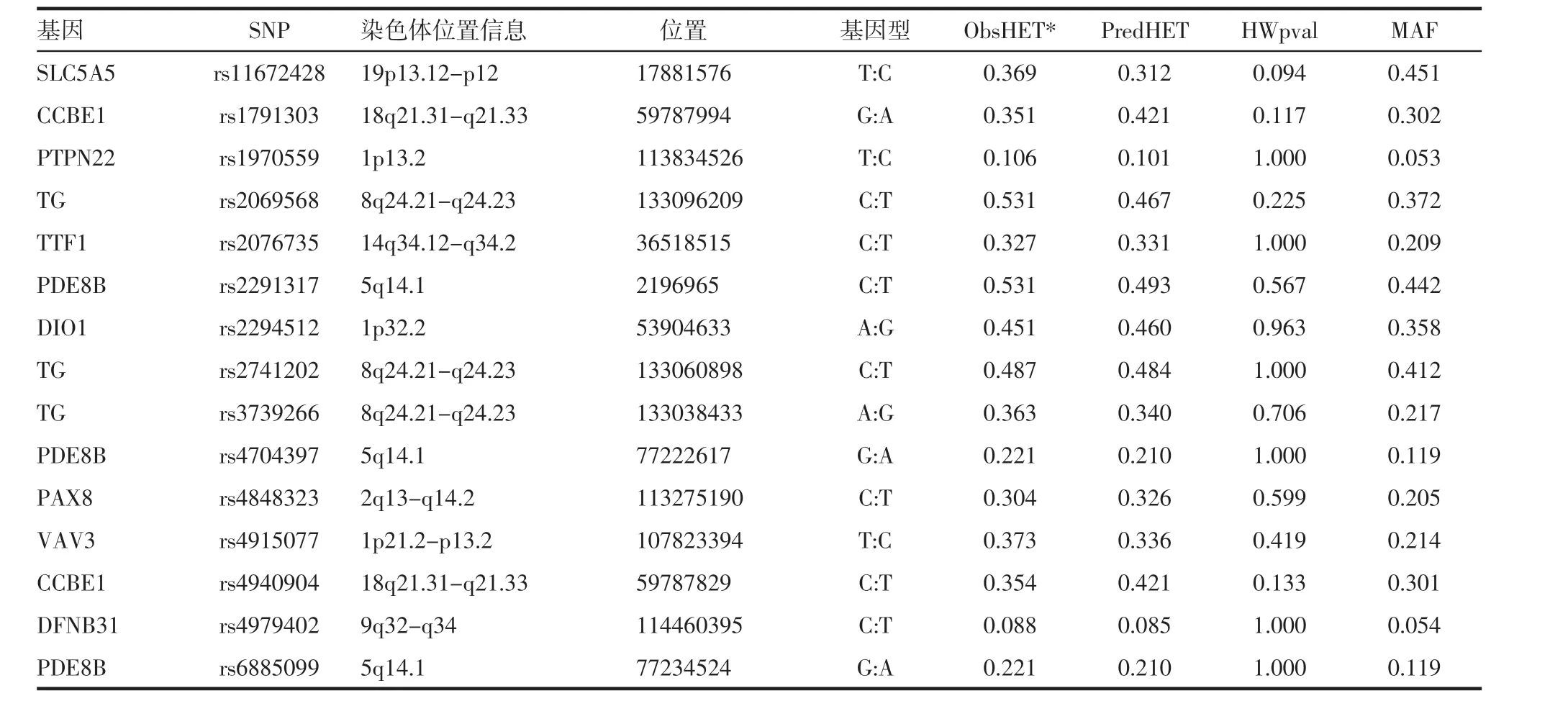
表4 Hardy-Weinberg 遗传平衡度检验Tab 4 Hardy Weinberg genetic balance test
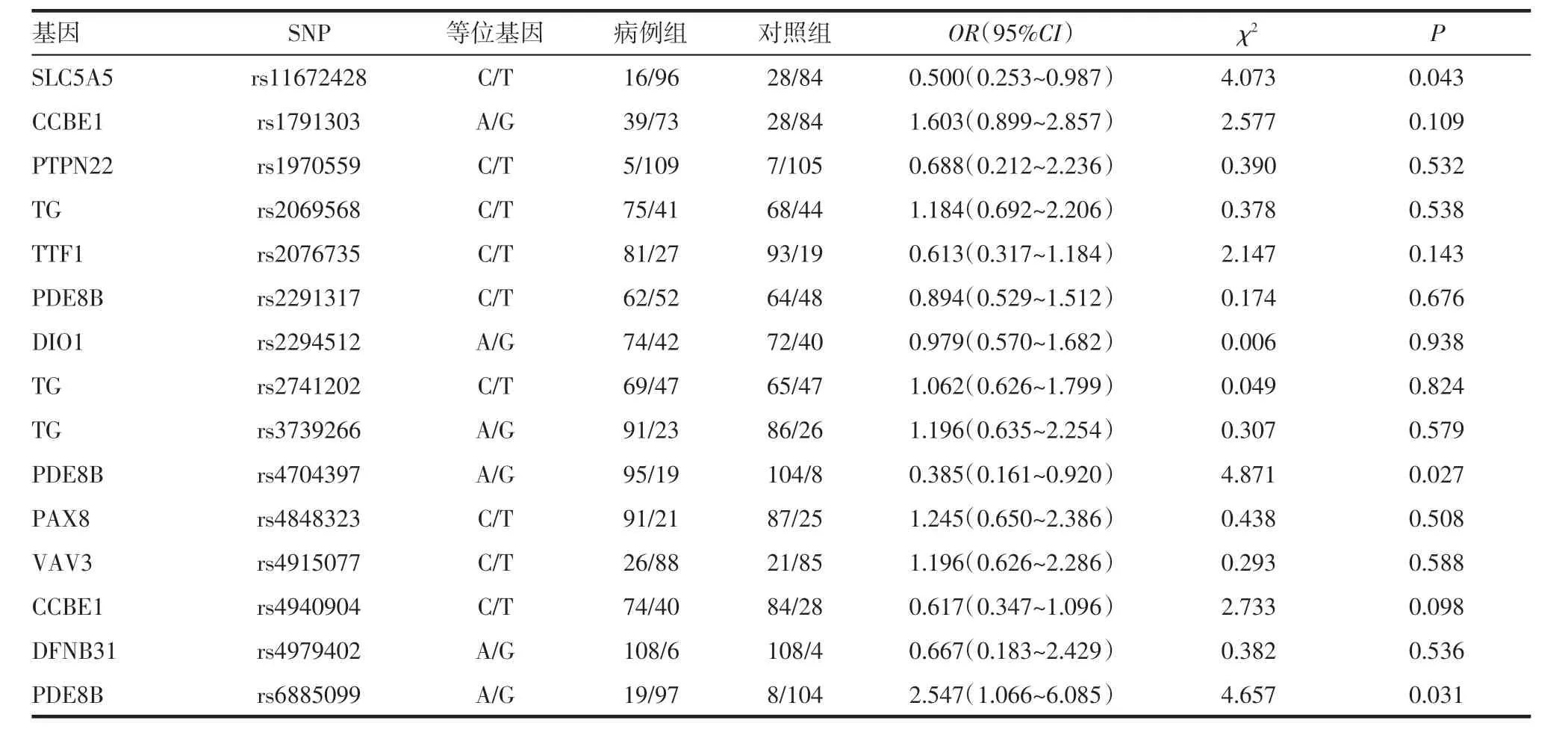
表5 SNP 的等位基因在病例组和对照组间的比较Tab 5 Comparison of the alleles of SNP between case group and control group
2.3.2 基于SNP 基因型的病例对照分析 每个SNP 位点具有2~3 种基因型,将病例组和对照组每组研究对象中3 种基因型的分布进行列联表χ2检验或Fisher 确切检验分析,根据P 值判断基因型与甲状腺功能异常之间是否存在关联。结果显示,CCBE1 基因的rs1791303 位点的3 种基因型AA、AG、GG 在病例组和对照组的分布频数为12/15/29和2/24/30(P=0.010),说明AA 基因型是与甲状腺功能异常相关性较强的基因型,它可能是增加罹患甲状腺功能异常易感性的基因型。CCBE1-rs4940904 位点的3 种基因型CC、CT、TT 在病例组和对照组的分布频数为29/16/12 和30/24/2(P=0.013),说明TT 基因型可能是增加罹患甲状腺功能异常易感性的基因型。VAV3 基因的rs4915077 位点的3 种基因型CC、CT、TT 在病例组和对照组的分布频数为0/26/31 和3/15/35(P=0.048),说明TT 基因型可能是增加罹患甲状腺功能异常易感性的基因型(表6)。
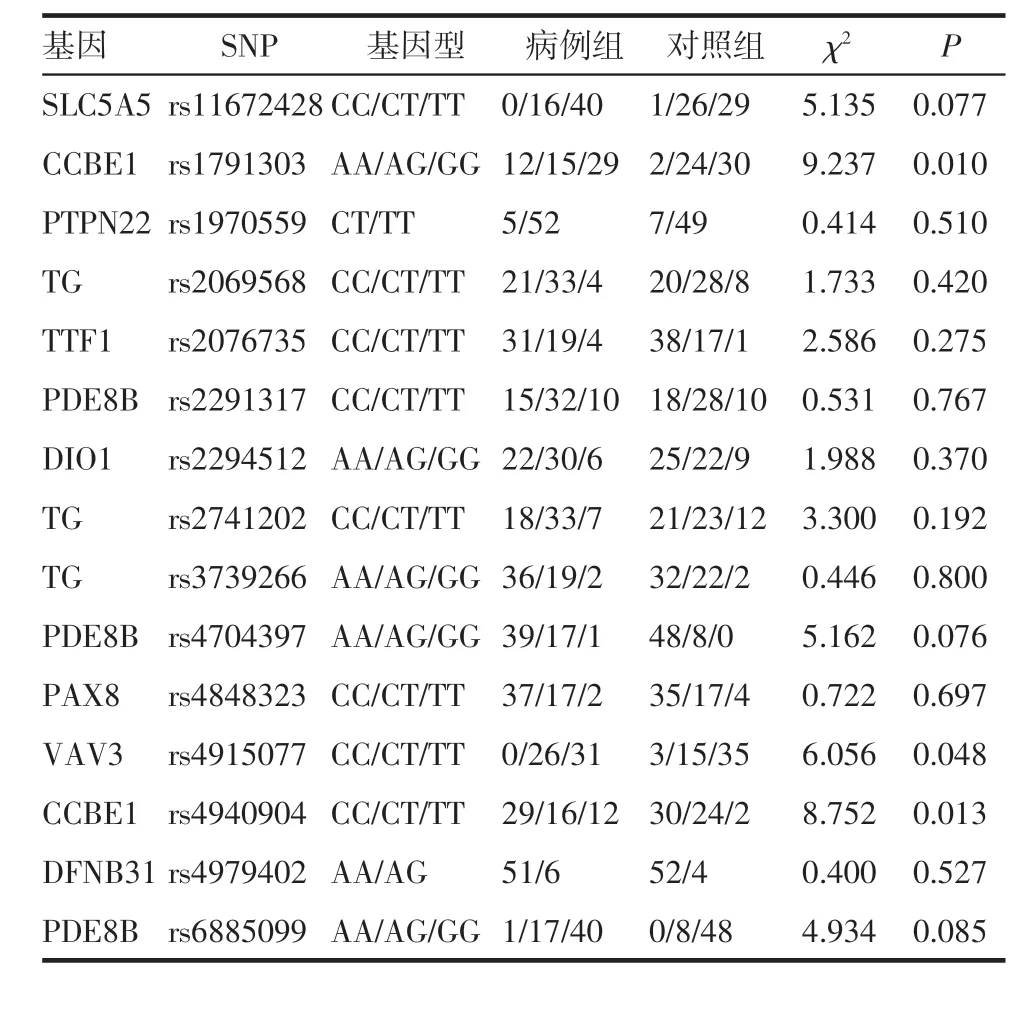
表6 SNP 基因型在病例组和对照组间的比较Tab 6 Comparison of SNP genotypes between case group and control group
3 讨论
近来对甲状腺疾病的遗传学研究受到越来越多的关注。有研究表明,人群血清甲状腺激素水平受基因调控影响的差异性很大,促甲状腺激素和甲状腺激素个体间的变异约有40%~65%归因于遗传[11]。国内外研究甲状腺功能疾病与基因位点的报道很多,但关于服用AMD 的患者甲状腺功能对高碘暴露敏感性相关的SNP 位点的研究尚无。
Ren 等[12]发现在低碘饮食人群中FOXE1-rs965513的等位基因A 的拷贝与分化型甲状腺癌有密切相关性。但张玲玲等[13]在中国鲁西南地区的汉族人群众中对比甲状腺乳头状癌患者与健康体检人群,未验证到FOXE1-rs965513 与膳食碘含量的摄入关系。Joshua 等[14]的GWAS 研究揭示了FOXE1 基因附近遗传区域与甲减的关联性。本研究参考其研究结果,从中选取FOXE1 基因附近的VAV3 基因和CCBE1基因的一些位点,在服用胺碘酮的高碘暴露人群中做SNP 分析,发现VAV3-rs4915077 的TT 基因型和CCBE1-rs4940904 的TT 基因型可能增加罹患甲状腺功能异常的风险。这两个基因位点的基因型可能为高碘暴露人群的敏感的基因型。
王文强等[8]针对山东高碘地区500例正常儿童与500例甲状腺激素水平异常儿童进行研究,发现PDE8B 基因的rs4704397 位点和rs6885099 位点与甲状腺功能异常之间存在显著的关联性。本研究结果表明,PDE8B-rs4704397 的野生等位基因A 和PDE8B-rs6885099 的野生等位基因G 可以降低甲状腺异常的风险。这两个基因位点的等位基因可能是在高碘暴露致甲状腺功能异常的潜在相关基因。
有证据表明SLC5A5 基因与甲状腺功能障碍存在显著相关性,Spitzweg 等[15]发现SLC5A5 基因上有13 个位点与碘转运障碍有关。此外,Yui 等[16]发现SLC5A5 基因-c.1042T>G, p.Y348D 突变可引起钠碘协同转运体(sodium-iodine symporter, NIS)缺陷将导致先天性甲状腺功能减退。Ferrandino 等[17]发现对于敲除SLC5A5 基因外显子6 和7 的小鼠,高碘饮食可以改善甲状腺功能减退症的症状。本研究也发现在高碘环境下SLC5A5-rs11672428 的突变等位基因C 的存在可以降低患甲状腺功能异常的风险。SLC5A5 的等位基因C 可能为碘暴露下甲状腺功能敏感性潜在相关的基因。
综上所述,本研究初步探索了碘暴露致甲状腺疾病风险相关的一些SNP 位点,其中SLC5A5-rs11672428的T 等位基因、PDE8B-rs4704397 的G 等位基因和rs6885099 的T 等位基因可增加甲状腺功能异常的风险;CCBE1 基因的rs1791303 位点和rs4940904位点、VAV3 基因的rs4915077 位点的多态性与甲状腺功能异常相关,本研究结果可为筛查高碘暴露下致甲状腺功能异常的敏感人群提供参考依据。本研究的不足之处是未能从敏感基因位点中筛查出相关等位基因型,这可能与样本量大小相关,因此,明确甲状腺功能对碘暴露敏感性相关的SNP 位点还需纳入更多样本进一步研究。
