高频不可逆电穿孔的消融参数与消融有效性关系的研究
2020-07-16刘玉堂韩玉薛志孝
刘玉堂,韩玉,薛志孝
(天津医科大学生物医学工程与技术学院医学仪器教研室,天津300070)
不可逆电穿孔(irreversible electroporation,IRE)是一种新兴的治疗肿瘤的非热消融技术。其运用微秒级高压电脉冲在细胞膜上形成纳米级孔隙,导致细胞凋亡,这一过程称为不可逆电穿孔[1-3]。最重要的是IRE 在破坏细胞膜的同时,不会引起热焦耳加热导致的组织损伤[4],因此在临床中有广泛应用前景,尤其对于临近重要血管和神经的病灶[5-6]。大量研究证明,IRE 在治疗胰腺癌[7]、近肝静脉或门脉的恶性肝肿瘤[8-9]、前列腺肿瘤[10]等具有较好的治疗效果和可行性。然而传统IRE 会造成局部和全身肌肉收缩,并可能影响心脏节律,造成心率失常等问题[11]。因此在临床应用中,患者接受IRE 治疗时要进行全身麻醉、肌肉麻醉以及心脏同步放电等处理[12]。高频不可逆电穿孔(high-frequency irreversible electroporation,H-FIRE)致力于解决IRE 中存在的不足而诞生,H-FIRE 有以下几种优点:(1)其产生频率高达500 KHZ 以上的交替极性脉冲,减少肌肉收缩[13]。(2)可以更均匀地将细胞的跨膜电位提高到模拟电穿孔阈值[14]。(3)可以达到良好的肿瘤消融效果以及抑制肿瘤生长的目的[15]。典型H-FIRE 仍然存在局限性,研究表明,运用典型H-FIRE 进行体内3D 模型仿真消融与IRE 达到相同致死域时所需要的电场强度更高。Sano 等[16]发现H-FIRE 的不对称输出方式可以增大消融区域,使消融区域更加均匀。目前不同参数的H-FIRE 对于实际组织的消融范围、有效剂量均没有明确。
本文通过一系列动物实验,分别对正常肝脏组织以不同场强、不同脉宽方式形式进行H-FIRE 消融,其中输出脉宽方式包括对称2 μs、对称5 μs、以及不对称3 μs 和2 μs 交替输出的方式。结合病理分析和部分仿真结果,研究了H-FIRE 在不同场强、不同脉宽方式、不同术后天数影响下消融面积的差异性。建立了兔子肝脏肿瘤模型以及对其消融效果进行分析,评价H-FIRE 消融的有效性,为后期H-FIRE 消融肿瘤提供实验参数依据。
1 材料和方法
1.1 实验仪器 天津市鹰泰利安康医疗科技股份有限责任公司研发的第二代高压陡脉冲治疗仪,该仪器可以产生频率为50~250 KHZ 的双向高压脉冲,输出电压为1000~3500V,正负脉冲均可在2~10 μs 内调节,可对组织使用高频双向对称及不对称方式进行消融;石蜡切片机:徕卡;显微镜:奥林巴斯;石蜡包埋机:徕卡;石蜡脱水机:徕卡;石蜡烤片机:徕卡。
1.2 材料和试剂 VX2 肝癌细胞:中国医学科学院基础医学研究所;胎牛血清:gibco;DMSO:Sigma;生理盐水:北京华兴科诺生物技术有限公司;0.4%台盼蓝染液:北京索莱宝科技有限公司;超声耦合剂:山东汇康;陆眠宁:吉林省华牧动物保健有限公司;伊红染色液:北京索莱宝科技有限公司;苏木素染色液:北京索莱宝科技有限公司;无水乙醇:天津市江天化工技术有限公司;二甲苯;天津市江天化工技术有限公司;多聚甲醛:北京索莱宝科技有限公司;PBS 缓冲液。
1.3 动物模型
1.3.1 兔正常肝脏 24 只雄性日本大耳兔(裕达,中国),平均体质量2.5 kg,常规饲养。所有动物实验均经中国医学科学院或生物医学工程技术学院医学工程研究所动物护理和使用委员会批准。
1.3.2 兔原位肝癌 肿瘤细胞制备:肝癌兔子模型首先利用冻存的VX2 细胞在兔子腋下皮肤较紧致的部位注射1 mL 细胞悬液。接种两周后取出肿瘤组织,制成细胞悬液浓度为1×107个/mL。肿瘤细胞植入:挑选3 只雄性日本大耳兔(裕达,中国),平均体质量2.5 kg,常规饲养。按照兔子体质量肌肉注射陆眠宁0.2 mL/kg,待兔子麻醉后,将兔子取仰卧位固定在手术台上,剃毛,在超声探头上抹上超声耦合剂,找到肝脏较厚且不靠近大血管和胆管的部位,注射0.5 mL 细胞悬液。术后2 周,使用超声观察肿瘤模型是否建立成功,肿瘤大约长到1 cm3时,可进行H-FIRE 消融手术。
1.4 消融参数 实验使用第二代高压陡脉冲治疗仪,正负脉宽均可调节,为方便后面分析,本研究脉宽设置有对称方式和不对称方式,不对称的脉宽用P-Dp-N-Dn 表示,P 为正脉冲脉宽,Dp 为正脉冲延时,N 为负脉冲脉宽,Dn 为负脉冲延时。为了便于组间比较使用简化的电剂量公式(1):

其中V 是施加的电压,Tp 是脉冲宽度,n 是施加的脉冲数。本研究通过设置不同的电压、不同脉宽以及脉冲数来比较不同剂量下H-FIRE 消融肝脏组织的面积和效果。在相同的电压、相同的剂量下比较脉宽为对称2 μs、对称5 μs 以及不对称3-2-2-3 μs 的H-FIRE 消融肝脏组织的面积和效果。最后比较在相同剂量、相同脉宽条件下在不同时间点的H-FIRE 消融肝脏组织的变化。具体脉冲参数如表1 所示。
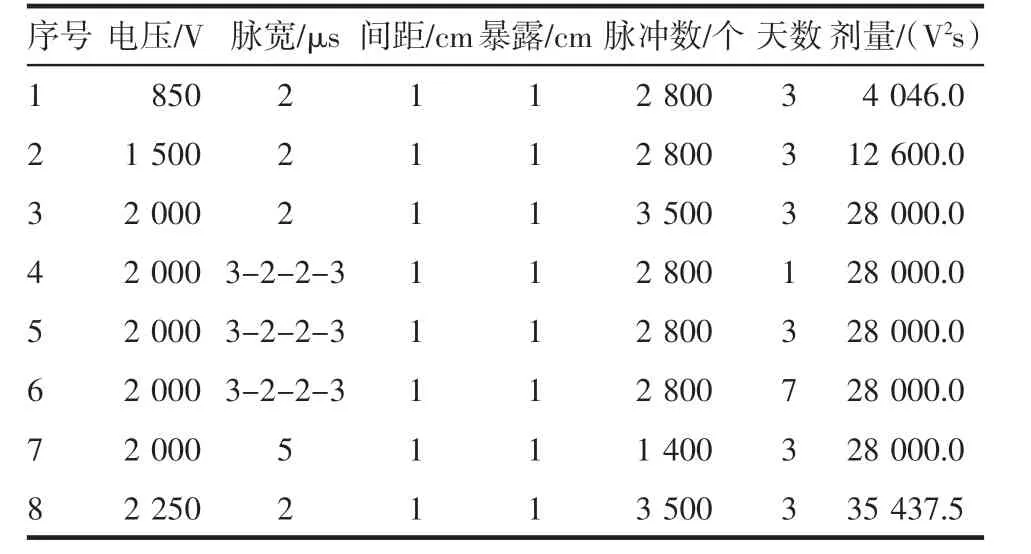
表1 脉冲参数设置Tab 1 Pulse parameter settings
1.5 手术消融 将24 只雄性日本大耳兔在手术前禁饲。麻醉使用肌肉注射陆眠宁和呼吸麻醉,消融时开腹并暴露肝脏,插入两根消融电极针,分组按照上述脉冲参数完成治疗并在指定天数处死动物,观察消融部位并进行病理观察。按照图1 中示意脉冲波形进行消融。将3 只造模成功的肿瘤兔子按照正常兔子的消融方法,麻醉开腹并暴露肝脏,寻找造模肿瘤位置后将两根电极针布置在肿瘤两侧(图2),按照2000 V,不对称3-2-2-3 μs,28000 V2s 的剂量进行消融。对照组开腹后,平行扎入电极针,但不放电。
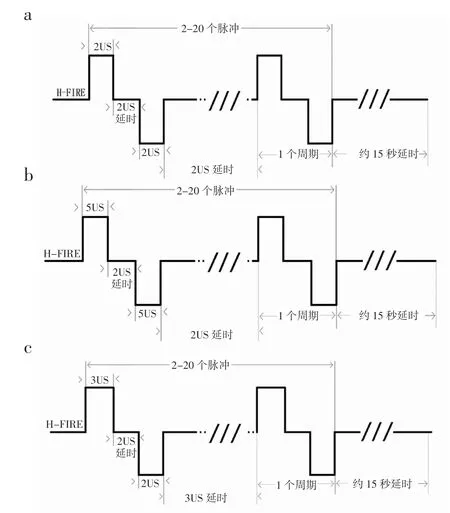
图1 H-FIRE 波形脉冲示意图Fig 1 H-FIRE waveform pulse diagram
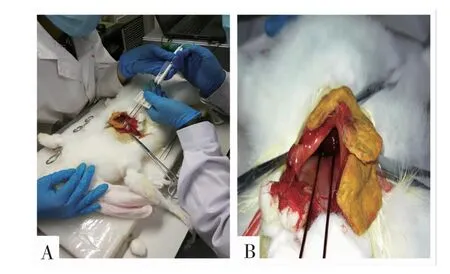
图2 消融实验现场操作图Fig 2 Ablation experiment site operation diagram
1.6 大体观察与消融面积计算 所有正常兔执行消融实验后在不同时间点处死,取出消融肝脏组织;所有肿瘤模型兔在治疗后第3 天处死,实验组取消融肝脏肿瘤组织,对照组取肿瘤组织。通过肉眼观察记录消融区域颜色、形状、大小等,随后在视野中加入标记物和标尺,用相机拍照后导入ImageJ软件,将标记物和标尺作为标准,换算像素与实际物体大小关系,计算消融面积。病理观察:将取出的正常消融肝脏组织和消融肝脏肿瘤组织用PBS 清洗后放入4%多聚甲醛中,24 h 后脱水、包埋、切片,HE 染色观察肿瘤组织形态的变化。
1.7 COMSOL 仿真模型 通过COMSOL 仿真软件建立12 cm3的肝脏模型,添加两根半径为0.0695 cm,高度和间距为1 cm 的圆柱形纳米针模型,通过对纳米针模型电极间电压的不同设置,模拟出场强分布,以便于对比仿真与实际结果消融区不同。电场分布由电势梯度得到,如式(2)所示。

结合文献中电导率的变化情况[17],得到电导率关于电场及温度的函数,如式(3)所示。
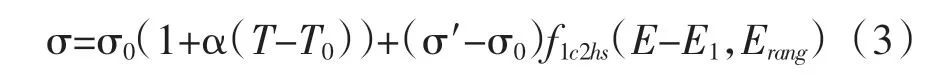
正常肝组织及肿瘤的初始电导率分别为0.067 S/m;α 为电导率随温度变化的系数;T0为组织的初始温度,设为37 ℃;σ′为组织只在电场作用下的最大电导率,正常肝组织的最大电导率为0.241S/m[18];f1c2hs为具有二阶连续导数的平滑Heaviside 函数;E 为电场强度。
1.8 统计学分析 使用SPSS V.19.0 软件进行统计学分析。数据表示为平均值±标准偏差。采用t 检验用于评估两组之间的差异。以上所有实验至少重复3 次。P<0.05 为差异有统计学意义。
2 结果
2.1 不同电压下肝脏组织消融的大小及病理分析 本实验观察了H-FIRE 消融后第三天脉宽均为2 μs,电压分别为850 V、1500 V、2000 V、2250 V 4 组的H-FIRE 消融肝脏的效果,发现电压为850 V/cm的消融面积最小为(0.59±0.03)cm3,且消融区域不连续。随着电压增加,消融面积增大,1500 V/cm、2000 V/cm 和2250 V/cm 消融面积分别为(1.43±0.08)cm3、(2.25±0.33)cm3和(2.34±0.13)cm3,电压超过2000 V/cm 后再增加,消融面积稍微增大,与2000 V/cm 组相比无明显变化,如图3 所示。
根据病理分析来看,电压为850 V,电极距离1 cm 的条件下,消融区内肝细胞大量坏死,细胞膜破碎,细胞排列规则、正常,细胞间隙可以明显看到;电压上升到1500 V 时,肝细胞坏死加剧,细胞排列较规则,细胞间隙相对上组缩小;电压继续提高为2000 V 时,细胞坏死严重,图中所见细胞核大量减少,细胞排列基本无规则,细胞间隙基本消失;电压为2250 V 时,消融区内无完好细胞,细胞严重碎裂,细胞排列无规则,细胞间隙消失,已经不能看出肝脏细胞形态,且消融区内存在许多出血点。由此可见,单位厘米电压的增加不仅会使宏观上的消融区域增大,还会在微观上影响肝脏细胞的坏死程度以及肝脏细胞间的基本排列、结构等。

图3 2 μs 脉宽不同电压H-FIRE 消融后第三天肝脏组织变化Fig 3 Changes in liver tissue on the third day after ablation of 2 μs pulse width and different voltage H-FIRE
观察不同电压条件下所形成消融区域面积大小的组间差异性,结果如图4 所示。
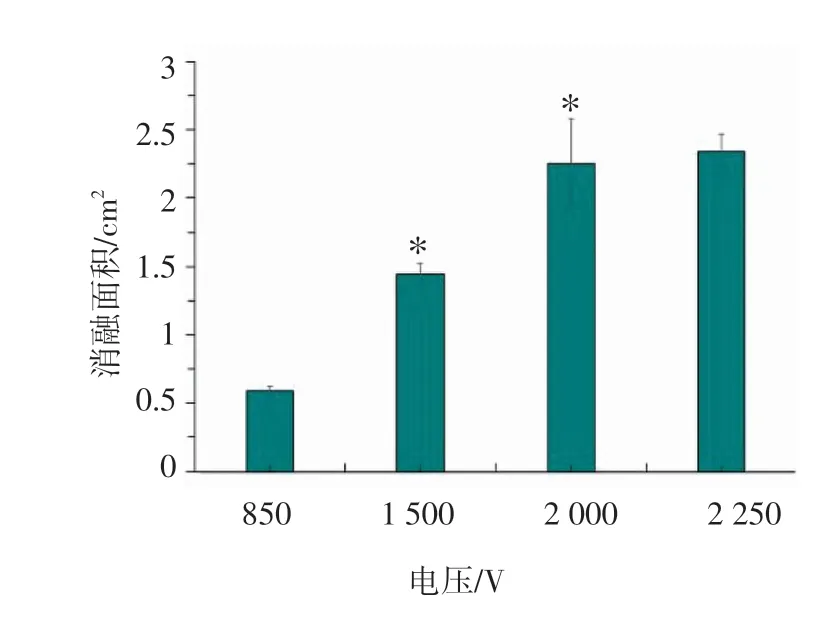
图4 2 μs 脉宽不同电压H-FIRE 消融面积比较Fig 4 Comparison of 2 μs pulse width of different voltage H-FIRE ablation area
2.2 数学仿真与实际消融面积对比 通过COMSOL有限元仿真软件模拟出双针间距1 cm,两电极之间压差分别为850 V、1500 V、2000 V 和2250 V,不考虑脉宽方式影响时的电场分布情况,并用线条画出大于600 V/cm[1](步长为200 V/cm)的等势线,计算大于600 V/cm 等势线所包含面积。根据宏观来看,理想的消融区形状应该更加接近仿真形状,以两个针眼为中心,类似为一个扁平状的椭圆形。然而真实的宏观结果显示,实际消融区与仿真结果大体形状一致,并没有理想中规则,其原因可能是由于肝脏组织存在密度差异,肝脏结构不规则。对比实际与数学模型之间的差异(图5),图中两条曲线重合趋势较好,可见,电场分布是决定实际消融区域形状和大小的决定性因素。

图5 实际消融面积与数学模型仿真面积对比Fig 5 Comparison of actual ablation area and simulation area of mathematical model
2.3 不同脉宽下肝脏消融的比较 剂量为28000 V2s,比较在消融后第三天脉宽为对称2 μs、对称5 μs,以及不对称3-2-2-3 μs 3 种放电方式消融效果,发现3 种方式消融面积大小无明显差异(P>0.05),不对称3-2-2-3 μs 的放电方式形成的消融区域更趋向于圆形。
对称2 μs、对称5 μs,以及不对称3-2-2-3 μs 3 种放电方式消融3 d 后宏观图与病理图如图6 所示,并用红色线条和红色圆圈分别勾勒出消融边缘以及入针位置。蛋白质变性在消融区内呈现出白色和黑色,脉宽为2 μs 和5 μs 时,蛋白质变性主要出现在针眼附近,呈圆圈状,具体表现为从两针眼开始以圆环状向外扩展,进一步来看,2 μs 相对于5 μs蛋白质变性较规则和均匀。脉宽为不对称3-2-2-3μs时,白色环状变性更大,范围更广,且存在于两针外围呈椭圆形分布,蛋白质变性程度相对于脉宽为2 μs和5 μs 结果明显更加均匀和规则。蛋白质的变性是指在某些物理和化学因素作用下,其特定的空间构象被破坏,从而导致其理化性质的改变和生物活性的丧失,其形状体现了消融的均匀程度。由此可见,不对称脉冲造成的消融效果相对更加均匀。从病理图分析来看(图6),5 μs 消融区内蓝染较少,细胞核较2 μs 明显减少,细胞损伤严重,细胞排列混乱。不对称组已经看不出明显的细胞排列结构,视野内几乎无完好细胞,且炎性细胞较多,细胞坏死程度进一步加剧。
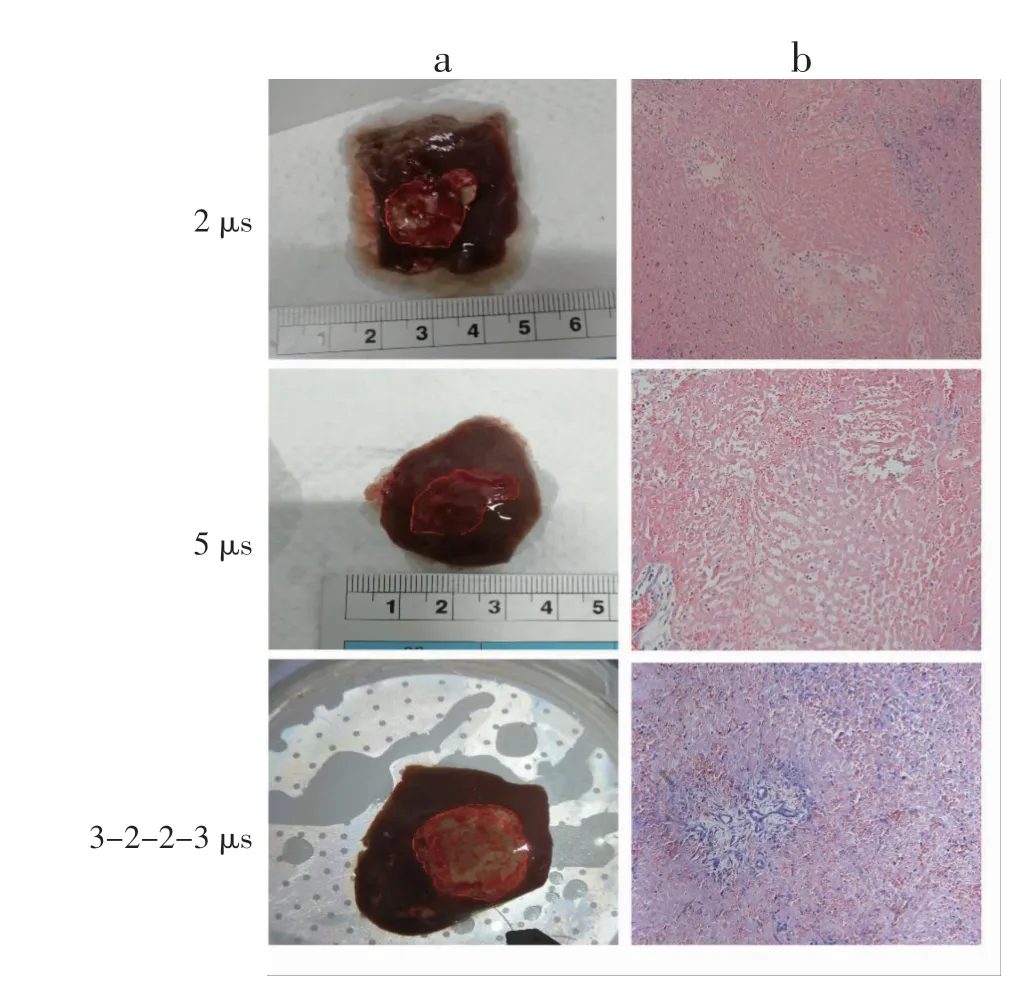
图6 不同脉宽方式的H-FIRE 消融后第三天肝脏组织的变化Fig 6 Changes in liver tissue on the third day after H-FIRE ablation in different pulse width modes
2.4 H-FIRE 消融在不同时间点的变化 设置HFIRE 参数为2000V,3-2-2-3μs,剂量为28000 V2s,消融后第一天,消融部位呈暗红色,有淤血,细胞状态相对完整,还能观察到完整的细胞核。消融后第三天消融部位增大,组织颜色发白,从病理观察到细胞核碎裂,细胞缩小,细胞死亡,组织大片坏死,炎性细胞浸润严重,组织消融边界明显。消融后第七天,明显观察到消融的组织面积缩小,周围组织收缩聚集。从病理图片上可以发现消融部位肝脏细胞完全坏死,纤维组织增生,肝细胞再生,纤维组织代替了正常组织,消融区域周围还可以观察到炎性细胞的浸润(图7)。
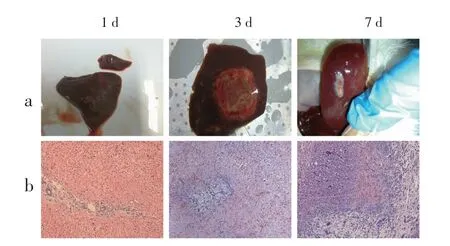
图7 肝脏组织在H-FIRE 消融后不同时间点的变化情况Fig 7 Changes in liver tissue at various time points after H-FIRE ablation
2.5 肿瘤模型消融实验结果 VX2 原位肝脏肿瘤模型均建立成功。病理图显示如图8,对照组细胞核明显大于正常的肝脏组织,核质比高,肿瘤呈巢状生长。两个电极针中间消融区域炎性细胞浸润严重,细胞核碎裂,细胞缩小,细胞界限不清晰。消融区域周围有明显的消融边界,坏死细胞与正常细胞之间能观察到明显的界限(图8 中红色线圈出),消融边界外围还有存活的肿瘤组织。
图8 中,消融参数为2000 V,脉宽3-2-2-3 μs,剂量28000 V2s 进行实验后的肿瘤模型和正常组织宏观消融图的消融区域边缘及针眼位置已用红色线标出。宏观上来看,正常组织消融区内蛋白质变性程度更加均匀,肿瘤模型消融后肿瘤内部蛋白质变性较集中,外围较均匀,其原因可能是消融区肿瘤呈巢状,肿瘤组织电导率、密度、细胞致死阈值和正常组织具有很大的差别。
另外,由于肿瘤呈巢状生长,外部存在纤维组织包膜,而H-FIRE 的原理是造成细胞膜纳米级电穿孔,无法消融纤维组织,治疗中也不会损伤血管。宏观上看到的差异性很可能是残留的纤维组织边界造成的。微观上来看,肿瘤模型消融区内蓝染大幅减少,肿瘤细胞基本完全坏死,原本的肿瘤细胞已无细胞结构,坏死细胞无规则排列,消融区内细胞与周围肿瘤带形成了鲜明对比。
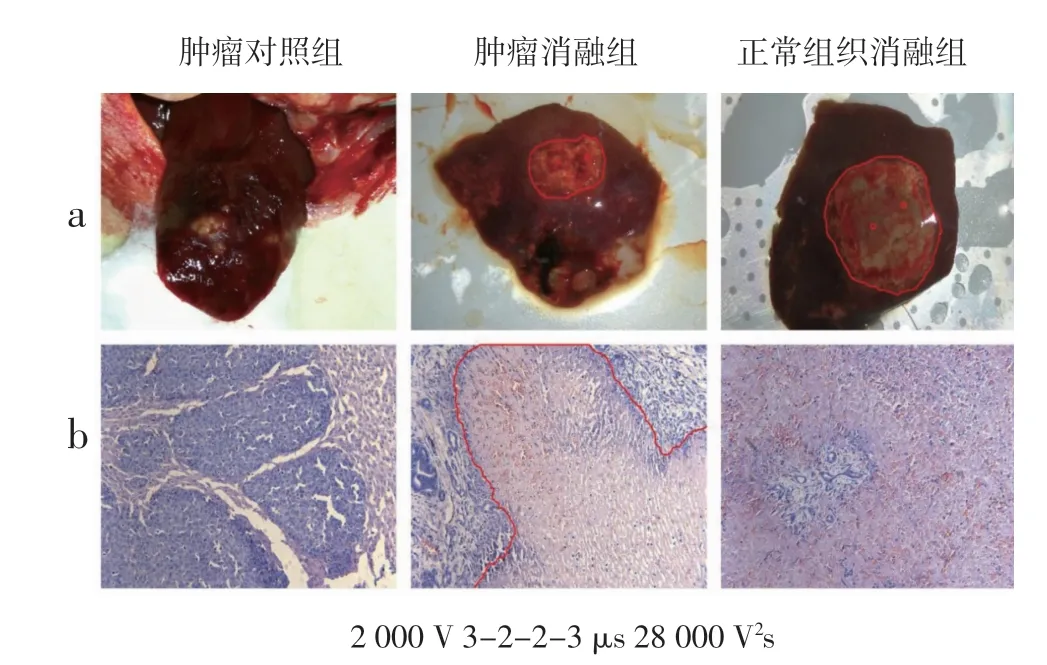
图8 肿瘤消融后的宏观图和病理图Fig 8 Macroscopic and pathological maps after tumor ablation
3 讨论
本实验消融过程中,观察到实验动物肌肉收缩减少,期间通过心电检测发现H-FIRE 治疗过程中未对心脏波形产生明显影响。根据实验结果和仿真结果来看,H-FIRE 脉宽为2 μs 时,单位距离间消融电压为1500 V/cm、2000 V/cm、2250 V/cm 的实验实际消融区域面积分别为(1.43±0.08)cm2、(2.25±0.33)cm2、(2.34±0.13)cm2。由此可见,当脉冲数超过一定范围时[19],影响消融区域大小的因素还是极间电压的大小,它决定了场强的分布范围,从而根本上影响消融的有效范围。但随着电压和剂量的增大,对消融区域的影响逐渐降低。
同等剂量和单位距离间电压相同的前提下,脉宽方式的不同会导致电导率产生不同变化[19-20],不对称脉宽输出的方式可以进一步减小细胞的致死阈值[15]。然而本次实验结果显示,2 μs、5 μs 对称和3-2-2-3 μs 不对称3 种方式消融面积大小无明显差异,值得注意的是,不对称放电形式形成的消融区域蛋白质变性较规则和均匀,具体原因需要数值模拟结合实际情况进一步分析。消融后第一天到第七天,区域内的细胞逐渐坏死,被正常细胞代替,从这方面看,H-FIER 的消融形式主要为细胞凋亡[21]。
肿瘤消融病理分析中,消融后的肿瘤细胞细胞核碎裂,细胞界限不清,出现了明显的细胞坏死,且消融区域边界明显,H-FIRE 对肿瘤细胞具有杀伤性,消融区域具有可控性。对于实际组织消融时,无论是传统IRE 还是H-FIRE,如果想达到理想的消融区域,治疗方案的参数设置尤为重要,较低的消融剂量或者较小的单位距离间电压都可能造成无法使消融区域连续的结果,从而使消融治疗不彻底,消融效果不理想。从本文的实验与数值仿真结果来看,过高的电压虽然会使消融区域略微增大,但效果甚微,若考虑到安全性、设备要求、耗损等条件时,单位距离间过高的电压是没有必要的。同理,过高的输出剂量会增加治疗时间和手术复杂程度,并且对消融区域面积大小无明显增益,因此,过高的消融剂量同样没有必要;不对称脉冲形成的消融区域蛋白质的变性更加规则和均匀,消融效果更好。结合本文实验来看,对于兔子正常肝脏组织消融,电压为2000 V,消融剂量为28000 V2s,放电脉冲为3-2-2-3 μs 不对称形式得到的消融效果最为理想。
本次实验中,从宏观和病理图来看,未发现消融区内存在肝脏血管损伤,与Siddiqui 等[3]所得结论一致;另外,本次实验中观察到实验兔均无明显颤抖出现,肌肉收缩现象不明显,结果与Sano、Arena等[13]发现高频双向脉冲抑制肌肉收缩的结论一致;从病理分析来看,H-FIER 的消融形式主要为细胞凋亡[21]。实验中发现,高频双向不对称脉冲与对称脉冲所造成消融区域并没有明显差别,与Sano 等[16]数值模拟得到的非对称H-FIRE 波形能够产生比对称H-FIRE 波形更大消融区域的结论不一致,具体造成实际结果与仿真模拟结果不同的原因还需进一步研究。值得注意的是,本实验中发现不对称脉冲所得到的消融区域形状更趋于圆型,蛋白质变性更加均匀和规则,造成此现象的原因还需要更多的模拟数据和实验数据来进行进一步的探索讨论。不对称H-FIRE 对于肿瘤细胞的杀伤性,消融区域的可控性在本次实验中得到验证,与H-FIRE 可以成功破坏肿瘤细胞的结论一致[22]。
本文通过实验,结合部分仿真结果,研究了HFIRE 在不同剂量、不同脉宽方式、不同术后天数影响下消融面积的差异性,展示了在H-FIRE 消融时电压、剂量、脉宽方式的不同时对消融区面积的大小,消融区域内蛋白质变性形状和程度造成的不同影响,并通过建立和消融兔子肝脏肿瘤模型,评价了H-FIRE消融的有效性,验证了已有结论,发现了未探索的问题,为H-FIRE 在今后的研究提供了数据支持。
