人肿瘤关联钙信号转导因子2的生物信息学分析
2020-07-15张玉洁孙怡琳马晓丽
张玉洁,孙怡琳,朱 苹,马晓丽
0 引 言
有效的肿瘤标志物可以反映肿瘤的生物学特性,对肿瘤诊断、治疗及预后有重要意义。肿瘤关联钙信号传导因子2(tumor associated calcium signal transducer 2,TACSTD2)在许多人类肿瘤中高表达,其染色体位置1q32.1是一个基因编码的肿瘤相关抗原。该抗原是转导钙信号的细胞表面受体[1],在调节癌细胞的生长中发挥作用[2]。TACSTD2最早从正常和恶性滋养细胞中鉴定出来,在人类合体细胞和滋养层细胞中存在特异性高表达,有研究将其描述为滋养层细胞的表面标志物,可用于检测和分离孕妇血液中循环的胎儿滋养层细胞,以及用于绒癌等生殖细胞瘤患者的诊断和治疗[3]。TACSTD2还与胶滴状角膜营养不良有关[4-6]。越来越多的研究证明,TACSTD2在人实体肿瘤中的表达增加调节了与肿瘤细胞增殖、迁移、侵袭和转移有关的生物过程,对肿瘤的发生发展过程起重要作用,可作为肿瘤的生物标志物,成为非常有希望的治疗靶标[7-10]。本研究通过生物信息学方法,对TACSTD2的结构和功能进行分析和预测,为进一步探索TACSTD2的分子功能提供依据。
1 材料与方法
1.1 材料从美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)获取人源性TACSTD2基因mRNA序列GI:1653961507,TACSTD2蛋白氨基酸序列CAG47056.1。TACSTD2蛋白氨基酸序列的FASTA文件格式:MARGPGLAPPPLRLPLLLLVLAAVTGHTAAQDNCTCPTNKMTVCSPDGPGGRCQCRALGSGMAVDCSTLTSKCLLLKARMSAPKNARTLVRPSEHALVDNDGLYDPDCDPEGRFKARQCNQTSVCWCVNSVGVRRTDKGDLSLRCDELVRTHHILIDLRHRPTAGAFNHSDLDAELRRLFRERYRLHPKFVAAVHYEQPTIQIELRQNTSQKAAGDVDIGDAAYYFERDIKGESLFQGRGGLDLRVRGEPLQVERTLIYYLDEIPPKFSMKRLTAGLIAVIVVVVVALVAGMAVLVITNRRKSGKYKKVEIKELGELRKEPSL。
1.2方法
1.2.1人源性TACSTD2的开放阅读框架预测登陆NCBI官网(https://www.ncbi.nlm.nih.gov/orffinder/),将TACSTD2的mRNA序列GI输入开放阅读框架(Open Reading Frame, ORF)Finder在线工具,得到TACSTD2基因的ORF。
1.2.2人源性TACSTD2蛋白的理化性质分析通过Uniprot数据库(https://www.uniprot.org/uniprot/?query=TACSTD2&sort=score),获得TACSTD2基因编码蛋白质的氨基酸序列,登录查询TACSTD2的ID为P09758,输入Prot-Param(http://expasy.org/tools/protparam.html)数据库,预测TACSTD2蛋白的理化性质,包括蛋白的分子量、氨基酸组成、脂肪指数、不稳定系数等参数。用ProtScale(https://web.expasy.org/protscale/)分析该蛋白的亲水和疏水性。用Window size=13时计算窗口内每个位置上氨基酸的标度权值。
1.2.3人源性TACSTD2的信号肽预测运用Signal P4.1(http://www.cbs.dtu.dk/services/SignalP/),通过对目的肽链前70个氨基酸间潜在酶切位点的预测来判断是否存在信号肽。设置Cut-off 值为0.450,预测C、Y、S-score,S 的平均值可以用来判断是否为分泌蛋白(S>0.5,为分泌蛋白且有信号肽),Y 的最大值用来判断信号肽的剪切位点。
1.2.4人源性TACSTD2蛋白的亚细胞定位预测通过NLStradamus 工具预测其蛋白质定位和细胞核定位;用PSORT Ⅱ软件分析TACSTD2蛋白的细胞定位。
1.2.5人源性TACSTD2蛋白的跨膜结构域预测将TACSTD2蛋白氨基酸序列的FASTA文件输入TMHMM 在线软件,对TACSTD2蛋白进行跨膜结构的预测。
1.2.6人源性TACSTD2蛋白的二级、三级结构分析将TACSTD2蛋白氨基酸序列用Predict-Protein工具中的PROF Sec 法分析TACSTD2蛋白的二级结构,用SOPMA分析TACSTD2蛋白的二级结构组成,将构象数目设置为3(Helix,Sheet,Coil),其它的参数默认为原始数据。用SWISS-MODEL在线工具通过同源建模法构建TACSTD2蛋白的三维结构模型。
1.2.7人源性TACSTD2蛋白的基本结构域预测采用NCBI里的CD-search在线程序直接对TACSTD2蛋白进行结构域预测。
1.2.8人源性TACSTD2蛋白的蛋白质修饰位点分析通过DISPHOS(http://www.dabi.temple.edu/disphos/)工具预测TACSTD2蛋白磷酸化位点;用NetNGlyc 1.0(http://www.cbs.dtu.dk/services/NetNGlyc/)在线工具预测TACSTD2蛋白的糖基化位点,包括O型糖基化位点和N型糖基化位点。
1.2.9人源性TACSTD2蛋白的互作蛋白和通路分析采用String工具预测与TACSTD2相互作用的蛋白,GO分析TACSTD2参与的信号通路。
1.2.10人源性TACSTD2蛋白的基因表达谱分析采用Gene Expression Display Server在线数据库直接输入TACSTD2的基因名,获得TACSTD2的蛋白和mRNA水平在不同组织及肿瘤中的情况。
2 结 果
2.1TACSTD2基因ORF分析TACSTD2的mRNA序列得到的ORF有12个,最长的ORF是ORF1,共972bp,可编码323个氨基酸。ORF1的序列(CAG47056.1)与TACSTD2的氨基酸序列一致。
2.2TACSTD2蛋白的理化性质分析TACSTD2蛋白分子量为35709.40,蛋白质的总分子式为C1561H2556N466O455S18,原子总数:5056。含有323个氨基酸残基,带负电荷的残基总数(Asp + Glu)36个,带正电荷的残基总数(Arg + Lys)47个。理论等电点pI为9.14,说明蛋白偏碱性。氨基酸组成中,Ala(A)27(8.4%)个、Arg(R)30(9.3%)个、Asn(N)9(2.8%)个、Asp(D)20(6.2%)个、Cys(C)12(3.7%)个、Gln(Q)10(3.1%)个、Glu(E)16(5.0%)个、Gly(G)24(7.4%)个、His(H)8(2.5%)个、Ile(I)12(3.7%)个、Leu(L)39(12.1%)个、Lys(K)17个(5.3%)、Met(M)6(1.9%)个、Phe(F)7(2.2%)个、Pro(P)19(5.9%)个、Ser(S)15(4.6%)个、Thr(T)17(5.3%)个、Trp(W)1(0.3%)个、Tyr(Y)8(2.5%)个、Val(V)26(8.0%)个。TACSTD2蛋白的不稳定指标达到了40.77,为不稳定蛋白。
TACSTD2蛋白的脂肪指数为93.28,亲水性的平均值为-0.228。TACSTD2蛋白最大的疏水性分值为3.8,亲水性最大的数值为-2.3。图1显示TACSTD2蛋白亲水性的氨基酸多于疏水性的氨基酸,表明TACSTD4蛋白属于亲水性蛋白。

图 1 TACSTD2蛋白亲水性和疏水性分析
Figure 1 Hydrophilicity-hydrophobicity analysis of human TACSTD2 protein
2.3TACSTD2蛋白信号肽预测及蛋白质定位TACSTD2蛋白存在信号肽:剪切位点C 的最大值为0.846,位于31位氨基酸,综合剪切位点Y 最大值为0.879,位于31位氨基酸,信号肽S 最大值为0.985,其预测的剪切点在1-30位氨基酸。S 平均值为0.913,能够形成经典的信号肽区域,说明TACSTD2蛋白是分泌蛋白且有信号肽。在第30-31位氨基酸残基间C值最大,S值陡峭,Y值最高峰,预测为信号肽剪切位点。NLStradamus 工具预测结果显示,TACSTD2氨基酸序列存在NLS,提示TACSTD2可定位于细胞核。见图2。

图 2 TACSTD2蛋白的信号肽分析
Figure 2 Signal peptide analysis of human TACSTD2 protein
2.4TACSTD2蛋白的亚细胞定位分析TACSTD2蛋白主要分布在细胞质膜、细胞外、细胞核以及细胞质,提示TACSTD2蛋白为分泌蛋白,可以在细胞外及细胞核内发挥作用,见图3。

图 3 TACSTD2蛋白的亚细胞定位
Figure 3 Subcellular localization of human TACSTD2 protein
2.5TACSTD2蛋白跨膜结构的分析TACSTD2蛋白主要在细胞膜外,部分在跨膜区,而细胞内较少,提示TACSTD2蛋白在细胞外的部分可以作为抗原表位发挥作用。见图4。

图示红色阴影为跨膜区
图 4 TACSTD2蛋白的跨膜区预测
Figure 4 Prediction of transmembrane region ofhuman TACSTD2 protein
2.6TACSTD2蛋白的二级结构与三维模型TACSTD2蛋白主要为环状结构,其次为螺旋结构;其二级结构中,α-螺旋占25.39%,无规卷曲占52.01%,延伸链占22.60%,无规卷曲常展示在蛋白质表面,有利于抗原抗体的相互作用;溶剂可及性分析结果主要为暴露。见图5。TACSTD2氨基酸序列(第31-273位氨基酸)与其模板4mzv.1.A存在48.54%相似度,属于上皮细胞黏附分子蛋白家族。见图6。
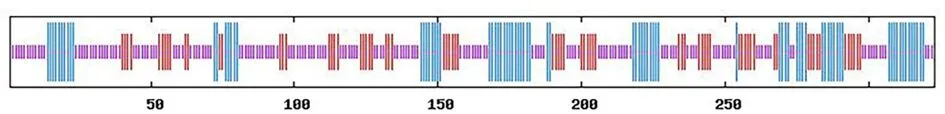
图 5 TACSTD2蛋白的二级结构
Figure 5 Prediction of secondary structure of TACSTD2 protein

图 6 TACSTD2蛋白的三维模型
Figure 6 3D structure of human TACSTD2 protein
2.7TACSTD2蛋白的结构域分析TACSTD2蛋白在72-145位置有一个I型甲状腺球蛋白重复序列的结构域,人甲状腺球蛋白的N端区域包含11个Ⅰ 型TY重复序列是半胱氨酸蛋白酶的抑制剂。
2.8TACSTD2蛋白修饰位点预测分析TACSTD2蛋白有15个丝氨酸修饰位点,17个苏氨酸修饰位点,8个酪氨酸修饰位点。见图7。糖基化位点预测的结果见图8,绿色线条代表一个糖基化修饰位点,共4个,所以TACSTD2 蛋白序列中存在4个N型糖基化修饰位点。
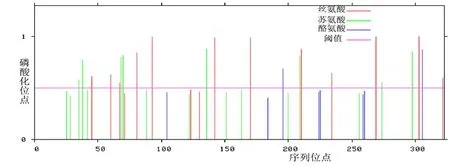
图 7 TACSTD2蛋白磷酸化位点预测
Figure 7 Phosphorylation analysis of human TACSTD2 protein

图 8 TACSTD2蛋白糖基化位点预测
Figure 8 Analysis of human TACSTD2 N-glycosylation
2.9与TACSTD2蛋白相互作用的蛋白及生物学功能预测TACSTD2与CLDN1、CLDN7、CLDN4、CYP8B1、KRTAP5-2、ATP6V1B1、TJP1、ACTB、ATP1A1等蛋白存在相互作用。见图9。根据GO分析结果,TACSTD2参与以下信号通路:细胞表面受体信号通路(GO0007166)、视觉感知(GO:0007601)细胞增殖(GO:0008283)、上皮细胞迁移的负调控(GO:0010633)、上皮细胞增殖的调节(GO:0050678)、对刺激的反应(GO:0050896)、应力纤维组件的负调节(GO:0051497)、输尿管芽形态发生(GO:0060675)、输尿管芽形态发生中分支的负调控(GO:0090191)、细胞间黏附(GO:0098609)、底物黏附依赖性细胞扩散的负调控(GO:1900025)、皱褶组件的负调控(GO:1900028)、细胞运动的负调控(GO:2000146)、干细胞分化的正调控(GO:2000738)。

图 9 String预测与TACSTD2相互作用的蛋白
Figure 9 Protein-protein interaction network for TACSTD2
2.10TACSTD2在人体正常组织和肿瘤中的表达TACSTD2蛋白在皮肤、胆囊、肺、肝等不同的组织中均有表达,在血管、睾丸、肌肉、心脏和脑组织中细胞系和对应的组织中表达量差异有统计学意义(P<0.05)。见图10。与正常组织比较,TACSTD2的mRNA在宫颈癌、肺癌、甲状腺癌、子宫癌、肝癌、结直肠癌中高表达。见图11。
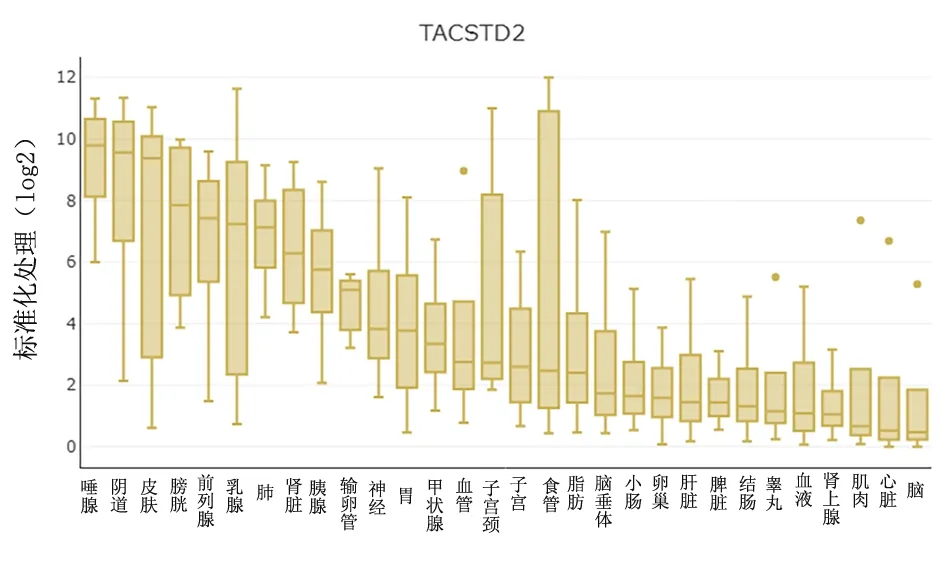
与对应细胞系比较,*P<0.05
图 10 TACSTD2蛋白在不同组织中的分布
Figure 10 Expression of TACSTD2 protein in different tissues

图 11TACSTD2 mRNA在不同肿瘤中的分布
Figure 11 Expression of TACSTD2 mRNA in differenttumor types
3 讨 论
本研究通过对人源性TACSTD2进行生物信息学分析,预测TACSTD2基因无内含子,TACSTD2蛋白是偏碱性不稳定亲水性蛋白。TACSTD2由一个大的细胞外结构域,一个跨膜结构域和一个短的细胞内或细胞质尾巴组成。蛋白质的定位信息存在于该蛋白质自身结构中,通过与膜上特殊的受体相互作用而得以表达。TACSTD2蛋白位于膜外区域的氨基酸序列可作为抗原表位,发挥膜受体蛋白的作用。TACSTD2蛋白有信号肽形成区域,有一个I型甲状腺球蛋白重复序列的跨膜结构域,是分布在细胞质内外、细胞膜上的分泌蛋白,主要的二级结构为无规则卷曲,溶剂可及性分析结果为暴露;三维结构显示它属于上皮细胞粘附分子家族,含有多个丝氨酸和糖基化的修饰位点,与CLDN1等蛋白相互作用,参与细胞的增殖、迁移、粘附等过程,在多种人实体肿瘤中高表达。
本研究发现,TACSTD2基因在起始密码子之后,有一段编码疏水性氨基酸序列的RNA片段,这个氨基酸序列就是TACSTD2的信号肽序列。而含有跨膜区的蛋白往往和细胞的功能状态密切相关,蛋白质序列含有跨膜区提示它可能作为膜受体起作用,也可能是位于膜的锚定蛋白或者离子通道蛋白[11]。三维结构模型显示,TACSTD2在拓扑上分为一个较大的N末端胞外部分(Trop2EC),该部分由三个结构域组成,该区域通过一个跨膜螺旋(TM)固定在细胞膜中,随后是26个氨基酸残基的短细胞内尾巴(Trop2IC)。模块化的Trop2EC进一步分为一个小的N端富含半胱氨酸的结构域(CRD),一个甲状腺球蛋白1型结构域(TY)和一个缺乏半胱氨酸的结构域(CPD)[12]。分子的特定拓扑区域涉及不同的过程。例如,在调节的膜内蛋白水解切割过程中,将Trop2EC和Trop2IC从TM部分切割下来。释放的Trop2IC通过β-catenin信号传导途径间接影响细胞增殖和自我更新[13]。接下来,TACSTD2充当钙信号转换器。此时,Trop2EC通过单克隆抗体在细胞膜上的交联导致细胞内Ca2+水平升高[14]。该机制可能涉及Trop2IC中的PIP2结合位点[15]。此外,最近的报告显示,在肺发育过程中,TACSTD2可能充当IGF-1 / IGF-1R信号传导途径的衰减剂,其中Trop2EC与IGF-1R竞争IGF-1结合[16]。Trop2EC的其他结合伴侣是跨膜蛋白CLAUDIN-1和-7,它们在上皮屏障的紧密连接中起重要的结构和功能作用。据推测,TACSTD2在CLAUDIN重排过程中充当锚或转运蛋白,或者它充当防止CLAUDIN降解的稳定剂。TACSTD2在维持紧密连接完整性方面的重要性得到了以下观察的支持:TACSTD2基因功能丧失导致紧密连接相关蛋白的亚细胞定位的表达降低和重排,从而影响上皮屏障的性能[17]。
在生物内,蛋白质的合成场所与功能场所常被一层或多层细胞膜隔开,这样就涉及到蛋白质的转运。合成的蛋白质只有准确地定向运行才能保证生命活动的正常进行。TACSTD2是一种糖蛋白,最初被鉴定为滋养层细胞的表面标志物,但随后在许多实体癌中显示出增加的表达,在某些正常组织中表达较低[10]。含有信号肽的蛋白质一般都是分泌到细胞外,可能作为重要的细胞因子起作用,有潜在的应用价值[18]。通过几种信号传导途径调节癌症的生长,侵袭和扩散,并在干细胞生物学和其他疾病中起作用。有一些研究表明高TACSTD2表达的生物学机制与癌症的侵袭性有关[19-20]。EI Sewedy等[21]的研究表明,TACSTD2的磷脂酰肌醇4,5-二磷酸结合位点具有被蛋白激酶C磷酸化的能力;因此,通过TACSTD2的信号转导有可能引起癌细胞的侵袭性。高TACSTD2表达将通过旁分泌和自分泌信号通路促进癌细胞的生物学攻击,可作为肿瘤治疗的新靶标[7]。
综上所述,本研究通过对TACSTD2的分析发现,该分子在肿瘤的发展过程中,参与调节细胞增殖和迁移,自我更新,以及维持基底膜完整方面的作用[22-23],但由于TACSTD2信号传导的复杂性,也存在很多不明确的潜在机制,了解TACSTD2蛋白的分子结构,为该分子蛋白功能的研究方向提供了新的可能,为进一步研究TACSTD2的作用机制提供了一定的理论依据。
