高效液相色谱-串联质谱法同时测定精神分裂症患者血浆中文拉法辛和阿立哌唑浓度
2020-07-15王建欣杨谦谦高明龙杨继章
王建欣,罗 丹,杨谦谦,高明龙 ,杨继章
(1. 河北医科大学第一医院药学部,河北 石家庄 050031; 2. 河北医科大学第一医院精神卫生科,河北 石家庄 050031)
精神分裂症阴性症状为精神分裂症的核心症状[1]。抗抑郁药物文拉法辛联合第2 代抗精神病药物阿立哌唑能显著改善精神分裂症阴性症状,且安全有效。但由于抗精神病药物治疗窗相对狭窄,毒副作用较大,且精神分裂症患者治疗的依从性较差,为确保药物治疗安全有效,临床应用时应监测患者的血药浓度,以便及时调整给药方案。目前,国内外测定文拉法辛和阿立哌唑血药浓度的方法主要有高效液相色谱-串联质谱(LCMS/MS)法[2-5]和高效液相色谱(HPLC)法[6-9]。本研究中建立了一种能同时快速、准确测定精神分裂症患者血浆中文拉法辛和阿立哌唑浓度的LC -MS/MS 法,为临床监测血药浓度提供参考。现报道如下。
1 仪器与试药
4000Q TRAP 型质谱仪(配有ESI 源,美国AB SCIEX公司);HPLC -30A 型液相色谱系统(配有液相输液泵、自动进样器、柱温箱,日本岛津公司);AnaLyst TF 1.6 软件(美国AB SCIEX 公司);D3024 型台式高速微量离心机(美国赛洛捷克公司);MX -S 型固定式混匀仪(大龙兴创实验仪器有限公司)。
试药:盐酸文拉法辛(成都德斯特生物技术有限公司,批号为DST190111 -025,含量不低于98%);阿立哌唑(上海远慕生物科技有限公司,批号为J0215AS,含量不低于98%);盐酸文拉法辛缓释胶囊(惠氏制药有限公司,批号为X44212C,规格为每粒75 mg);阿立哌唑片(上海中西制药有限公司,批号为180357,规格为每片10 mg);咖啡因(内标,中国食品药品检定研究院,批号为171215 -2010,含量为99.9%);甲醇为色谱纯,水为超纯水,其余试剂均为分析纯。
2 方法与结果
2.1 受试者选择
纳入标准:年龄18 ~65 岁,性别不限;体质量指数(BMI)18 ~30 kg/m2;符合《国际疾病分类(第10 版)》(ICD -10)精神分裂症诊断标准;患者及法定代理人自愿参与本研究。
排除标准:脑器质性疾病所致精神障碍,精神活性物质所致精神障碍、心境障碍、神经官能症、精神发育迟滞诊断;合并器官功能障碍或其他严重系统性疾病;妊娠期或哺乳期;有吸毒史;试验前2 周内使用过其他药物;3 个月内参加临床研究;研究者认为不适宜参与本研究。
入组情况:本试验经河北医科大学第一医院医学伦理委员会批准。选择20 例精神分裂症患者,其中男6 例,女14 例;年龄20 ~43 岁,平均(32.15±6.12)岁;体质量55 ~64 kg,平均(59.25 ±2.67)kg;身高165 ~177 cm,平均(170.75 ±3.55)cm。
2.2 治疗方案及血液样本采集
患者口服盐酸文拉法辛缓释胶囊(150 mg / d)和阿立哌唑片(10 mg / d),于20 d 后清晨服药前0.5 h时,抽取肘静脉血5 mL,置含肝素钠的抗凝离心管中,3 000 r/min 离心10 min,分离血浆,保存在-80 ℃冰箱中,待测。
2.3 色谱与质谱条件
2.3.1 色谱条件
色谱柱:Phenomenex Kinetex XB-C18柱(50 mm ×3 mm,2.6 μm);流动相:甲醇(A)-2%甲酸水溶液(B)(70 ∶30,V/ V),等度洗脱;流速:0.4 mL/min;柱温:40 ℃;进样量:5 μL。
2.3.2 质谱条件
离子源:电喷雾离子源,多反应监测模式扫描,正离子检测模式;离子源喷射电压:5 500 V;离子源温度:600℃;气帘气(N2)压力:20psi;雾化气(N2)压力:55psi;辅助气(GS2,N2)压力:55 psi;碰撞气(N2):High;毛细管:入口电压为10 V,出口电压为10 V。质谱参数见表1。

表1 文拉法辛、阿立哌唑和咖啡因的质谱参数
2.4 溶液制备
对照品溶液:取文拉法辛对照品约10 mg,精密称定,置10 mL 容量瓶中,用甲醇溶解并稀释至刻度,混匀,配成质量浓度为1 mg/mL 的文拉法辛贮备液。用甲醇稀释贮备液,配成质量浓度分别为0.1,0.5,1,2,4,6,8 μg /mL 的文拉法辛标准曲线溶液,质量浓度分别为0.5,2,6 μg /mL 的文拉法辛质控样品溶液,置4 ℃保存备用。取阿立哌唑对照品约10 mg,精密称定,置10 mL容量瓶中,用甲醇溶解并稀释至刻度,混匀,配成质量浓度为1 mg/mL 的阿立哌唑贮备液。用甲醇稀释贮备液,配成质量浓度分别为0.2,0.5,1,2,4,6,8 μg/mL 的阿立哌唑标准曲线溶液,质量浓度分别为0.5,3,7 μg /mL的阿立哌唑质控样品溶液,置4 ℃保存备用。
内标溶液:取咖啡因对照品约1 mg,精密称定,置1 mL 容量瓶中,用甲醇溶解并稀释至刻度,混匀,配成质量浓度为1 mg /mL 的咖啡因内标贮备液。取内标贮备液适量,用甲醇稀释,配成质量浓度为1 μg/mL 的咖啡因内标溶液,置4 ℃保存备用。
2.5 血浆样品处理
取血浆100 μL,加入内标溶液10 μL、甲醇20 μL,涡旋30 s,加入甲醇270 μL,涡旋60 s,室温下15 000 r/min离心10 min,取上清液,过0.22 μm 微孔滤膜,取续滤液5 μL,进样分析。
2.6 方法学考察
专属性试验:分别取空白血浆、空白血浆+对照品标准溶液、患者用药1 h 后血浆样品各6 份,按血浆样品处理项下方法操作,得到相应样品色谱图。结果显示,文拉法辛、阿立哌唑和咖啡因的保留时间分别为0.58,0.67,0.64 min,血浆中内源性成分对文拉法辛、阿立哌唑和咖啡因的测定无干扰,专属性强。色谱图见图1。
标准曲线绘制和定量下限考察:取空白血浆100 μL,加入内标溶液和不同质量浓度的文拉法辛、阿立哌唑系列标准曲线溶液各10 μL,配成文拉法辛质量浓度分别为10,50,100,200,400,600,800 ng / mL,阿立哌唑质量浓度分别为20,50,100,200,400,600,800 ng/mL的系列血浆样品溶液,按“血浆样品处理”项下自“涡旋30 s”后同法操作,以待测物与内标的峰面积之比(Y)对待测物的质量浓度( X)进行线性回归,权重系数为1 / X2。结 果 显 示,文 拉 法 辛 的 标 准 曲 线 方 程 为 Y =4.87 ×103X +1.11 ×105(r =0.993 2), 线 性 范 围 为10 ~800 ng/mL,定量下限为10 ng /mL;阿立哌唑的标准曲线方程为Y=9.94×103X +1.69×105(r =0.992 8),线性范围为20 ~800 ng/mL,定量下限为20 ng /mL。
准确度与精密度试验:取空白血浆100 μL,加入内标溶液和不同质量浓度的文拉法辛、阿立哌唑质控样品溶液各10 μL,配成文拉法辛质量浓度分别为50,200,600 ng / mL 和阿立哌唑质量浓度分别为50,300,700 ng/mL 的系列血浆质控样品溶液各6 份,按“血浆样品处理”项下自“涡旋30 s”后同法操作,连续制备3 d并测定,分别计算准确度和日内、日间精密度的RSD。结果显示,日内、日间精密度的RSD 均小于15%,相对误差为-4.67 ~7.08,符合生物样品定量分析的相关要求。详见表2。

图1 文拉法辛、阿立哌唑和咖啡因高效液相色谱图
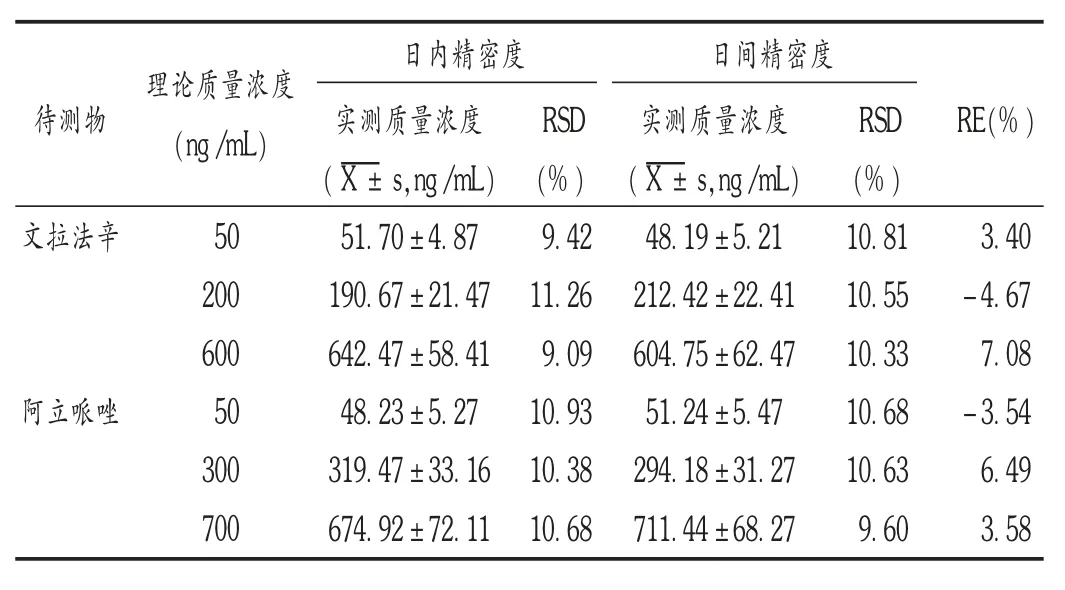
表2 血浆中文拉法辛和阿立哌唑的精密度和准确度试验结果(n =6)
提取回收试验:取不同质量浓度(文拉法辛质量浓度分别为50,200,600 ng/mL,阿立哌唑质量浓度分别为50,300,700 ng/mL)的血浆质控样品溶液各6 份,按“血浆样品处理”项下自“涡旋30 s”后同法操作,得相应 峰面积(A);同时,另取18 份100 μL 空白血浆,分成3 批,分别加入甲醇270 μL,涡旋60 s,室温下15 000 r/min 离心10 min,取上清液,过0.22 μm 微孔滤膜,取续滤液加入相应浓度的文拉法辛、阿立哌唑和咖啡因溶液适量,涡旋60 s,进样分析,得相应峰面积(B)。以A/ B 比值计算提取回收率。结果文拉法辛提取回 收 率 分 别 为(93.24 ±4.21)% ,(90.24 ±5.28)% ,(105.34 ±4.56)% , RSD 分 别 为 4.52% , 5.85% ,4.33%(n =6);阿立哌唑提取回收率分别为(94.35 ±3.17)% ,(110.24 ±6.74)% ,(94.28 ±3.21)% , RSD分别为3.36%,6.11%,3.40%(n =6);内标提取回收率为(93.67 ±2.44)%,RSD 为2.60%(n =6),符合生物样品定量分析的相关要求[10]。
基质效应考察:取空白血浆100 μL,按“血浆样品处理”项下自“涡旋30 s”后同法操作,得空白基质后,加入内标溶液和不同质量浓度的文拉法辛、阿立哌唑质控样品溶液各10 μL,配成文拉法辛质量浓度分别为50,200,600 ng/mL 和阿立哌唑质量浓度分别为50,300,700 ng /mL 的基质考察样品溶液各6 份,进样分析,得相应峰面积(C);用纯水代替血浆,加入内标溶液和不同质量浓度的文拉法辛、阿立哌唑质控样品溶液适量,配成文拉法辛质量浓度分别为50,300,700 ng /mL 和阿立哌唑质量浓度分别为50,300,700 ng /mL 的质控样品溶液各6 份,按“血浆样品的处理”项下自“涡旋30 s”后同法操作,得相应峰面积(D)。内标归一化的基质因子=C/ D ×100%。结果文拉法辛在3 个质量浓度下的平均内标归一化的基质因子分别为91.24% ,104.82%,107.32%(RSD <15%,n =6),阿立哌唑在3 个质量浓度下的平均内标归一化的基质因子分别为92.74%,102.51%,96.45%(RSD <15%,n =6),咖啡因的平均内标归一化的基质因子为104.81%(RSD <15%,n =6),提示样品测定不受基质效应影响。详见表3。

表3 基质效应试验结果(n =6)
稳定性考察:取不同质量浓度(文拉法辛质量浓度分别为50,200,600 ng/mL 和阿立哌唑质量浓度分别为50,300,700 ng/mL)的血浆质控样品溶液各24 份,分成4 批,分别考察在室温放置8 h、处理后室温放置3 d、反复冻融3 次、-40 ℃冻存1 周的稳定性。结果血浆质控样品在上述条件下均稳定,RSD 均小于15%(n =6)。详见表4。
2.7 临床应用
20 例精神分裂症患者文拉法辛的稳态血药浓度为140.62 ~483.54 ng/mL,阿立哌唑的稳态血药浓度为140.83 ~527.65 ng/mL。详见表5。
表4 稳定性试验结果(± s,n =6)
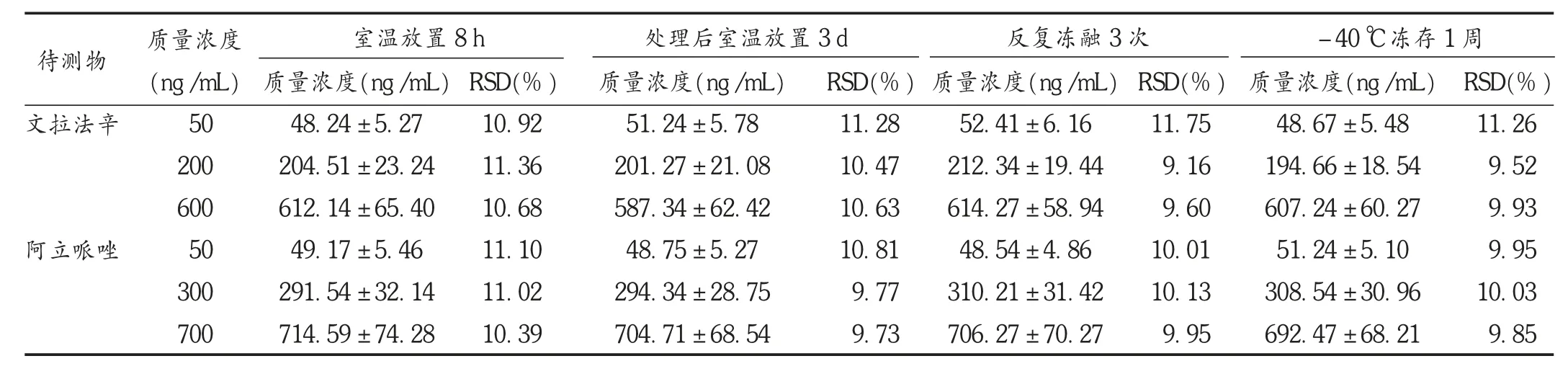
表4 稳定性试验结果(± s,n =6)
待测物文拉法辛阿立哌唑质量浓度(ng /mL)50 200 600 50 300 700室温放置8 h 处理后室温放置3 d 反复冻融3 次 -40 ℃冻存1 周质量浓度(ng /mL)48.24 ±5.27 204.51 ±23.24 612.14 ±65.40 49.17 ±5.46 291.54 ±32.14 714.59 ±74.28 RSD(%)10.92 11.36 10.68 11.10 11.02 10.39质量浓度(ng/mL)51.24 ±5.78 201.27 ±21.08 587.34 ±62.42 48.75 ±5.27 294.34 ±28.75 704.71 ±68.54 RSD(%)11.28 10.47 10.63 10.81 9.77 9.73质量浓度(ng /mL)52.41 ±6.16 212.34 ±19.44 614.27 ±58.94 48.54 ±4.86 310.21 ±31.42 706.27 ±70.27 RSD(%)11.75 9.16 9.60 10.01 10.13 9.95质量浓度(ng /mL)48.67 ±5.48 194.66 ±18.54 607.24 ±60.27 51.24 ±5.10 308.54 ±30.96 692.47 ±68.21 RSD(%)11.26 9.52 9.93 9.95 10.03 9.85

表5 20 例精神分裂症患者服药后血浆中文拉法辛和阿立哌唑的血药浓度监测结果
3 讨论
本研究中建立了能同时测定血浆中文拉法辛和阿立哌唑质量浓度的LC -MS/MS 法,与传统的HPLC 法及单一样品检测方法[6-7,10-11]相比,灵敏度及专属性均有提高,且缩短了分析时间。采用甲醇沉淀蛋白法处理血浆样品,与液-液萃取法[6-7,10]、固相萃取法[8]及乙腈沉淀蛋白[2,5]相比,提取回收率较高,操作简便、快速,有利于节约成本。
20 例精神分裂症患者给予临床常规剂量文拉法辛和阿立哌唑,达稳态时,测得文拉法辛的血药浓度为140.62 ~483.54 ng /mL,1 例患者高于其有效血药浓度100 ~400 ng/mL 范围[12];测得阿立哌唑的血药浓度为140.83 ~527.65 ng /mL,1 例患者低于其有效血药浓度150 ~500 ng/mL 范围[13-14],2 例患者高于该浓度范围。可见,这2 种药物在不同人群中存在一定的个体差异。文拉法辛联合阿立哌唑治疗精神分裂症,应监测治疗药物血药浓度,及时调整给药剂量,做到个体化用药,才能保证用药安全有效。
