胃饥饿素对小鼠肾缺血再灌注损伤模型的保护作用
2020-07-15王莉芳冯正平李晓春张金山
王莉芳,冯正平,李晓春,张金山
(1. 陕西省食品药品监督检验研究院,陕西 西安 710062; 2. 西北濒危药材资源开发国家工程实验室·药用资源与天然药物化学教育部重点实验室·陕西师范大学生命科学学院,陕西 西安 710062; 3. 中国人民解放军空军军医大学解剖与组织胚胎学教研室,陕西 西安 710062)
肾缺血再灌注导致肾脏血管内皮细胞和肾小管上皮细胞结构和功能的破坏,使细胞间的连接丧失,造成细胞凋亡、坏死而引起炎性反应,是引起急性肾损伤的重要因素[1-2],同时也是导致肾移植后功能恢复困难的主要因素,甚至可能出现急性肾功能衰竭,严重的可能导致死亡[3]。胃饥饿素是由28 个氨基酸组成的多肽,是生长激素促分泌素受体(GHS-R)的内源性配体[4],广泛分布于人、鼠及多种动物的中枢神经系统和外周组织器官中,如脑干、垂体、胃、肠、肝、肾等[5]。胃饥饿素与GHS-R 结合发挥作用,通过激活Ca2+释放进入细胞内,通过Ca2+刺激生长激素(GH)的释放[6]。本研究中选用C57 小鼠构建肾缺血再灌注损伤模型,探讨胃饥饿素对肾缺血再灌注损伤后的保护作用及其机制。现报道如下。
1 材料与方法
1.1 动物、仪器与试药
动物:成年C57 小鼠50 只,雄性,SPF 级,体质量18 ~22 g,购自成都达硕实验动物有限公司,动物许可证号为SYXK(陕)2013 -001。饲料及鼠笼均购自西安交通大学动物中心,大鼠饲养温度为18 ~22 ℃,相对湿度为50% ~60%,自然光照。
仪器:3131 型三气培养箱,1300 SERIES A2 型生物安全柜,均购自美国Thermo 公司;MCO-18AIC 型二氧化碳培养箱(日本SANYO 公司);Do X6 型全自动化学发光图像分析系统(上海天能公司)。
试药:SYBR®Premix Ex TaqTMⅡ(TaKaRa 公司);胃饥饿素(Sigma 公司);白细胞介素(IL)-1β,肿瘤坏死因子-α(TNF-α),IL-6,酶联免疫吸附(ELISA)试剂盒,均购自Invitrogen 公司;缺口末端标记(TUNEL)试剂盒(Roch 公司);HK-2 细胞(中科院细胞所);ERK 一抗,p-ERK 一抗,P38 兔一抗,p-P38 兔一抗,均采购于CST 公司;GHS-R,β-actin 兔一抗及HRP 标记兔二抗,均购自Abcam 公司;其他试剂均为分析纯。
1.2 方法
1.2.1 动物分组及模型制备
将已适应性喂养7 d 的C57 小鼠随机分为假手术组(A 组),模型组(B 组),胃饥饿素低、中、高剂量组(C1组、C2组、C3组),各10 只。A 组小鼠仅打开腹腔,游离双侧肾,不夹闭肾蒂;B 组、C1组、C2组、C3组小鼠称定质量后,腹腔注射戊巴比妥钠0.1 g/kg 麻醉,仰卧位固定于手术板上,腹部备皮后酒精消毒,做长约2 cm 的腹部正中切口,打开腹腔,左、右肾脂肪囊内游离双侧肾蒂,无创微血管夹夹闭,观察肾脏颜色,由红润变为灰白色表示夹闭有效,并开始计时,双侧肾缺血40 min 后移去血管夹,观察肾脏颜色,出现紫黑至恢复红润提示再灌注良好,手术线逐层关腹;C1组、C2组、C3组于再灌注时分别腹腔注射胃饥饿素10,20,40 μg/kg。各组小鼠在术前12 h 禁食不禁饮。恢复供血24 h 后,各组小鼠心脏采血并摘取双侧肾。
1.2.2 ELISA 法检测小鼠血清IL-1β,IL-6,TNF-α 水平
按ELISA 试剂盒说明书操作,取各组小鼠眼球血,每组4 只,分离血清,检测缺血再灌注后24 h 的IL-1β,IL-6,TNF-α 水平,用多功能微孔板检测仪(λ =450 nm)测定吸光度(A)。
1.2.3 肾组织过碘酸希夫反应(PAS)染色
肾组织切片,置95%乙醇中固定1 min,水洗后再将切片浸于1%过碘酸溶液中氧化5 min 后水洗,把切片放于雪夫试剂中染色5 min 后水洗,再以偏亚硫酸钠溶液浸泡1 min 后,水洗,自然晾干,滴加1 滴香柏油,置普通光学显微镜下观察。
1.2.4 TUNEL 法检测肾小管上皮细胞凋亡
将4%中性甲醛固定的肾组织常规石蜡包埋,脱蜡至水,不含DNase 蛋白酶K 消化,以链霉亲和素(streptavidin)工作液覆盖孵育样品,DAPI 复染封片。200倍显微镜下观察细胞核呈黄色为阳性的凋亡细胞。
1.2.5 实时荧光定量聚合酶链式反应(RT -PCR)检测肾组织中GHS-R 的表达
各组小鼠肾组织低温研碎后用Trizol 提取其总RNA,按TaKaRa PrimeScriptTM RT reagent Kit 试剂盒说明书将其反转成cDNA,根据SYBRP®remix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒步骤上机检测,结果通过计算2-△△Ct进行相对定量计算。
1.2.6 蛋白质印迹(WB)法检测肾组织GHS-R 的表达
低温研碎后的肾组织用RIPA 裂解液提取其总蛋白,30 μg 的蛋白样品在10%的SDS-PAGE 凝胶上分离,并转移到PVDF 膜上。PVDF 膜用5%脱脂牛奶封闭2 h。PVDF 膜在4 ℃温度下与GHS-R 和β-actin 一抗孵育过夜,再用1 ∶2 000 辣根过氧化物酶结合的二级抗体室温下孵育1 h。最后,蛋白条带以化学发光法显色获得。
1.3 统计学处理
采用Graphpad Prism 5 统计软件分析。实验数据经单因素方差分析(One -way ANOVA)表示,组间比较采用Tukey′s Multiple Comparisons Test。P <0.05 为差异有统计学意义。
2 结果
2.1 小鼠血清IL-1 ,IL -6、TNF- 表达水平
结果见表1。可见,肾缺血再灌注后,B 组中IL-1β,IL-6,TNF -α 表达水平均显著高于A 组(P <0.05);但胃饥饿素处理组(C1组、C2组、C3组)以上3 种指标水平均低于模型组,C2组和C3组显著降低(P <0.05),降低程度与胃饥饿素质量浓度呈正相关。
表1 各组小鼠血清IL -1 ,IL -6,TNF - 表达水平比较(± s,pg /mL,n =10)
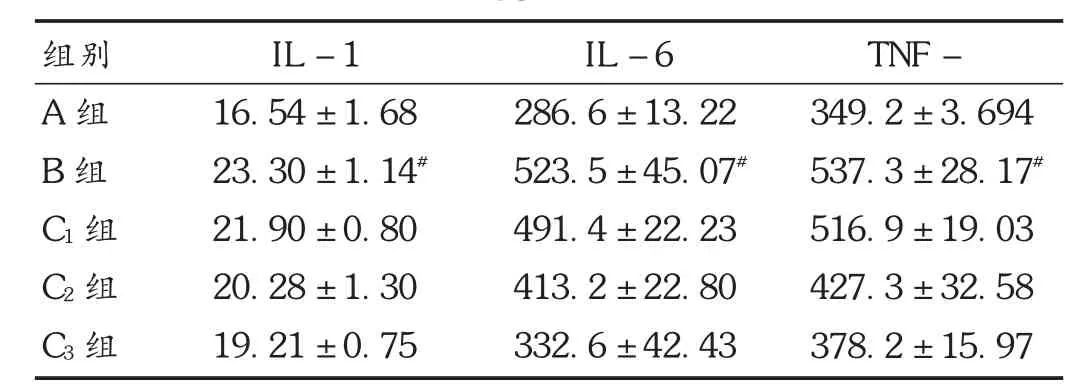
表1 各组小鼠血清IL -1 ,IL -6,TNF - 表达水平比较(± s,pg /mL,n =10)
注:与A 组比较,#P <0.05;与B 组比较, P <0.05。
组别A 组B 组C1 组C2 组C3 组IL -1 16.54 ±1.68 23.30 ±1.14#21.90 ±0.80 20.28 ±1.30 19.21 ±0.75 IL -6 286.6 ±13.22 523.5 ±45.07#491.4 ±22.23 413.2 ±22.80 332.6 ±42.43 TNF -349.2 ±3.694 537.3 ±28.17#516.9 ±19.03 427.3 ±32.58 378.2 ±15.97
图1 肾组织染色结果( ×200)
2.2 肾组织PAS 染色结果
结果见图1。可见,A 组肾组织结构清晰,肾小管上皮细胞完整、排列整齐、胞浆丰富;B 组肾小管排列紊乱、胞浆萎缩、细胞间质增宽,肾小管上皮细胞肿胀,出现空泡变性,纹状缘消失,肾间质炎性细胞浸润,出现明显的肾损伤。与B 组比较,C1组、C2组和C3组的肾损伤依次明显减弱,炎性反应减弱,其中C2组基本接近A 组水平。
2.3 TUNEL 染色结果
结果见图1。可见,A 组基本无细胞凋亡出现,B 组中肾细胞出现明显凋亡现象,C1组、C2组和C3组肾细胞的凋亡程度下降,且有随着胃饥饿素浓度升高而降低的趋势。
2.4 肾组织中GHS -R mRNA 水平的表达
结果见图2。可见,肾缺血再灌注后,B 组肾组织中GHS-R 转录水平表达量显著低于A 组(P <0.01),C1组的GHS-R 转录水平表达量与B 组相比无显著差异,C2组和C3组有不同程度的升高,且具有显著性(P <0.01),基本达到A 组表达量。
2.5 肾组织中GHS -R 蛋白水平的表达
结果见图3。可见,与A 组比较,B 组中GHS-R 蛋白显著降低(P <0.01);C1组、C2组、C3组的GHS-R蛋白水平表达较B 组均有不同程度升高,但C1组无显著差异,C2组和C3组均显著升高(P <0.05),与转录水平的趋势具有一致性。
3 讨论

图2 肾组织中GHS -R mRNA 水平的表达
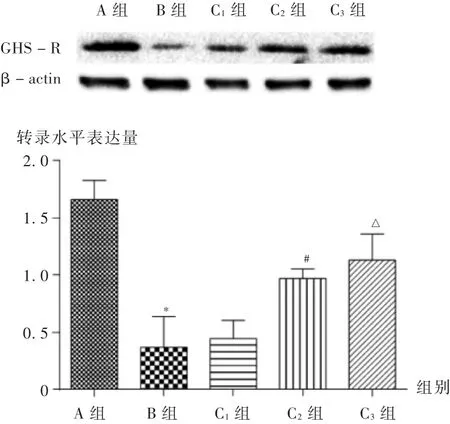
图3 肾组织中GHS -R 蛋白水平的表达
肾脏的血流量非常丰富,具有血液代谢废物过滤及生成尿液排出体外的功能,人双侧肾脏的血液灌注可达到1 200 mL /min,是人体重要的器官之一。肾脏对缺血缺氧十分敏感,缺血后,肾细胞就开始积累代谢废物,出现细胞凋亡。血液重新灌注后,肾组织的功能不能得到立刻恢复,反而会进一步加剧损伤[7]。缺血再灌注模型损伤的病理反应与细胞凋亡和炎性反应关系密切,主要是在缺血再灌注模型过程中出现缺氧,导致氧自由基大量聚集,致使细胞DNA 断裂,从而诱发细胞凋亡[8]。同时,在缺血再灌注损伤过程中会导致大量炎性因子的释放,引起一系列炎性级联反应,结合相关受体,也会激活相关凋亡基因,导致细胞凋亡[9-11]。
胃饥饿素在肾脏中可激活抗氧化应激机制,保护免受血管紧张素Ⅱ(Ang Ⅱ)引起的肾脏损害[12]。RAJAN等[13]发现,胃饥饿素可能通过迷走神经对动物肾缺血再灌注损伤有防护作用。TAKEDA 等[14]研究发现,胃饥饿素可能通过胰岛素样生长因子-1 介导改善内皮功能来保护肾脏免受缺血再灌注损伤。这也提示胃饥饿素可能通过多种途径对肾缺血再灌注损伤起防护作用。
本研究结果显示,肾缺血再灌注模型损伤后,B 组炎性因子IL -1β,IL-6,TNF-α 较A 组显著升高,且肾组织的PAS 染色结果显示,炎性细胞浸润;肾组织切片结果显示,细胞有凋亡现象,同时GHS-R 的基因和蛋白水平表达均显著降低。再灌注时不同质量浓度胃饥饿素预处理后,发现各组中IL-1β,IL -6,TNF-α 表达水平下降,肾组织的损伤减弱,且炎性症状消除,同时凋亡细胞数量减少,GHS-R 的表达量升高,且这些表现与胃饥饿素的质量浓度呈正相关。结果显示,胃饥饿素的预处理能有效减少肾缺血再灌注模型损伤后的炎性反应及细胞凋亡情况,减轻了肾损伤的病理性改变,且促进GHS-R 的表达。提示胃饥饿素能减少肾缺血再灌注模型损伤后的炎性反应,而炎性反应的减弱有助于肾缺血再灌注模型损伤后功能的恢复,同时炎性因子的减少可能抑制凋亡基因的激活,进一步减少细胞的凋亡,但有待于进一步研究。肾缺血再灌注模型损伤后胃饥饿素受体GHS-R 的表达显著降低,胃饥饿素处理后GHS-R 的表达升高,且高剂量胃饥饿素处理后能达到缺血再灌注模型损伤前水平,提示肾缺血再灌注模型损伤后生长素的减少可能是其损失加重的因素,胃饥饿素能通过增加GHS-R 的表达,两者结合后能刺激GH 的释放,起到对肾缺血再灌注损伤模型的保护作用。
