不同种猪品种对克隆胚胎体内外发育的影响
2020-07-14李志伟袁曼曼齐晓红
李志伟 袁曼曼 齐晓红


摘要 [目的]促进体细胞克隆技术的大规模产业化应用。[方法]以长白猪、杜洛克猪2个品种种猪不同个体的耳部成纤维细胞为供体细胞,体外构建克隆胚胎,并对其克隆胚胎体内外发育以及产仔情况进行研究。[结果]长白猪、杜洛克2个品种种猪克隆胚胎分裂率、囊胚率分别为100%和 83.7%、31.3%和19.1%。将来源于2个品种不同个体供体细胞的共3 419枚体外构建克隆胚胎移植给19头代孕母猪,结果发现16头代孕母猪共产下64头克隆仔猪;长白猪和杜洛克猪受孕率分别为83.3%和84.6%,平均窝产仔数分别为(1.7±2.87)和(2.0±2.3)头,平均初生重分别为(0.92±0.35)和(1.18±0.39)kg,以上指标2个品种间均差异不显著。长白猪克隆效率为0.84%,显著低于杜洛克猪(2.42%)。[结论]该研究比较了不同种猪品种克隆胚胎体内外发育以及出生情况,证明来源于成年种猪的耳部组织成纤维细胞可以有效用于克隆种猪,但克隆效率存在品种差异。
关键词 体细胞克隆;组织冻存;胚胎移植;克隆仔猪
Abstract [Objective] To promote the largescale industrial application of somatic cell cloning technology.[Method]The embryos were cloned by using the fibroblast cells from ear tissues of Landrace and Duroc as donor cells,and then their development in vitro and in vivo and farrowing situation were studied.[Result]The ear fibroblast cells from both breeds above had excellent cell viability,the average cleavage rate and average blastocyst rate of the cloned embryos reached 100% and 83.7%(P<0.05),and 31.3% and 19.1% (P>0.05),respectively.After that,3 419 cloned embryos were transferred to 19 surrogate sows,among which 16 surrogate sows were conceived and littered,and 64 piglets were born.The conception rate,average litter size,average birth weight,and cloning efficiency of Landrace and Duroc reached 83.3% and 84.6%,(1.7±2.87)and (2.0±2.3),(0.92±0.35) and(1.18±0.39) kg,0.84% and 2.42%,respectively.[Conclusion]This study indicated that fibroblast cells from ear tissues of adult pigs could be successfully used for pig cloning industry,although the cloning efficiency could be significantly different between porcine breeds.
Key words Somatic cell nuclear transfer;Tissue cryopreservation;Embryo transfer;Cloned piglets
体细胞核移植(somatic cell nuclear transfer,SCNT)是指利用一定的设备和技术,人工将动物的體细胞核与已经去除核遗传物质的卵母细胞进行体外融合,组成重构胚并在体外人工环境条件下发育至一定阶段后,人工转移入代孕母体生殖道内,继续发育成新的动物个体,以生产出大量遗传同质后代的过程。SCNT技术的本质是无性繁殖,又称为克隆技术。2000年,克隆猪技术诞生,并成功获得了体细胞克隆后代[1-2],宣告了一个全新的生物技术时代的到来。自此,克隆猪技术在畜牧业[3]、生物医学[4-6]、野生濒危动物保护[7-8]等领域发挥了重要作用,并具有较高的应用价值和广阔的发展前景。利用克隆技术可以快速、有效地扩繁优质种猪后代,稀释种猪育种成本,有助于优质种质资源保护,并缩短猪品种遗传改良的进程[9];此外,克隆技术还可以结合基因编辑技术、全基因组选育技术和试管猪技术等[10],培育出基因编辑猪群体,为猪品种改良、人类疾病和异种器官移植等领域作出贡献[11-15]。
南方医科大学研究团队以中国本土小型猪品系猪种为试验动物,利用SCNT技术获得了3只具有皮肤特异性表达pDKK1(pig Dickkopfrelated protein 1)基因的DKK1(Dickkopfrelated protein 1)转基因克隆猪,研究结果为探索DKK1基因在猪皮肤生长、毛囊发育等方面的功能提供了猪模型[16]。Hwang等[17]利用SCNT技术成果获取了1只健康的猪白细胞抗原(SLA)同型的体细胞克隆韩国本地猪种,且建立了相应的克隆体系,克隆效率为0.65%~1.08%。Zhao等[18]以欧洲野猪为试验动物,首次研究了抗坏血酸对猪克隆胚胎去甲基化的作用机制,根据该研究结果,建议用于SCNT胚胎发育的培养基应补充抗坏血酸。Jin等[19]通过不同的试验技术尝试提高从供体细胞到受体的克隆过程不同阶段猪的克隆效率,结果发现该研究中使用的方法可能有助于提高猪的克隆效率。
体细胞核移植技术发展已有20多年,尽管越来越多的学者不断地对该技术进行探索,克隆技术也日臻完善,但哺乳动物克隆效率仍普遍较低。猪的克隆效率为0.5%~3.0%[20-21]。限制猪体细胞克隆效率的因素目前一般包括2个方面:一方面,猪卵母细胞含有大量的脂肪滴,对温度等条件特别敏感;另一方面,猪是多胎动物,其妊娠的建立和维持至少需要4枚以上优质囊胚同时着床,需要移植大量的克隆胚胎才能保证产生足够的妊娠识别信号[22]。同时,供体细胞类型的选择和制备是提高克隆效率的关键步骤,经过大量的试验,学者们对供体细胞的类型、供体来源、体外培养时间等方面进行了大量试验[23-24],通过比较猪胎儿成纤维细胞、成体成纤维细胞、成体前脂肪细胞和颗粒细胞等作为核移植供体细胞构建重组胚胎的发育能力,结果表明成纤维细胞是作为核移植供体细胞最合适的细胞类型[25-27]。
笔者所在实验室前期研究结果表明,猪耳部成纤维细胞不仅具备完整的个体遗传信息,而且具有优异的细胞活性,取材后对供体动物的健康没有任何影响。杜洛克猪是瘦肉型猪种之一,具有体质结实、适应性强、生长发育快、饲料利用率、肉质较好等优良特性,相较于其他品种,仔猪初生重较大;长白猪同样作为瘦肉型猪种,具有饲料利用率高、瘦肉率高、母猪产仔多、泌乳性能好等优点。该研究采集这2个品种种猪不同成年个体的耳部成纤维细胞作为供体细胞,初步探讨不同种猪品种对体细胞克隆技术效率的影响,旨在为进一步提高种猪克隆效率并促进该技术的大规模应用奠定基础。
1 材料与方法
1.1 试验地点 实验室工作在河南创源生物技术有限公司实验室完成,养殖工作在漯河养殖场完成。
1.2 试剂
“方舟计划”组织冻存套装包括Stericome Solution 组织消毒液,Flushcome Solution 组织清洗液、Cryocome Solution 组织冻存液。
“方舟计划”冷冻组织高效细胞分离建系试剂盒包括Digestcome Solution A 组织消化液A、Digestcome Solution B组织消化液B、Dissocome Solution P1.0细胞解离液P1.0、Pricome Solution P1.0 细胞培养液 P1.0、Cryoone Solution P1.0细胞冻存液 P1.0。
胚胎体外构建及操作液体包括Washcome medium P1.0卵母细胞洗液、Matcome medium P1.0卵母细胞成熟液、Blacome medium P1.0胚胎培养液、Mancome medium P1.0卵母细胞显微操作液、Fusioncome medium P1.0融合激活液、Transcome medium P1.0胚胎移植液。
以上试剂均为河南创源生物技术有限公司提供的商品化试剂,其他试剂、药品除特别注明外,均购自Sigma公司。
1.3 主要仪器与耗材
体式显微镜(Nikon)、超低温冰箱(中科都菱)、显微操作仪(Nikon)、电融合仪(ECM-2001)等;12孔培养板、4孔培养板、15 mL/50 mL离心管等细胞培养耗材均为Corning公司产品。
1.4 试验方法
1.4.1 卵母细胞收集和体外成熟。
猪卵巢采集于当地某屠宰场,摘取新鲜卵巢并立即置于盛有33~35 ℃生理盐水的保温瓶中,3 h内送回实验室,用10 mL注射器(12号针头)抽吸直径3~7 mm的卵泡。在显微镜下挑选胞质均匀的卵母细胞并于Washcome medium P1.0液中洗3次,然后在卵母细胞成熟液Matcome medium P1.0中洗2次并置于四孔培养板中,于38.5 ℃、5%CO2的CO2培养箱体外成熟42~45 h。显微镜下挑选成熟好的胞质均匀且含有第一极体的卵母细胞备用。
1.4.2 供体细胞分离培养。
分别随机选择长白成年种公猪2头、杜洛克成年种公猪3头作为供体猪(所选种猪年龄均在2岁以内),采集耳部组织,按照组织冻存试剂盒标准采样流程进行采样后,4 ℃低温条件下将样本带回实验室。实验室内按照组织冻存试剂盒标准流程进行组织冻存,样本存放在-80 ℃冰箱或液氮中。利用冷冻组织高效细胞分离建系试剂盒标准操作流程进行细胞分离培养、细胞冻存或扩增传代以备克隆使用,待供体细胞达到80%汇合度后,接触抑制1~2 d内使用,且供体细胞一般使用1~3代以內。
1.4.3 重构胚构建以及体外发育测试。
在显微操作仪上,在Mancome medium P1.0显微操作液中用固定针固定MⅡ期卵母细胞,用15~18 μm去核针吸取极体附近的胞质,然后利用活细胞荧光染料Hochest33342进行染色,荧光显微镜下挑选成功去核的卵母细胞作为受体胞质;在显微镜下细胞大小均匀,折光性好、细胞表面光滑的供体细胞进行透明带下注射完成胚胎体外构建。将构建好的重构胚置于融合液Fusioncome medium P1.0中,用电融合仪ECM2001进行电融合、激活(场强为100 V/mm,3次脉冲,脉冲时间为30 μs)。然后,将融合、激活后的重构胚转移到添加细胞松弛素的Blacome medium P1.0胚胎培养液中,CO2培养箱(38.5 ℃、5% CO2)中培养3 h,此后再移入Blacome medium P1.0胚胎培养液,2、7 d时分别观察胚胎分裂数、囊胚数并记录。
1.4.4 克隆胚胎体内移植以及克隆猪生产。
代孕母猪均为二元母猪,胎次不等,选择的代孕母猪均有良好的繁殖记录。利用2头长白公猪个体供体细胞分别制作3头份克隆胚胎,并随机移植给6头代孕母猪;随机利用3头杜洛克公猪个体供体细胞,分别制作3、5和5头份克隆胚胎(每头份克隆胚胎数量在150枚左右,胚龄约为0.5~2.0 d),随机移植给10头代孕母猪。选择断奶3~5 d的代孕母猪,并在代孕母猪发情高峰期开始后2 d内进行胚胎移植,手术前一天下午停喂饲料,手术当天将构建完成的优质克隆胚胎利用Transcome medium P1.0胚胎移植液于12 h内带入猪场。手术法将优质克隆胚胎从输卵管伞部缓慢注入输卵管。术后受体母猪单栏饲养,连续5 d注射抗生素防止炎症发生,移植后密切观察愈后情况。分别于胚胎移植后的21~28 d进行第一次孕检,49~56 d进行第二次孕检,大约114 d后记录代孕猪分娩头数和产仔情况。
1.5 数据处理方法
针对此次试验中不同种猪品种的克隆胚胎发育及产仔数据,利用SPSS 19.0统计软件进行分组间差异显著性分析,分组间分裂率、囊胚率、妊娠率采用二项式检验分析其差异性,分组间窝均产仔数、平均初生重采用独立样本t测驗方法分析其差异性,各组间克隆效率采用卡方检验分析其差异性,P<0.05表示差异显著。
2 结果与分析
2.1 猪耳部成纤维细胞分离培养
按照组织冻存试剂盒标准操作流程,将长白猪、杜洛克猪耳部组织进行组织冻存,并储存于-80 ℃冰箱中,方便开展各种检测。然后,利用冷冻组织高效分离试剂盒标准流程解冻冷冻组织,并进行细胞分离培养,结果显示第3天开始有小三角形、梭形细胞爬出;第5~7天,梭形细胞优势生长,为典型的流水状生长,细胞生长旺盛,当细胞汇合度达80%以上时进行传代或细胞冷冻(图1)。
2.2 克隆胚胎体内外发育及出生情况
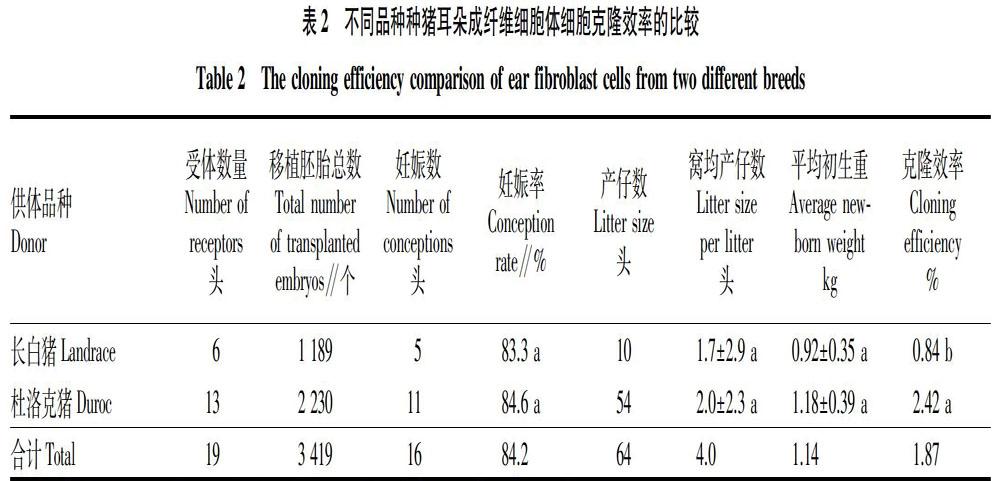
分别用长白猪、杜洛克猪2个品种不同个体的供体细胞构建重构胚,并比较其体内外发育情况以及仔猪出生情况。由表1可知,长白猪与杜洛克猪克隆胚胎分裂率、囊胚率分别为100%和 83.7%、31.3%和19.1%,2个品种分裂率差异显著(P<0.05),而2个品种间囊胚发育率差异不显著(P>0.05)。分别将来源于长白猪和杜洛克猪不同个体的供体细胞体外构建克隆胚胎(长白猪,1 189枚;杜洛克猪,2 230枚),然后分别移植到代孕母猪体内(长白猪,6头;杜洛克猪,13头),其受胎率分别为83.3% 和84.6%,2个品种间差异不显著(P>0.05);平均窝产仔数和平均初生重分别为1.7和2.0头、0.92和1.18 kg,这2个指标在2个品种间均差异不显著;其总克隆效率分别为0.84%和2.42%,差异显著(P<0.05)(表2)。胚胎体内外发育及克隆猪情况见图2。
3 讨论
体细胞克隆环节涉及供体细胞制备、卵母细胞成熟培养、重构胚构建及激活、重构胚体外培养和胚胎移植等环节,每个技术环节都会影响克隆的效率。在这些环节中,供体细胞的制备、卵母细胞成熟培养和重构胚构建尤为重要。供体细胞的类型多种多样,并且有多种类型的体细胞被证实具有完全的克隆发育能力,并作为供核细胞,成功得到了克隆后代[28-29]。但目前使用最广泛的是胎儿成纤维细胞和新生猪耳组织成纤维细胞,这是由于其增殖能力强,易于转染,且形成的重构胚发育率较高,尤其是皮肤成纤维组织,取材方便,试验成本低。虽然有研究表明,猪胎儿成纤维细胞的生长速度快于皮肤成纤维细胞,也就是说其生长活力优于皮肤成纤维细胞,且分化程度较低,便于进行基本修饰等操作,更适合作为供核细胞[30-31],甚至有研究表明胎儿成纤维细胞的克隆效率略高于皮肤成纤维细胞[24],但制备猪胎儿成纤维细胞会受到试验成本及动物福利等因素的影响,因此根据笔者所在实验室前期的研究成果,该试验选取耳部成纤维细胞作为供核细胞。
马红[32]研究表明采用出生7 d以内的仔猪耳尖组织培养成纤维细胞,并以此作为供核细胞,结果发现重构胚卵裂率为65.6%,囊胚率为17.8%。另外,也有研究学者利用成年猪耳部成纤维细胞作为供核细胞,最终重构胚囊胚率达9.4%[33]。该研究中将冷冻的成年猪耳部组织解冻复苏后,进行细胞分离,成功获得了原代成纤维细胞,且细胞生长旺盛且形态良好,以该细胞作为供体细胞,可以支持克隆胚胎完全的体外和体内发育潜能。同时,组织冷冻法并不影响其活性,且为体细胞克隆提供了一定的技术保障。
该研究结果表明长白猪的卵裂率显著高于杜洛克猪(P<0.05),而2个品种的囊胚率不存在显著差异(P>0.05)。这有可能是因为品种特性不同及试验所用样本数量不同,但总体来说平均卵裂率和囊胚率较高,可进行样本数量扩大试验。对比前人的研究结果,也说明该试验重构胚的发育效率较高,试验系统较为稳定,可以大批量制备重构胚,以供下一步克隆所用。
将构建完成的重构胚移植给代孕母猪,整体受孕情况较好,整体克隆效率也较高(1.87%)。有研究学者对影响克隆效果的供体细胞类型和胚胎移植数目等因素进行了研究[19,34-36],结果发现移植克隆胚胎的最优数量为150~249个,受孕率为30%~90%,克隆效率为0.70%~1.62%;对比国内外猪克隆效率,笔者所在实验室的受体母猪受孕率和克隆效率均相对较高,其中长白猪受孕率约83.3%,杜洛克猪受孕率约84.6%,且2个品种间受孕率不存在显著差异(P>0.05)。虽然2个品种间的平均窝产仔数和仔猪初生重均不存在显著差异(P>0.05),但杜洛克猪的平均窝产仔数和仔猪初生重均高于长白猪,且杜洛克猪的克隆效率显著高于长白猪(P<0.05)。根据长白猪产仔数较多,杜洛克猪仔猪初生重较大的品种特点,该试验结果中杜洛克猪的仔猪初生重高于长白猪,可能是由品种差异所致,而长白猪平均窝产仔数少于杜洛克猪,可能是由于样本数量不同或长白猪遗传稳定性较差所导致的,结果表明杜洛克猪遗传特性较为稳定,且生产性能表现良好,在避免高温高湿环境下生长,可使具有快长基因的杜洛克猪发挥遗传潜力[37]。该试验结果表明,杜洛克猪较高的克隆效率可能是因为其较好的品种特性及遗传潜力所致。
4 结论
综上所述,利用组织冻存技术以及冷冻组织细胞分离技术,分离成年种猪耳部成纤维细胞,体外构建克隆胚胎可以支持体内、外发育以及克隆动物出生,为推进体细胞克隆技术大规模应用于种猪克隆奠定基础。
参考文献
[1] POLEJAEVA I A,CHEN S H,VAUGHT T D,et al.Cloned pigs produced by nuclear transfer from adult somatic cells[J].Nature,2000,407:8690.
[2] ONISHI A,IWAMOTO M,AKITA T,et al.Pig cloning by microinjection of fetal fibroblast nuclei[J].Science,2000,289(5482):1188-1190.
[3] STEINBORN R,SCHINOGL P,WELLS D N,et al.Coexistence of Bos taurus and B.indicus mitochondrial DNAs in nuclear transferderived somatic cattle clones[J].Genetics,2002,162(2):823-829.
[4] BROPHY B,SMOLENSKI G,WHEELER T,et al.Cloned transgenic cattle produce milk with higher levels of βcasein and κcasein[J].Nat Biotechnol,2003,21(2):157-162.
[5] HWANG W S,RYU Y J,PARK J H,et al.Evidence of a pluripotent human embryonic stem cell line derived from a cloned blastocyst[J].Science,2004,303(5664):1669-1674.
[6] CHEN Y,HE Z X,LIU A L,et al.Embryonic stem cells generated by nuclear transfer of human somatic nuclei into rabbit oocytes[J].Cell Res,2003,13(4):251-263.
[7] LOI P,PTAK G,BARBONI B,et al.Genetic rescue of an endangered mammal by crossspecies nuclear transfer using postmortem somatic cells[J].Nat Biotechnol,2001,19(10):962-964.
[8] LANZA R P,CIBELLI J B,DIAZ F,et al.Cloning of an endangered species (Bos gaurus) using interspecies nuclear transfer[J].Cloning,2000,2(2):79-90.
[9] 吳亚林,李继良,周伟良,等.猪体细胞克隆胚胎移植技术要点分析[J].农业生物技术学报,2019,27(6):1126-1132.
[10] RUAN J X,XU J,CHENTSAI R Y,et al.Genome editing in livestock:Are we ready for a revolution in animal breeding industry?[J].Transgenic research,2017,26(6):715-726.
[11] 李继连,王丽,胡满.哺乳动物体细胞克隆技术应用的研究进展[J].中国畜牧兽医,2011,38(6):98-102.
[12] 史伟平,吴琳,赵庆新.生物科学中的克隆与克隆技术[J].生物学教学,2013,38(2):69-71.
[13] 张廷宇,顾晓龙,吴彩凤,等.猪转基因克隆技术的研究与应用[J].上海农业学报,2011,27(1):107-110.
[14] PRATHER R S,LORSON M,ROSS J W,et al.Genetically engineered pig models for human diseases[J].Annual review of animal biosciences,2013,1(1):203-219.
[15] KLYMIUK N,SEELIGER F,BOHLOOLYY M,et al.Tailored pig models for preclinical efficacy and safety testing of targeted therapies[J].Toxicologic pathology,2016,44(3):346-357.
[16] LIU W,WU L H,YUE M,et al.Generation of DKK1 transgenic Tibet minipigs by somatic cell nuclear transfer (SCNT)[J].Oncotarget,2017,8(43):74331-74339.
[17] HWANG I S,KWON D J,OH K B,et al.Production of cloned Korean native pig by somatic cell nuclear transfer[J].Development & reproduction,2015,19(2):79-84.
[18] ZHAO M H,HUR T Y,NO J,et al.Ascorbic acid increases demethylation in somatic cell nuclear transfer embryos of the pig (Sus scrofa)[J].AsianAustralasian journal of animal sciences,2017,30(7):944-949.
[19] JIN Y,ZHANG M L,JU X R,et al.Factors influencing the somatic cell nuclear transfer efficiency in pigs[J].Frontiers of agricultural science and engineering,2019,6(1):73-80.
[20] CALLESEN H,LIU Y,PEDERSEN H S,et al.Increasing efficiency in production of cloned piglets[J].Cellular reprogramming,2014,16(6):407-410.
[21] WILMUT I.Embryo stem cells from parthenotes and embryos produced by nuclear transfer:The distinction between them and their potential value in cell therapy[J].Cloning Stem Cells,2007,9(3):291-292.
[22] LI R F,LAI L X,WAX D,et al.Cloned transgenic swine via in vitro production and cryopreservation[J].Biol Reprod,2006,75(2):226-230.
[23] LI Z C,SHI J S,LIU D W,et al.Effects of donor fibroblast cell type and transferred cloned embryo number on the efficiency of pig cloning[J].Cellular reprogramming,2013,15(1):35-42.
[24] LIU T B,DOU H W,XIANG X,et al.Factors determining the efficiency of porcine somatic cell nuclear transfer:Data analysis with over 200,000 reconstructed embryos[J].Cellular reprogramming,2015,17(6):463-471.
[25] 劉吉宏.体细胞克隆猪胚胎制备及鉴定的研究[D].扬州:扬州大学,2008.
[26] 朱向星,孙俊丽,谢炳坤,等.广西巴马小香猪体细胞克隆[J].生物资源,2018,40(5):383-390.
[27] 华再东,魏庆信,郑新民,等.猪体细胞克隆技术研究进展[J].湖北农业科学,2011,50(7):1309-1312.
[28] 朱向星,全守能,卢晟盛.广西巴马小型猪转基因克隆胚胎的体外生产[J].基因组学与应用生物学,2015,34(1):41-46.
[29] 黄勇,朱向星,全守能,等.电转染法电压优化与广西巴马小型猪转基因克隆胚胎的生产[J].基因组学与应用生物学,2014,33(2):348-356.
[30] 闵江涛.绵羊体外胚胎生产技术的研究[D].南京:南京农业大学,2014.
[31] 刘晓.影响猪体细胞克隆胚胎生产效率因素的研究[D].北京:中国农业科学院,2008.
[32] 马红.供核细胞来源对猪克隆胚胎发育的影响[J].黑龙江农业科学,2013(12):54-57.
[33] 潘登科,张运海,孙秀柱,等.供体细胞对猪体细胞克隆胚胎早期发育的影响[J].畜牧兽医学报,2006,37(4):331-336.
[34] ZHAO J G,HAO Y H,ROSS J W,et al.Histone deacetylase inhibitors improve in vitro and in vivo developmental competence of somatic cell nuclear transfer porcine embryos[J].Cellular reprogramming,2010,12(1):75-83.
[35] CALLESEN H,LIU Y,PEDERSEN H S,et al.Increasing efficiency in production of cloned piglets[J].Cellular reprogramming,2014,16(6):407-410.
[36] KOO O J,KANG J T,KWON D K,et al.Influence of ovulation status,seasonality and embryo transfer method on development of cloned porcine embryos[J].Reprod Domest Anim,2010,45(5):773-778.
[37] 成霞林.新美系杜洛克猪的行为观察与性能测定的研究[D].长沙:湖南农业大学,2014.
