长链非编码RNA PVT1通过miR-17-5p调控肝癌细胞增殖与迁移的机制研究
2020-07-13崔士猛罗海峰闻庆平
崔士猛,杜 渐,罗海峰,闻庆平,苗 壮,温 超,吴 越
研究表明[1-2]长链非编码RNA (long non-coding RNA, lncRNA)在多种癌症类型的基因组改变、诊断、预后和治疗预测中发挥着关键作用。到目前为止,lncRNA在肝细胞癌(hepatocellular carcinoma, HCC)中已被证实在肿瘤细胞生长、化疗敏感性、药物诱导的细胞凋亡、肿瘤干细胞调控、治疗结果预测和病毒性肝炎相关进展中发挥重要作用[3-5]。因此,lncRNA作为HCC发病机制的调控因子,被认为是潜在的癌症治疗靶点。
TCGA数据库表明PVT1在HCC组织中表达明显上调。课题组的细胞水平研究显示,PVT1促进了HCC细胞增殖与迁移;通过生物信息学软件预测提示PVT1存在与miR-17-5p靶向结合的位点;而miR-17-5p在HCC中常呈低表达并影响其发生发展。现通过实验证明PVT1与miR-17-5p之间存在特异性调控关系,进而影响HCC细胞的增殖和迁移能力,为PVT1调控HCC细胞的分子机制奠定了理论基础。
1 材料与方法
1.1 材料细胞株HepG2和Huh7购自上海中乔新舟公司;DMEM、胎牛血清及胰酶均购自美国Gibco公司。培养基通过DMEM添加10%胎牛血清进行配置,4 ℃保存不超过1周。细胞培养于37 ℃、5% CO2的培养箱中,每1~2 d换液1次,待细胞生长融合度达到80%~90%对细胞进行传代。
RIPA裂解液、BCA试剂盒、TRIzol提取试剂均购自北京碧云天公司;cDNA逆转录试剂盒及SYBR Green RealTime PCR MasterMix购自美国Invitrogen公司;CCK-8试剂盒及Lipofectamine 3000购自美国Invitrogen公司;lncPVT1及siPVT1由上海吉玛公司构建;miR-17-5p模拟物、抑制剂及阴性对照寡核苷酸由上海吉玛基因设计及合成;双荧光素报告基因试剂盒购自美国Invitrogen公司。
1.2 方法
1.2.1细胞转染 转染前对细胞进行观测,待细胞融合度达到50%~70%时对细胞进行si-PVT1及miRNA的转染,NC为空载体,作为阴性对照。使用Lipofectamine 3000染试剂进行转染实验,根据说明书步骤将细胞放入培养箱37 ℃、5% CO2的环境培养6 h左右,随后对细胞进行换液。提取RNA在转染后24 h,蛋白提取在转染后48~72 h。si-PVT1由吉玛基因设计并构建:F:5-ATAGGATCCCGATGCTGGG-3, R:5-ATACGCTCGAGTCCGGAG-3。
1.2.2PCR定量 使用TRIzol对处理后的细胞进行总RNA提取,随后加入氯仿进行12 000 r/min 离心20 min,获取上清液,并加入异丙醇-20 ℃过夜,第2天进行12 000 r/min离心20 min,随后使用75%乙醇进行清洗。NanoDrop检测RNA的浓度及纯度。随后进行逆转录合成cDNA。PVT1-F:5′-TGAGAACTGTCCTTACGTGACC-3′,PVT1-R:5′-AGAGCACCAAGACTGGCTCT -3′;miR-17-5p-F:5′-CGGCGGCAAAGTGCTTACAG-3′,miR-17-5p-R:5′-GTGCAGGGTCCGAGGT-3′;GAPDH-F: 5′-TGTTCGTCATGGGTGTGAAC-3′,GAPDH-R: 5′- ATGGCATGGACTGTGGTCAT -3′。
1.2.3双荧光素酶实验 将野生型Wt-PVT1和突变型Mut-PVT1序列插入到pGL4.74载体中,构建Luc-PVT1-WT和Luc-PVT1-MUT。所有的细胞24孔板过夜后,进行Luc-PVT1-WT/Luc-PVT1-MUT与miR-17-5p共转染,共转染时间12~24 h。采用双荧光素酶报道系统检测荧光素酶活性。
1.2.4CCK-8实验 以2×103/孔的细胞量将细胞接种于96孔板中,设置3个复孔,置于恒温培养箱中培养24 h,24 h后使用CCK-8试剂盒,按照说明书,每孔加入10 μl CCK-8溶液,培养箱孵育2 h,然后使用酶标仪检测波长在450 nm处的吸光度 (optical density,OD) 值,计算细胞增殖/抑制率。细胞增殖/抑制率(%)=(对照组OD值-敲降组OD值)/(对照组OD值-空白组OD值)×100%
1.2.5划痕实验 每株细胞待生长至约90%融合时,用移液枪头进行划痕,使用力度均匀,宽窄一致,分别对细胞进行0、24 h的观测并记录。
1.3 统计学处理采用SPSS 16.0统计软件(SPSS, Inc.,Chicago, IL, USA)进行统计分析。采用独立t检验分析两组间的差异。组间数据比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 lncRNA PVT1在HCC中呈高表达为了探究PVT1在HCC组织中的表达情况,首先通过TCGA数据库-生信网站(http://ualcan.path.uab.edu/index.html)对PVT1在HCC中的表达进行评估,见图1A。结果显示在HCC中PVT1的表达明显增高(P<0.05)。为探究PVT1在HCC细胞中的表达情况,使用L02细胞系作为对照,对Huh7、HepG2、Hep3B和Bel-7402细胞进行PVT1的检测,见图1B,结果显示PVT1在后3者中表达增高(P<0.05)。
2.2 lncRNA PVT1促进肝癌细胞增殖和迁移选取Hep3B和Bel-7402细胞系进行功能评价实验。首先通过转染技术构建PVT1低表达细胞系,进行转染效率的检测。结果证实si-PVT1能够显著降低细胞中PVT1表达,见图2A。与阴性对照组(si-NC)比较,CCK-8显示PVT1敲低后细胞增殖能力显著下降。见图2B。并且敲低PVT1抑制了肝癌细胞迁移能力,见图2C、D(P<0.05)。
2.3 PVT1能够与miR-17-5p靶向结合通过生信网站STARBASE和miRcode对PVT1进行miRNA靶点预测,见图3A。结果显示miR-17-5p存在与PVT1靶向结合的位点(mimic-NC为阴性对照组,mimic-17-5p为实验组)。为了证实预测位点的存在,使用荧光酶实验在2种细胞系中进行验证,见图3B。结果提示Wt组miR-17-5p能够与PVT1结合(P<0.05)。分析HCC细胞系中miR-17-5p的表达,结果显示miR-17-5p在HCC细胞中表达明显下降,见图3C。另一方面,通过TCGA数据库对PVT1与miR-17-5p的表达进行了相关性分析,见图3D。结果表明PVT1与miR-17-5p表达呈现负相关(P<0.01)。以上实验证明了PVT1能与miR-17-5p结合且二者表达呈负相关。
2.4 PVT1通过miR-17-5p影响肝癌细胞增殖和迁移能力为了验证PVT1是通过miR-17-5p靶向结合从而影响HCC细胞的生物学功能。对敲低PVT1的细胞系进行miR-17-5p的检测,见图4A。结果提示敲低PVT1后导致miR-17-5p表达升高(P<0.05)。通过共转染实验验证miR-17-5p抑制了PVT1对HCC细胞增殖的影响,见图4B。划痕实验证明miR-17-5p抑制了PVT1诱导的HCC细胞迁移,见图4C。上述结果表明PVT1对HCC细胞增殖和迁移能力的影响机制是通过miR-17-5p发挥作用。
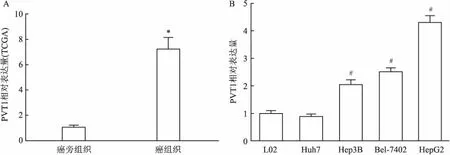
图1 lncRNA PVT1在肝癌组织和细胞中高表达

图2 长链非编码RNA PVT1影响肝癌细胞增殖和迁移
A:PVT1的转染效率;B:细胞的生存能力;C:敲低PVT1后Hep3B细胞的迁移能力;D:敲低PVT1后Bel-7402细胞的迁移能力;与si-NC比较:**P<0.05,*P<0.05

图3 PVT1与miR-17-5p靶向结合
A:Targetscan 预测结合位点;B:Hep3B细胞系相对荧光素酶活性;C:Bel-7402细胞系相对荧光素酶活性;D: miR-17-5p相对表达量;E:PVT1与miR-17-5p表达的相关性(Spearmen-correction:0.4993,p-value:6.547e-24,Sample:n=357);与PVT1Wt mimic-NC比较:*P<0.05; 与PVT1Mut mimic-NC比较:#P<0.05;与L02比较:△P<0.05

图4 PVT1通过miR-17-5p促进HCC细胞增殖和迁移
A:miR-17-5p转染效率; B:CCK - 8测定细胞生存能力;C:细胞迁移能力的测定;a:inhibitor-NC;b:siPVT1+inhibitor-NC;c:inhibitor;d:inhibitor+siPVT1;与mimic-NC比较:**P<0.01;与inhibitor-NC组比较:#P<0.05;与inhibitor组比较:△P<0.05
3 讨论
研究[6-7]发现PVT1能够参与肿瘤细胞多种生物学功能,包括影响细胞增殖、侵袭和迁移、代谢等过程。本实验探究了PVT1对HCC细胞增殖及迁移能力的影响。近年来,不断有研究证实ceRNA是lncRNA发挥调控肿瘤细胞功能的具有重要意义的调控机制。lncRNA可通过靶向结合某些miRNA,并间接的抑制miRNA对其靶基因的调控作用,从而实现了对肿瘤发生、发展的影响。有研究[8]发现,PVT1能够作为辅助肿瘤诊断或判断患者预后的标志物。本研究通过TCGA数据库分析了PVT1在HCC组织中的表达情况,并在细胞系中证实了PVT1在肝癌细胞中的高表达趋势。
miRNAs被认为是各种肿瘤的独立调控因子,在ceRNA机制上也发挥着特定的作用。一般认为miRNA是lncRNA调控肿瘤发生的靶基因,通过与lncRNAs相互作用或靶向mRNA参与许多人类肿瘤的生物学过程。miR-17-5p参与肝癌的多种生物学效应且能在很大程度上提高癌细胞生长[7]。除了miR-17-5p外,其他miRNA例如miR-181a-5p也与癌细胞的生命活动息息相关[9]。lncRNA PVT1能否作为ceRNA参与对miR-17-5p表达的调控需要进一步验证。
本研究证实 PVT1能够与miR-17-5p靶向结合,并通过共转染实验验证了lncRNA PVT1对肝癌细胞的影响是通过抑制miR-17-5p从而发挥作用。为了探寻PVT1在肝癌细胞中的潜在分子机制,通过荧光素酶实验证实了数据库的预测结果。实验结果表明PVT1可以与miR-17-5p靶向结合。进一步实验显示PVT1通过阻断miR-17-5p的表达,正向调控肝癌细胞增殖和能力。但其靶基因和下游的目标蛋白都是哪些分子,这些问题有待进一步研究。
