噁二唑硝胺化合物在水中稳定性及其水解机制
2020-07-11张祯琦卢欢唱廖龙渝范桂娟
张祯琦,马 卿,卢欢唱,廖龙渝,范桂娟
(中国工程物理研究院化工材料研究所,四川 绵阳 621999)
1 引言
探索新型高能量密度化合物是当前含能材料领域中一个重要研究方向。当前应用的含能材料仍以发展于20 世纪的多硝基芳香化合物三硝基甲苯(TNT)、2,4,6-三氨基-1,3,5-三硝基苯(TATB)、六硝基茋(HNS)和硝胺类化合物黑索今(RDX)、奥克托今(HMX)等为主[1]。前者主体骨架结构为苯环,后者为非芳香氮杂环,这两类骨架本身的生成焓及密度并不高,而含能材料的能量性能与其生成焓和密度都有着直接关系,因此,对高生成焓的骨架结构进行含能修饰,是发展新型高能量密度含能材料的重要研究策略之一。近年来,高含氮量杂芳环以其固有的高生成焓,引起了研究人员的广泛关注[2-8]。三氮唑、四氮唑以及噁二唑等含氮丰富的杂环化合物具有较高的正生成焓和热稳定性,为开发新的高能材料提供了良好的基础。在这类杂芳环骨架上引入含能修饰基团[9-10],不仅能够提升化合物的密度和能量,还能构建出平面性更好的分子结构,以获得更高的晶体堆积密度和更好的感度性能。
硝胺基作为一种高能量密度含能修饰基团,以其便捷的引入方法和良好的能量性能而被广泛应用于新型含能材料的研发中,尤其对于高氮杂环的修饰,引入硝胺基团是一种迅速提升其能量密度的有效策略。硝胺基团的引入方法通常为杂环上的氨基进行直接硝化,这为杂环硝胺化合物的制备提供了高效便捷的方法,例如由5,5′-二胺基-3,3′-双(1,2,4-噁二唑)或2,2′-二胺基-5,5′-双(1,3,4-噁二唑)(BODA)通过直接硝化合成5,5′-二硝胺基-3,3′-双(1,2,4-噁二唑)以及 2,2′-二 硝 胺 基-5,5′-双(1,3,4-噁 二 唑)(ICM-101)[11-13]。然而,使用100%硝酸或者100%硝酸/Ac2O 直接对氨基进行硝化的合成方法并不能适用于所有硝胺化合物的合成,尤其在噁二唑类硝胺化合物的合成上已有不少失败的例子,例如硝胺化合物1、2、3 的合成,在常用硝化条件(100%硝酸或者100%硝酸/Ac2O)下并不能获得相应的硝胺结构,而是生成了水解后的噁二唑酮化合物4、5、6[1,14-15](图1)。而且,在噁二唑结构中不仅硝胺官能团的引入会导致水解,其他含能修饰基团(偕二硝基,氟代偕二硝基)的引入也时有水解反应发生[9,17],但遗憾的是,当前对于噁二唑化合物的水解反应机理和内在规律仍未有深入研究。
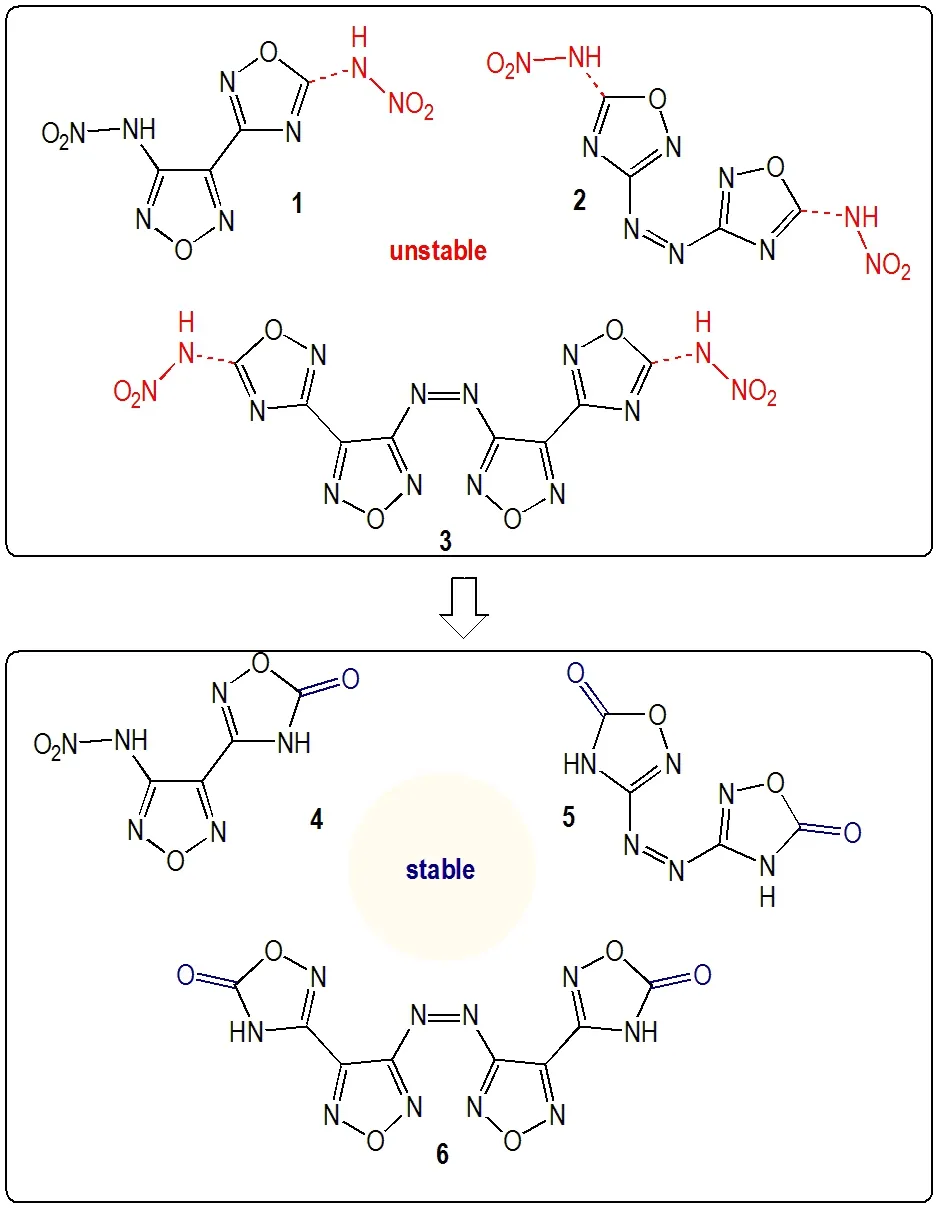
图1 不稳定硝胺化合物及其水解产物Fig.1 Unstable azole nitramide compounds and their hydrolysates
本工作针对噁二唑硝胺化合物在水中的稳定性及其水解机制进行了研究,通过理论计算获得了几种噁二唑硝胺化合物的LUMO 轨道及分子内各原子的NBO 电荷分布,结合前人实验结果,揭示了噁二唑硝胺化合物发生水解反应的位点及内在规律,提出了可能的水解机理;在此基础上,还预测了5,5′-二硝胺基-3,3′-双(1,2,4-噁二唑)以及2,2′-二硝胺基-5,5′-双(1,3,4-噁二唑)(ICM-101)两种噁二唑硝胺化合物的水解反应,并获得了相应的水解产物及其单晶结构。此外,通过对唑环类硝胺化合物进行结构等效,提出了唑类硝胺化合物发生水解反应的难易顺序。该工作可为噁二唑硝胺化合物的合成与应用提供理论支撑。
2 实验部分
2.1 试剂与仪器
试剂:氢氧化钾,分析纯,阿拉丁试剂有限公司;无水乙醇,乙酸乙酯,分析纯,成都科龙试剂有限公司;5,5′-二硝胺基-3,3′-双(1,2,4-噁二唑)以及2,2′-二硝胺基-5,5′-双(1,3,4-噁二唑)为自制,纯度>98%。
仪器:XRD 单晶衍射采用Bruker SMART APEXⅡCCD 面探X 射线单晶衍射仪。
2.2 实验
2.2.1 计算方法
直接采用Gaussian 09w(ver. 8.0)软件中对有机化合物结构的NBO 电荷进行计算,所有化合物结构是在B3LYP/6-311G(d,p)水平下进行优化。
2.2.2 合成
2.2.2.1 合成路线
选择5,5′-二硝胺基-3,3′-双(1,2,4-噁二唑)和2,2′-二硝胺基-5,5′-双(1,3,4-噁二唑)(ICM-101)两种噁二唑硝胺化合物作为实验对象,合成路线Scheme 1 所示。
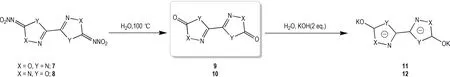
Scheme 1 Hydrolysis reactions of compound 7 and 8.
2.2.2.2 [3,3′-双(1,2,4-噁 二 唑)]-(4,4′-二 氢)-5,5′-二酮(9)的合成
称取516 mg(2 mmol)的5,5′-二硝胺基-3,3′-双(1,2,4-噁二唑)(7),加入带有搅拌子的25 mL 烧瓶中,量取5 mL 蒸馏水加入其中,使用油浴加热烧瓶至水相沸腾,溶液由白色悬浊液,逐渐变为浅黄色澄清溶液,当固体全部溶解后继续搅拌30~60 min 后,烧瓶中析出大量白色固体,将烧瓶取出油浴,自然冷却降温,过增加滤,用少量蒸馏水洗涤两次,干燥即得170 mg产物9,产率50%。1H NMR(400 MHz,DMSO-d6)δ:12.60(s,2H)。13C NMR(101 MHz,DMSO-d6)δ:159.13,147.53;IR(KBr,ν/cm-1):522,619,752,888,937,986,1174,1253,1435,1538,1768,1948,2132,1496,2752,3120。 C4H2N4O4(170.01):calcd:C 28.25,H 1.19,N 32.94;found:C 28.22,H 1.13,N 32.84。
2.2.2.3 [2,2′-双(1,3,4-噁 二 唑)]-(4,4′-二 氢)-5,5′-二酮(10)的合成
称取516 mg(2 mmol)的2,2′-二硝胺基-5,5′-双(1,3,4-噁二唑)(ICM-101,8),加入带有搅拌子的25 mL 烧瓶中,量取5 mL 蒸馏水加入其中,使用油浴加热烧瓶至水相沸腾,溶液由白色悬浊液,逐渐变为黄色澄清溶液,当固体全部溶解后继续搅拌3~5 min 后,将烧瓶取出油浴,自然冷却降温,静置较长时间后,析出片状晶体,过滤,用少量蒸馏水洗涤两次,干燥即得146 mg 产 物10,产 率43%。1H NMR(400 MHz,DMSO-d6)δ:13.22(s,2H)。13C NMR(101 MHz,DMSO-d6)δ:153.21,142.69;IR(KBr,ν/cm-1):523,620,681,754,770,932,950,1087,1147,1170,1266,1398,1558,1770,1866,3248。C4H2N4O4(170.01):calcd:C 28.25,H 1.19,N 32.94;found:C 26.88,H 1.18,N 33.57。
2.2.2.4 [3,3′-双(1,2,4-噁 二 唑)]-5,5′-二 酮 二 钾 盐(11)的合成
称取170 mg(1 mmol)的9,加入带有搅拌子的25 mL 烧瓶中,量取5 mL 蒸馏水加入其中,再称取KOH 112 mg(2 mmol)并溶解在1 mL 蒸馏水中,搅拌下逐滴加入烧瓶中,加毕,溶液由白色悬浊液变为澄清溶液,随后,挥发结晶,得到无色透明晶体210 mg即为产物11,产率85%。13C NMR(101 MHz,D2O)δ:174.79,161.01;IR(KBr,ν/cm-1):783,870,933,977,1216,1284,1294,1468,1664。 C4K2N4O4(245.92):calcd:C 19.51,H 0,N 22.77;found:C 19.57,H 0.15,N 22.24。
2.2.2.5 [2,2′-双(1,3,4-噁 二 唑)]-5,5′-二 酮 二 钾 盐(12)的合成
称取170 mg(1 mmol)的10,加入带有搅拌子的25 mL 烧瓶中,量取5 mL 蒸馏水加入其中,再称取KOH 112 mg(2 mmol)并溶解在1 mL 蒸馏水中,搅拌下逐滴加入烧瓶中,加毕,溶液由白色悬浊液变为淡黄色澄清溶液,随后,挥发结晶得无色晶体或加入无水乙醇析出淡黄色固体,过滤得淡黄色粉末190 mg即为产物12,产率77%。13C NMR(101 MHz,D2O)δ:166.76,146.09。C4K2N4O4(245.92):calcd:C 19.51,H 0,N 22.77;found:C 18.91,H 0.11,N 23.01。
3 结果与讨论
3.1 噁二唑硝胺化合物的水解现象解释
根据文献[1,14-15],可发现1,2,4-噁二唑硝胺化合物通常具有水解不稳定性。杂环硝胺化合物的水解过程是以水分子作为亲核试剂的亲核加成-消除反应。影响亲核加成难易程度的主要因素有中心原子的位阻效应和缺电子程度。噁二唑硝胺化合物为平面或近平面结构,位阻影响较小,而对于相同的亲核试剂——水分子,碳原子中心的亲电性强弱则直接影响了其自身被水分子进攻的难易程度。此外,根据前线轨道理论:占HOMO 成分越大的原子越有可能成为亲电位点;占LUMO 轨道成分越大的原子越有可能成为亲核位点[16]。噁二唑硝胺化合物的水解反应是水分子对碳原子中心的亲核进攻过程,因此研究噁二唑硝胺化合物的LUMO 轨道覆盖位置也可以定性揭示发生亲核进攻的可能位点。
基于此,选取化合物1 和2 这两种已知的不稳定噁二唑硝胺化合物进行结构研究。分别获得了它们的NBO 电荷分布,LUMO 轨道分布。(如图2 所示)可以发现,两种结构中,1,2,4-噁二唑环连接硝胺官能团后,相应碳中心的NBO 电荷均达到了0.7 a.u.以上,高于其它位点,更远远高于同样连接硝胺官能团的呋咱环碳正中心(仅为0.3 a.u.左右),这一明显的碳正中心电荷差异,正好与呋咱硝胺比1,2,4-噁二唑硝胺更加稳定的实验结果相吻合。同时,我们还计算了1,2,4-噁二唑硝胺的两种异构体(即环内双键型与环外双键型)的NBO 电荷分布和LUMO 轨道分布。其中环外双键型的碳正中心具有更高的NBO 电荷分布,但是遗憾的是,两种构型中,仅有环内双键型的LUMO 轨道有覆盖硝胺所连碳正中心,而环外双键构型则不存在LUMO 轨道覆盖碳正中心原子,因此,化合物1 和2的水解过程更可能是以环内双键的形式进行的。
上述研究进一步证实了噁二唑硝胺化合物的水解稳定性与硝胺官能团所在碳原子的NBO 电荷的相关性,而噁二唑硝胺化合物环内双键型与环外双键型中的哪一种结构作为优势构型进行水解反应,则主要与LUMO 轨道的分布有关。
基于该方法,尝试预测两种较为稳定的噁二唑硝胺化合物5,5′-二硝胺基-3,3′-双(1,2,4-噁二唑)(7)和2,2′-二硝胺基-5,5′-双(1,3,4-噁二唑)(ICM-101,8)的水解稳定性。首先,同样对NBO 电荷和LUMO轨道的分布进行了分析,(如图3 所示)发现该两种化合物的NBO 电荷分布与化合物1 和2 类似,仍然是硝胺所在碳正中心位点具有远高于其他位点的NBO 电荷数值;化合物7 不论环内双键型还是环外双键型,其碳中心的NBO 电荷分布分别为0.704 a.u.和0.738,而化合物8 的环内双键型结构的电荷分布较环外双键型低0.069 a.u.,分别为0.648 a.u.和0.717 a.u.;这种趋势也与化合物1 和2 相同,也即是环外双键异构化后,由于共轭效应导致该结构中碳正中心的正电性增强。同时我们还对7 和8 化合物的LUMO 轨道分布进行了分析,发现该两类化合物不论哪种构型都在中心碳原子上有着较大的LUMO 轨道分布。因此,由上述分析,可以推测,化合物7 与8 均能发生水解,而其水解位点同样是发生在硝胺基团连接的碳原子上,但是此两种化合物发生水解的起始物种很可能为环外双键型结构。
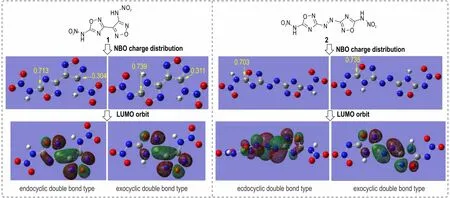
图2 化合物1 和2 的NBO 电荷分布及LUMO 轨道分布Fig.2 The NBO charge distribution and LUMO distribution of compound 1 and 2

图3 化合物7 和8 的NBO 电荷分布及LUMO 轨道分布Fig.3 The NBO charge distribution and LUMO distribution of compound 7 and 8
3.2 噁二唑硝胺化合物7 和8 的水解实验验证
通过理论计算,预测了噁二唑硝胺化合物5,5′-二硝 胺 基-3,3′-双(1,2,4-噁二唑)(7)和2,2′-二硝胺基-5,5′-双(1,3,4-噁二唑)(ICM-101,8)类似于化合物1 和2,在硝胺所在碳位点发生水解。为了验证该推测,分别将化合物7 和8 放入水中,在加热条件下进行水解反应,并成功获得相应的水解产物[3,3′-双(1,2,4-噁 二 唑)]-(4,4′-二 氢)-5,5′-二 酮(9)和[2,2′-双(1,3,4-噁二唑)]-(4,4′-二氢)-5,5′-二酮(10),其中化合物10 在水解过程中即可获得单晶,而9 为白色粉末。为了获得9的结构,采用与氢氧化钾中和成盐的方式,获得了9和10的二钾盐化合物11和12,如Scheme 2所示。
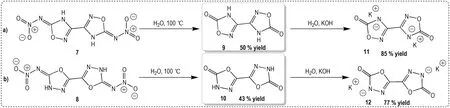
Scheme 2 Hydrolysis reaction conditions and products of compound 7 and 8
随后,通过单晶X-射线衍射获得了水解产物10 及钾盐11、12 的晶胞参数及晶体结构,如表1 和图4 所示。三种晶体均为单斜晶体,其中水解产物10 及钾盐11 为无水单晶,其中化合物10 在室温下具有高达1.908 g·cm-3的晶体密度,这与晶体结构中C═O 与N—H 键之间较强的氢键及高平面性的分子结构有关。钾盐11 的结构中,发现钾离子主要与C═O 中的氧进行配位,因此,分子中负电荷较多的不是N 位点,而是环外的O。此外,钾盐12 为四水合物,钾离子为七配结构,每个钾离子不仅与三个水解产物10 中的羰基位点有配位,还与四个水分子进行配位。通过单晶结构表征,我们发现噁二唑硝胺化合物7 和8 确实能在热水中发生水解反应,并且硝胺基作为离去基,得到了噁二唑酮结构的水解产物9 和10。
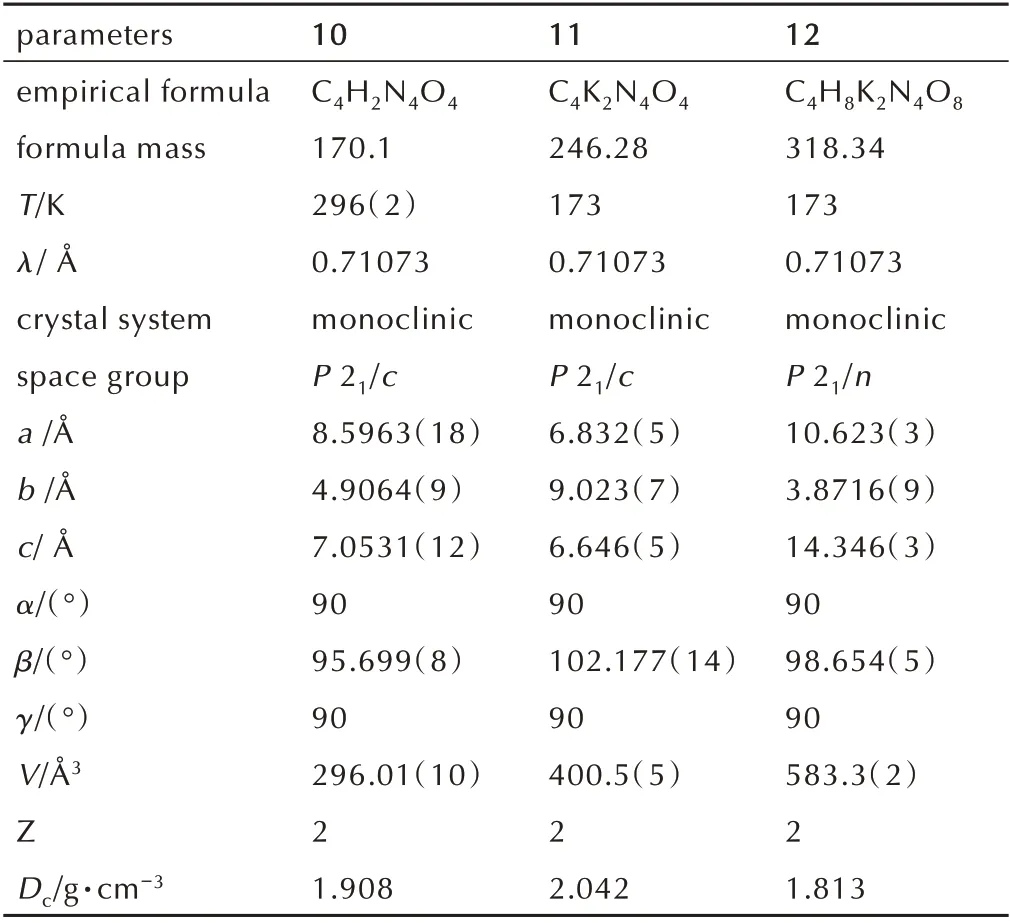
表1 化合物10,11 和12 的晶胞参数Table 1 Cell parameters of compound 10,11 and 12
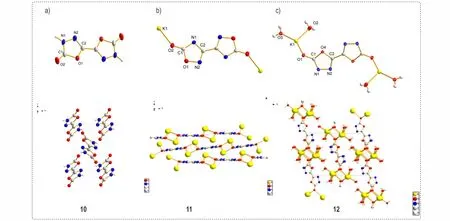
图4 化合物10、11 和12 的晶体结构图Fig.4 The single-crystal structures of compound 10,11 and 12
3.3 唑环硝胺化合物的水解规律推测
有趣的是,化合物9 曾作为一种副产物被Klapötke 课题组报道过,其主要是在偕二硝基甲基取代的联1,2,4-噁二唑在水相中进行氟代反应时产生的[17]。我们通过计算发现,虽然是负离子形式,但该偕二硝基官能团所连碳原子中心仍然具有较高的NBO 电荷(0.511 a.u.),如Scheme 3 所示,而且取代基偕二硝基结构与化合物1、2、7 和8 中的硝胺官能团性质完全不同,但仍然促使了水解反应的发生,这一现象引起了我们的注意,并以此推测:高的水解活性不仅与官能团所连原子的NBO 电荷有关,还极有可能与噁二唑这类骨架本身有关。
基于此推测,对几种唑环结构进行比较,将其母环结构进行了等效简化,如图5 所示,发现:呋咱环、1,2,4-三氮唑以及噁二唑环的硝胺结构可以按照碳中心所连原子的种类进行等效简化,分别可等效为硝基脒、硝基胍、硝基脲三种。通过NBO 电荷分析,上述三种等效结构的NBO 电荷分布的变化趋势与相应杂环骨架的变化趋势一致。进一步调研文献获知:硝基脲中,硝胺基团可以作为一种离去基被多种亲核试剂取代,而硝基胍和硝基脒中,则分别为氨基和亚氨基容易被取代[18-20]。这些现象与噁二唑硝胺化合物水解活性高的实验结果相吻合。因此,对不同杂环硝胺化合物的NBO 电荷分布进行比较,可以获得杂环硝胺水解反应的难易顺序为:S1<S2<S3<S4<S5,其中1,3,4-噁二唑(S4)与5-取代-1,2,4-噁二唑(S5)的硝胺化合物最易发生水解。
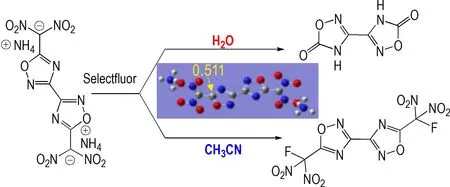
Scheme 3 Hydrolysis of gem-dinitro oxadiazole compounds
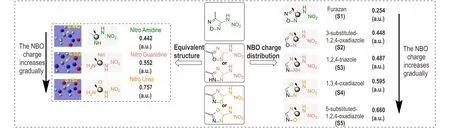
图5 唑环硝胺化合物的结构等效及其NBO 电荷分布对比Fig.5 The equivalent structures and NBO charge distributions of different nitroamino-azoles
3.4 噁二唑硝胺化合物的水解机理
结合上述研究,以噁二唑硝胺化合物8(ICM-101)为例推测出了相应的水解机理,如Scheme 4 所示:首先化合物8 通过互变异构变为环外双键型的8′结构,随后水分子对碳正中心进行亲核加成变为中间体1,之后脱除一分子硝基胺,获得半水解产物中间体2,接着中间体2 再被一分子水加成获得中间体3,之后继续脱除一分子硝基胺获得终水解产物10。
4 结论
(1)采用量化计算对文献中报道的几种不稳定噁二唑硝胺化合物进行NBO 电荷分布和LUMO 轨道的理论计算,发现与硝胺基相连的碳中心具有LUMO 轨道覆盖,为可能反应位点,而此位点的NBO 电荷为分子中最高,通常达到0.7 a.u.左右,这是导致噁二唑硝胺化合物更易发生水解反应的主要因素。
(2)基于理论计算预测和水解实验验证,成功证实 了5,5′-二 硝 胺 基-3,3′-双(1,2,4-噁 二 唑)和2,2′-二硝胺基-5,5′-双(1,3,4-噁二唑)(ICM-101)两种噁二唑硝胺化合物的水解反应,并通过单晶X-射线衍射获得了相应水解产物及其二钾盐的晶体结构,明确了水解反应的位点为硝胺基团所在的碳原子中心,而硝胺基团作为离去基被水分子取代。
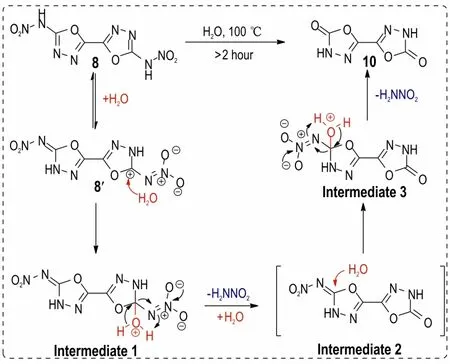
Scheme 4 The probably mechanism of the hydrolysis reaction of compound 8
(3)利用唑类硝胺化合物的结构等效方法,提出了唑类硝胺化合物发生水解反应的难易顺序为:呋咱<3-取代-1,2,4-噁二唑<1,2,4-三氮唑<1,3,4-噁二唑<5-取代-1,2,4-噁二唑。
(4)以噁二唑硝胺化合物(ICM-101)为例,提出了此类水解反应的机理:首先通过结构互变转化为碳中心正电性更强的环外双键型结构,随后碳正中心被水分子进行亲核加成,进而H2NNO2作为离去基团发生消除反应,形成水解后的噁二唑酮结构。该机理将为后续噁二唑硝胺化合物的合成与应用提供了理论支持。
