联吡唑含能化合物合成及性能研究进展
2020-07-11罗义芬毕福强李祥志王子俊王伯周
罗义芬,肖 川,毕福强,李祥志,王子俊,王伯周,3
(1. 西安近代化学研究所,陕西 西安710065;2. 中国兵器科学研究院,北京 010000;3. 氟氮化工资源高效开发与利用国家重点实验室,陕西 西安710065)
1 引言
吡唑结构单元含有较多的N—N,C—N,C ═N键,这些化学键对标准生成焓的贡献大都为正值,非常有利于设计、合成新型含能材料,并提高其爆热和单元比冲[1-11]。联吡唑骨架结构中含有两个吡唑环,由于氮原子的电负性高,能形成类苯结构的共轭平面大π键结构,因此联吡唑含能化合物具有钝感且热稳定性好的特质。另外,利用联吡唑骨架上N—H 的反应活性引入含能基团,可显著提高含能化合物生成焓,例如,在吡唑环上引入第二个硝基比单硝基的生成焓可提 高108 kJ·mol-1[12],基 于 此 采 用 在 联 吡 唑 环 上 引 入含能基团的方式可设计合成高能低感的含能材料。联吡唑骨架结构含能材料性能表现突出,目前已成为含能材料研究领域的热点之一,近年来,一系列性能优异联吡唑含能化合物的合成,受到了科研工作者的高度关注。吡唑骨架中两个吡唑环根据键合方式不同,可以分为2H,2′H-3,3′-联吡唑(Ⅰ)、1H,1′H-4,4′-联吡唑(Ⅱ)、1′H-1,4′-联 吡 唑(Ⅲ)、2′H-1,3′-联 吡 唑(Ⅳ)、1′H,2H-3,4′-联吡唑(Ⅴ)和1,1′-联吡唑(Ⅵ)6种结构[13](图1)。在含能材料研究领域,科研工作者关注更多的联吡唑结构单元主要是Ⅰ、Ⅱ、Ⅲ三种,这三种联吡唑母体环更有利于引入含能基团,近年来已合成了多种性能优良的含能化合物并初步进行了性能研究;对于联吡唑母体结构Ⅳ、Ⅴ,也开展了一部分合成研究工作,但性能研究较少;对于联吡唑母体结构Ⅵ,目前还没有相关含能材料方面的研究报道。
为了推动联吡唑骨架结构在含能材料中的应用,以不同结构联吡唑骨架单元化合物分类,重点归纳了在含能材料领域已开展研究的5 种联吡唑骨架含能化合物的母体构建与含能基团引入方法,总结了联吡唑骨架含能化合物的研究进展,并对相同结构联吡唑骨架含能化合物的性能进行了梳理对比,重点介绍了近年来部分性能突出的新型联吡唑含能化合物的研发,为联吡唑骨架含能化合物的设计制备提供借鉴。

图1 不同的联吡唑母体环结构[13]Fig.1 Different bipyrazole structures
2 2H,2′H-3,3′-联吡唑含能化合物
2.1 2H,2′H-3,3′-联吡唑母体结构(Ⅰ)的构建
1965 年,F.Effenberger 等[14]报 道 了2H,2′H-3,3′-联吡唑母体环的合成方法。以乙烯基乙醚和草酰氯为原料,首先在乙醚溶液中经过加成反应,然后再在三乙胺的作用下发生消除,脱去氯化氢,最后以70%~80% 的收率得到化合物1;然后再在无水甲醇中,-10 ℃下化合物1 与肼发生环化反应得到2H,2′H-3,3′-联 吡 唑(Scheme 1),收 率 为60%~75%。2004 年,Virginie Vicente 等[15]以1 为 原 料,改 进 了2H,2′H-3,3′-联吡唑的合成方法。在四氢呋喃溶液中,通过加入催化剂对甲苯磺酸,常温下化合物1 与水合肼就能发生环化反应得到2H,2′H-3,3′-联吡唑,收率为75%。
另外还有两种不同原料合成2H,2′H-3,3′-联吡唑的方法,2009 年,K. V. Yakovlev 等[16]在室温下,以苯为溶剂,采用二氧化锰对4,4′,5,5′-四氢-3H,3′H-3,3′-联吡唑进行氧化得到2H,2′H-3,3′-联吡唑(Scheme 2),此方法虽然步骤少,但收率较低,仅为27%。

Scheme 1 Synthesis of 2H,2′H-3,3′- bipyrazole with oxalyl chloride as as primary material[14-15]

Scheme 2 Synthesis of 2H,2′H-3,3′-bipyrazole with 4,4′,5,5′-tetrahydro-3H,3′H-3,3′-bipyrazole as primary material[16]
2001 年,T. M. Shironina 等[17]以2,4,5,7-四酮辛烷和肼为原料,在二氧六环溶液中发生环化得到4,4′-二 硝 基-5,5′-二 甲 基 联 吡 唑(Scheme 3)(化 合 物2),收率为48%。化合物2 是一种重要的联吡唑中间体,可以设计合成其他高能低感的联吡唑含能化合物。
2.2 2H,2′H-3,3′-联吡唑衍生物的合成
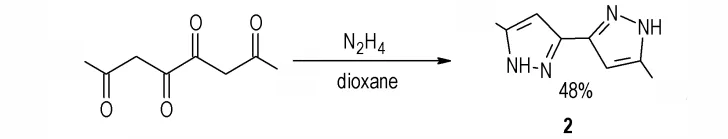
Scheme 3 Synthesis of compound 2[17]
2.2.1 多硝基2H,2′H-3,3′-联吡唑含能化合物
2018 年,Dheeraj Kumar 等[18]以2H,2′H-3,3′-联吡唑为原料,采用(CH3CO)2O/100%HNO3对其进行硝化得到化合物3,收率为71%,接着在苯腈中高温下重排,以56% 的收率得到化合物4,最后采用100%HNO3/H2SO4对化合物4 进行硝化得到化合物5,收率为81%;然而,若采用(CH3CO)2O/100%HNO3对化合物4 进行硝化,却得到化合物8,收率为87%;若采用100%HNO3/H2SO4对2H,2′H-3,3′-联吡唑进行硝化得到化合物6,收率为83%,再采用(CH3CO)2O/NH4NO3对化合物6 进行硝化,以91%的收率得到化合物7,但7 在苯腈中回流得不到化合物5(Scheme 4)。联吡唑硝化条件及研究结果表明,若采用的是(CH3CO)2O/HNO3体系,通常得到的是N—NO2;若采用的是HNO3/H2SO4体系,得到的C—NO2。性化合物3~8 及HNS 和RDX 的性能数据见表1。

Scheme 4 Synthesis of polynitro 2H,2′H-3,3′-bipyrazole energetic compounds[18]
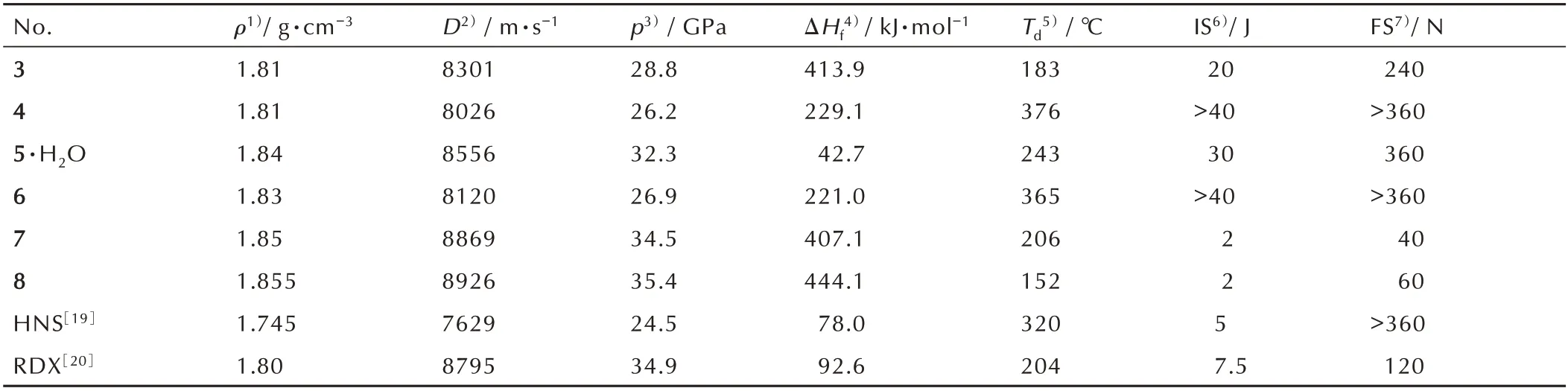
表1 3~8[18]、HNS[19]和RDX[20]的物化及爆轰性能Table 1 The performances of physico-chemistry and detonation for 3~8 and HNS,RDX and Pb(N3)2
从表1 中可以看出,相较于耐热炸药HNS(Td=320 ℃,D=8026 m·s-1),化 合 物4(Td=376 ℃,D=8026 m·s-1)和6(Td=365 ℃,D=8120 m·s-1)表现出更良好的热稳定性和爆轰性能,且化合物4(IS≥40 J,FS≥360)和6(IS≥40 J,FS≥360)非常钝感,这两种化合物在不敏感炸药和耐热炸药中有广泛的应用前景;化合物3(IS=20 J,FS=240 N)和5·H2O(IS=30 J,FS=360 N)的感度比4 和6 稍高,但爆轰性能(D=8301 m·s-1)优于化合物4 和6,综合性能较为优异;在这些多硝基联吡唑化合物中化合物7(IS=2 J,FS=40 N,D=8869 m·s-1)和8(IS=2 J,FS=60 N,D=8926 m·s-1)的爆轰性能最好,能量性能优于RDX(D=8795 m·s-1),但感度也较高。
2.2.2 硝基/氨基2H,2′H-3,3′-联吡唑化合物
2018 年,Tatyana K. Shkineva 等[21]以2H,2′H-3,3′-联吡唑为原料,拟合成4,4′-二硝基-5,5′-二氨基1H,1′H- -3,3′-联吡唑(化合物9)。利用硝硫混酸对2H,2′H-3,3′-联吡唑进行硝化获得6 之后,试图通过异常亲核取代氢(VNS)反应在5-位进行氨化得到化合物9,然而没有达到预期的目的(Scheme 5)。改变研究思路,先对2H,2′H-3,3′-联吡唑进行C-硝化,然后再进行N-硝化得到化合物7,然后再在7 的基础之上进行5-位取代等后续的相关反应得到化合物9(Scheme 6)。另外4,4′,5,5′-四硝基-1H,1′H-3,3′-联吡唑(化合物5)高压下在氨水中进行氨解,或者在FeCl3·6H2O 的催化作用下,进行肼解,均可以获得化合物9,但是收率均较低;化合物9 的在硝酸体系中进行硝化,可以得到硝胺含能化合物13(Scheme 7),收率为67%。
2018 年,Yongxing Tang 等[22]以4,4′-二 硝 基-5,5′-二羧基联吡唑为原料,经过酯化、氨解、重排三步反应得到化合物9(Scheme 8)。4,4′-二硝基-5,5′-二甲基联吡唑(化合物2)用Na2Cr2O4/H2SO4氧化可以方便的得到原料4,4′-二硝基-5,5′-二羧基联吡唑。

Scheme 5 Synthesis of compound 9 via VNS[21]
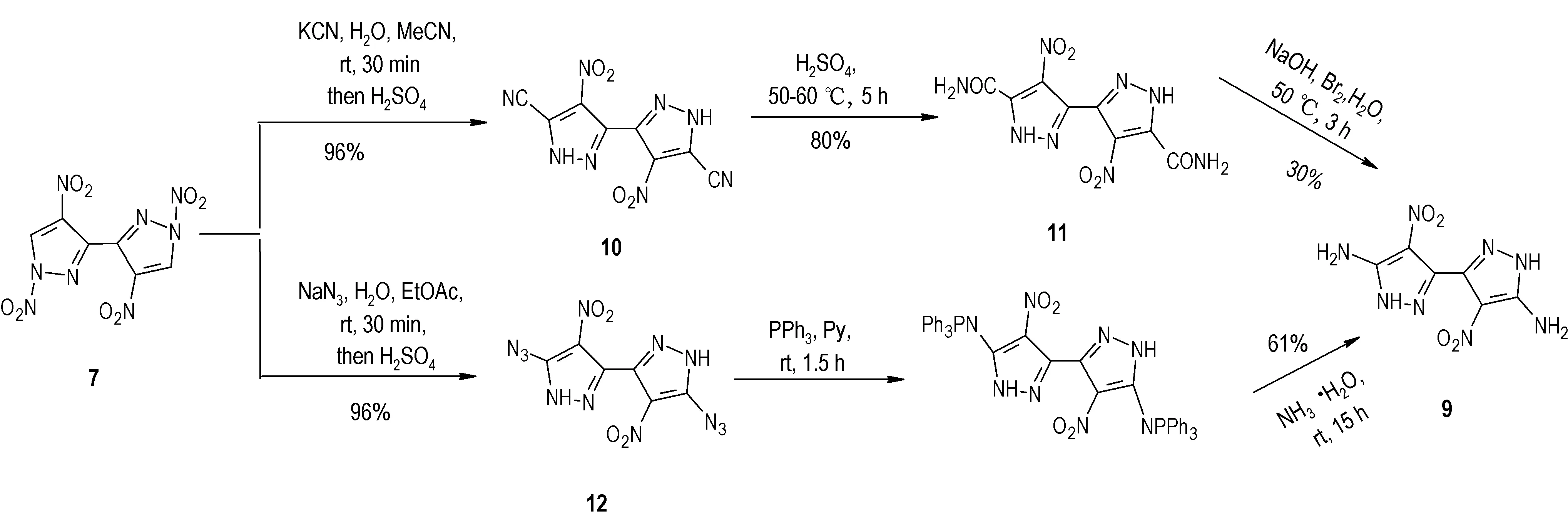
Scheme 6 Synthesis of compound 9 with compound 7 as primary material[21]

Scheme 7 Synthesis of compound 9 and 13 with compound 5 as primary material[21]

Scheme 8 Synthesis of compound 9 with 4,4′-dinitro-5,5′-dicarboxybipyrazole[22]
2.2.3 4,4′,5,5′-四硝基-1H,1′H-3,3′-联吡唑(5)含能衍生物
化合物5 既是一种性能优异含能化合物,也是一种重要的含能材料合成中间体,其密度为1.84 g·cm-3、爆速8556 m·s-1、爆压32.3 GPa、撞击感度30 J、摩擦感度60 N 以及分解点243 ℃。由于多硝基的强吸电子作用,导致化合物5 呈酸性,可以合成多种有机盐。利用吡唑环上N-H 的反应活性,可以衍生得到一系列的含能化合物。2018 年,Yongxing Tang 等[23]以5 为原料,经过氯丙酮取代、然后再在硝硫混酸中进行硝化得到化合物14(Scheme 9),总收率为24%;化合物14 密度为1.882 g·cm-3,爆速8987 m·s-1,爆压36.0 GPa,撞击感度5 J 以及摩擦感度240 N,但是其分解点太低,仅有150 ℃;同样是以5 为原料,在氨化试剂THA作用下,得到化合物15,试图在NO2BF4作用下进行硝化,得到硝胺化合物,然而没有成功,仅得到化合物5的单钾盐;以化合物5 为原料,与多种碱性物质发生中和反应,得到9 种含能离子盐。将所得到化合物的性能数据列于表2,从表2 中可以看出,化合物9 的含能离子盐中5b(D=8851 m·s-1)和5h(D=8952 m·s-1,)的爆轰性能与RDX(D=8795 m·s-1)相当,感度低于RDX((IS=7.4 J,FS=120 N),但是这两种盐分解点低(Td=137 ℃,Td=193 ℃),热稳定性较差。
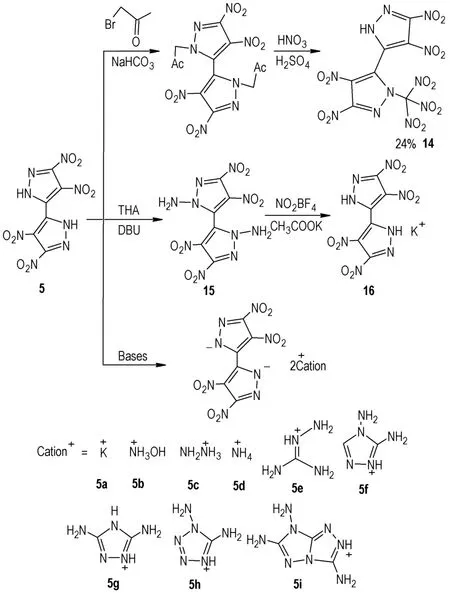
Scheme 9 Derivative reaction of compound 5[23]
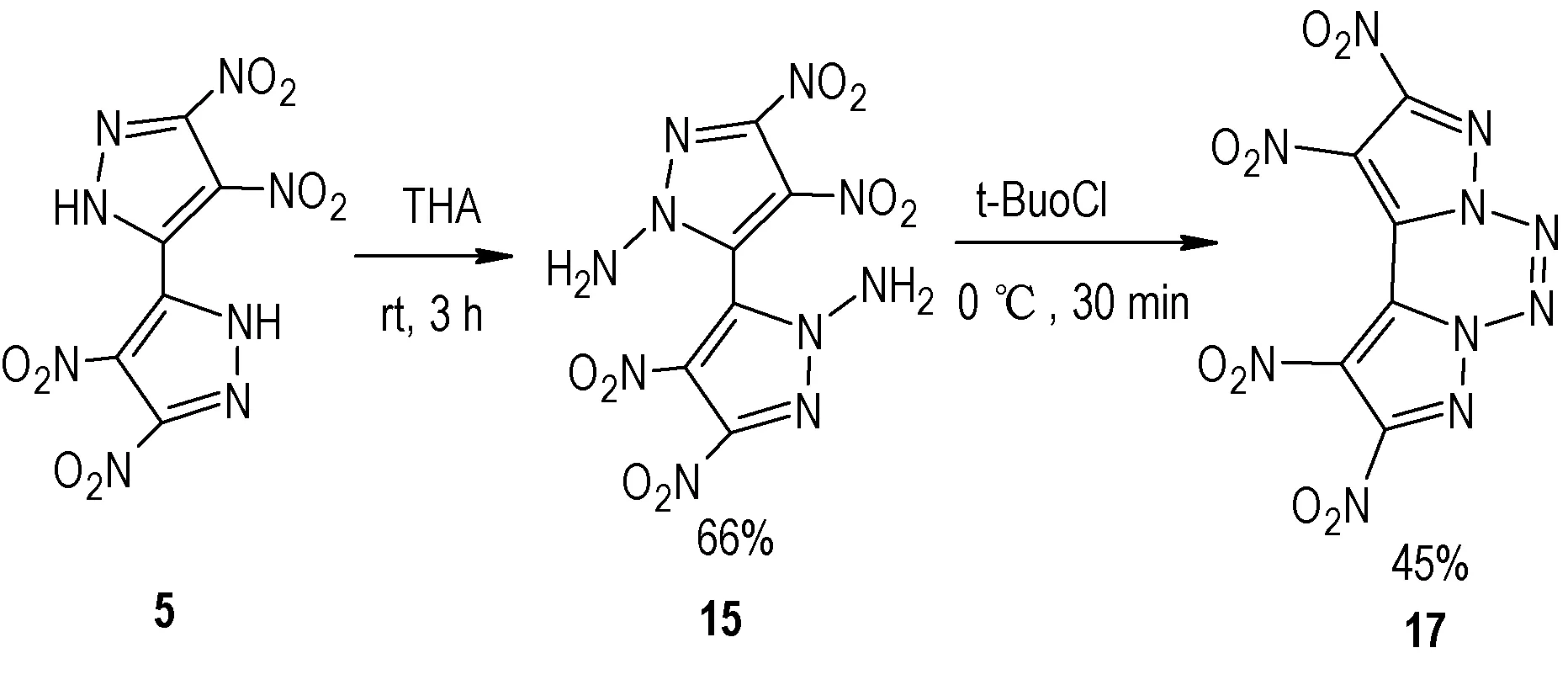
含能化合物5 结构中活泼N—H 的酸性,严重影响了其在武器装备中的应用。因此,拟通过氨化反应,在联吡唑分子结构中引入两个N—NH2,使分子内氨基偶联形成吡唑稠环结构,可降低其感度。2017 年,Yongxing Tang 等[24]以5 为原料,首先在氨化试剂对甲基苯酰羟胺(THA)作用下得到化合物15,基于联吡唑环上两个氨基与吡唑平面垂直的特性,在氧化偶联试剂t-BuoCl 作 用 下,得 到1,2,9,10-四 硝 基 联 吡 唑[1,5-d:5′,1′-f][1,2,3,4]四嗪(17)(Scheme 10),总收率为23.1%。将化合物15、17、RDX、HMX 及CL-20的物化及爆轰性能数据列于表2 中。从表2 可以看出,化合物15(D=8504 m·s-1,p=31.0 GPa)的爆轰性能略低于RDX(D=8795 m·s-1,p=34.9 GPa);然而化合物17 性能优异,其密度为1.955 m·s-1,起始分解点为233 ℃,可能由于环本身的骨架特点以及吡唑环的特性,是迄今为止热稳定性最好的1,2,3,4-四嗪化合物;其理论爆速为9631 m·s-1,理论爆压为44 GPa,撞击感度10 J,摩擦感度240 N,综合性能优于HMX,略低于CL-20,但是感度低于CL-20,在混合炸药和固体推进剂中有潜在的应用前景。
2018 年,Yongxing Tang 等[25]以5 为原料,在二甲基甲酰胺的碳酸氢钠溶液中,分别与二溴乙烷、二溴丙烷作用发生环化反应得到乙撑、丙撑桥联的环状化合物18 和19(Scheme 11),收率分别为82%和85%;将化合物18 和19 的物化及爆轰性能数据列于表2 中。从表2 数据分析可以看出,引入乙撑基和丙撑基,相较于原料5(Td=243 ℃),化 合 物18(Td=261 ℃)和19(Td=280 ℃),能量有所下降,但具有更好的热稳定性;将18(D=8135 m·s-1,p=28.1 GPa)和19(D=7700 m·s-1,p=24.1 GPa)的爆轰性能分别与TNT、TATB 比较,二者能量均优于TNT,其中18 与TATB 接近,感度与TNT 相当,但是热稳定性相对较低。
Scheme 10 Synthesis of compound 15 and 17[24]

Scheme 11 Synthesis of compound 18 and 19[25]
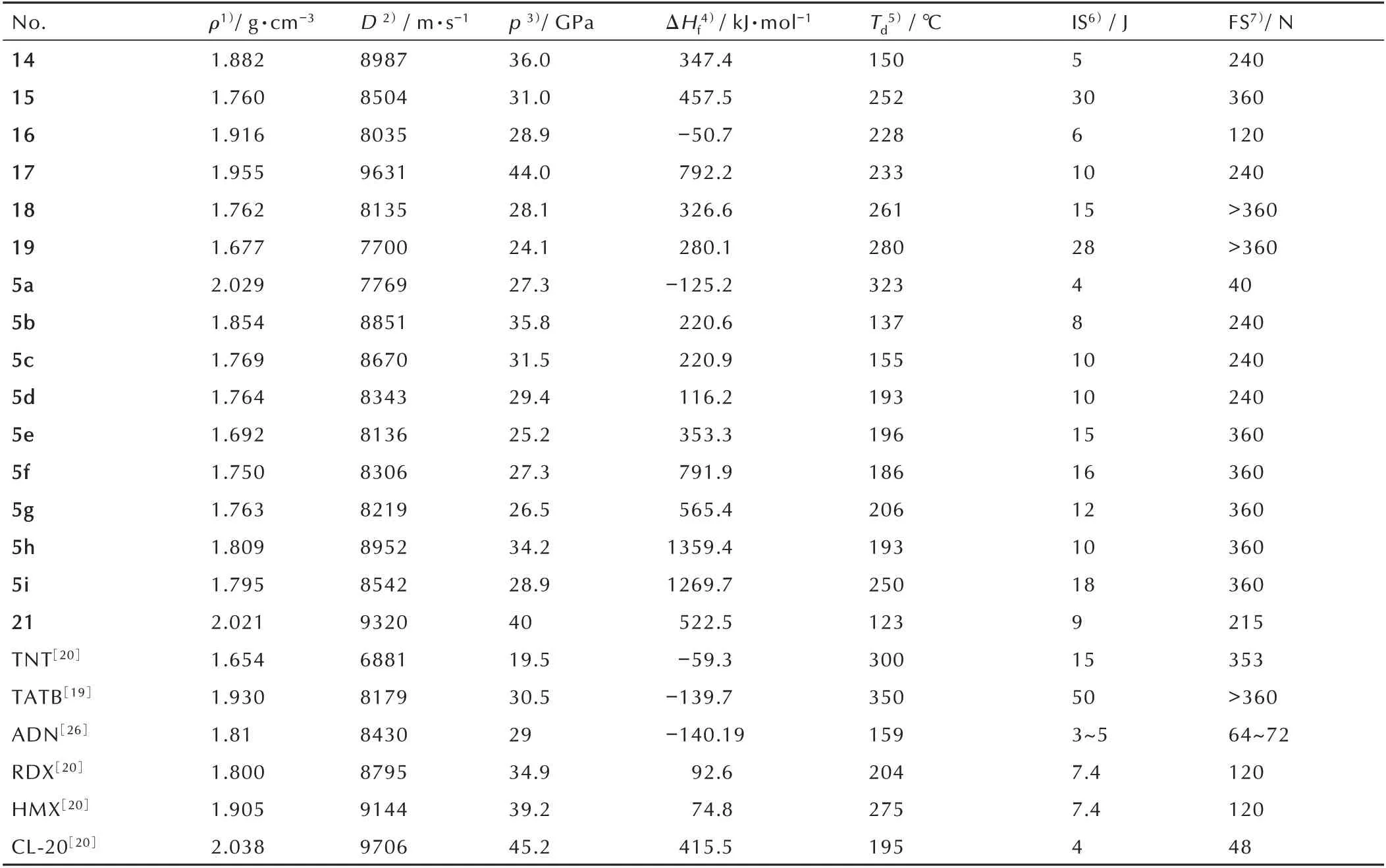
表2 化合物5 衍生物[23-26]及几种常用炸药的物化及爆轰性能Table 2 The performances of physico-chemistry and detonation for compound 5 derivatives and several conventional explosives
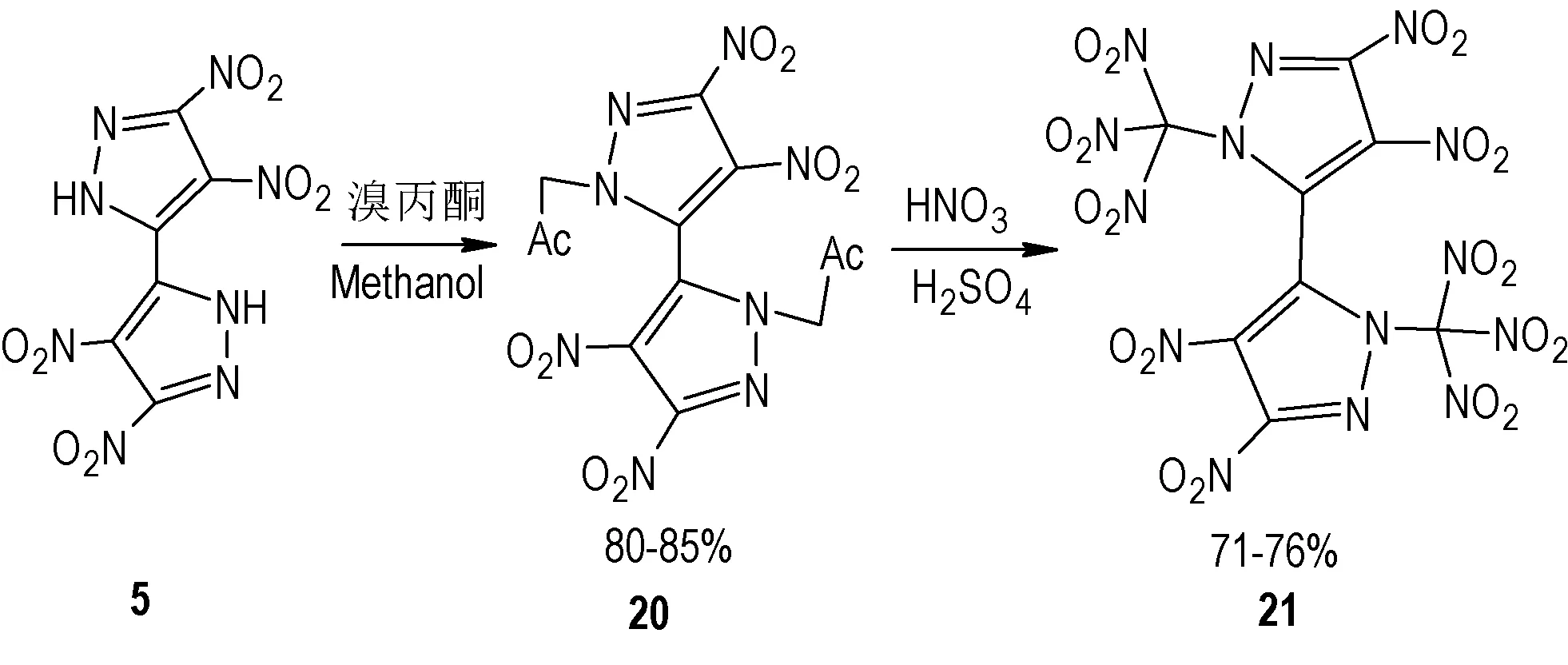
2018 年,Dalinger 等[26]以5 为原料,在甲醇溶液中经过溴丙酮取代得到中间体20,然后再在硝硫混酸作用下发生硝化反应得到4,4′,5,5′-四硝基-2,2′-双(三硝甲基)-2H,2′H-3,3′-联吡唑(21)(Scheme 12),总收率为50%;化合物21 氧平衡为(10.5%),可作为氧化剂使用。化合物21的物化爆轰性能见表2。从表2可以看出,化合物21 密度为2.021 g·cm-3,熔点123 ℃,起始分解温度为125 ℃,理论爆速为9320 m·s-1,理论爆压为40 GPa,爆轰性能优于ADN;其撞击感度9 J,摩擦感度215 N,较ADN 感度显著降低,有望取代ADN 应用于固体推进剂中。
Scheme 12 Synthesis of compound 21[26]
2.2.4 4,4′-二硝基-5,5′-二氨基-1H,1′H-3,3′-联吡唑(9)衍生物
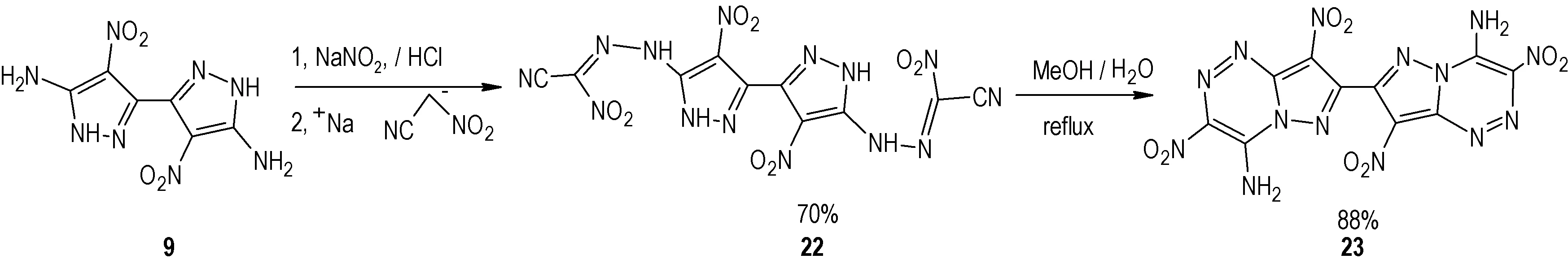
2018 年,Yongxing Tang 等[22]以化合物9 为原料,在NaNO2/HCl 作用下发生重氮化反应,然后再与硝基乙腈钠盐反应得到中间体22,最后化合物22 在甲醇溶液中回流,发生环化反应得到化合物23(Scheme 13),总收率为61.6%;将化合物9、23、TATB 以及2,6-二氨基-3,5-二硝基吡嗪-1-氧化物(LLM-105)的物化及爆轰性能列于表3中。从表3可以看出,通过将化合物9进行重氮化再环化得到化合物23,其爆轰性能、热稳定性、安全性均得到较大的提升。化合物23 密度为1.85 g·cm-3,起始分解点为315 ℃,理论爆速为8572 m·s-1,理论爆压为31.4 GPa,撞击感度>60 J,摩擦感度>360 N,表明其爆轰性能优于TATB,与LLM-105 相当。
从前期的研究可以得到[27-28],重氮化合物也是一种能量较高的含能材料,并且可以稳定存在。2019年,Yongxing Tang 等[29]将化合物9 的重氮化产物进行了分离,成功获得一种新型的重氮内盐化合物24(Scheme 14),其密度为1.85 g·cm-3,起始分解点为150 ℃,理论爆速为8943 m·s-1,理论爆压为34.0 GPa,撞击感度1 J,摩擦感度20 N。将24 的性能与常用的起爆药二硝基重氮酚(DDNP)和叠氮化铅(Pb(N3)2)进行比较,结果列于表3。从表3 可以看出,相较于DDNP 和Pb(N3)2,化合物24 具有更好的爆轰性能和较安全的摩擦感度,但是其热稳定性较差,分解点只有150℃;将其与4-重氮基-3,5-二硝基吡唑(DDNPz)进行对比,两者有接近的爆轰性能和热稳定性。
Scheme 13 Synthesis of compound 23[22]

表3 化合物9 及其衍生物[29]和几种常用炸药的的物化及爆轰性能Table 3 The performances of physico-chemistry and detonation for compound 9,its derivatives and several conventional explosives

Scheme 14 Structure of compound 24
3 1H,1′H-4,4′-联吡唑含能化合物
3.1 1H,1′H-4,4′-联吡唑母体环(Ⅱ)的构建
1964 年,S.Trofimenko 等[30]以3,4-二氰基呋喃为原料,经过选择性还原、偶联以及肼解等反应得到化合物25;25 再与水合肼发生环化反应,得到1H,1′H-4,4′-联吡唑(Scheme 15)。
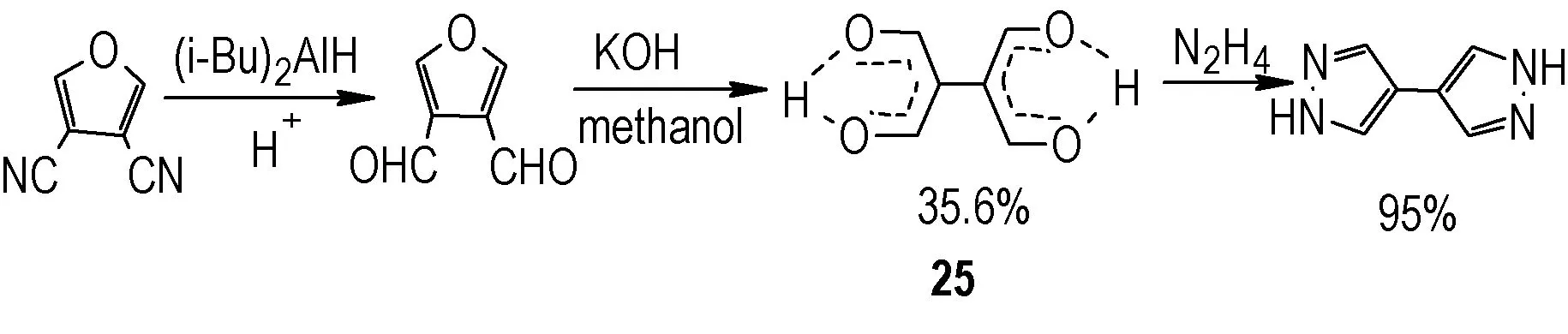
Scheme 15 Synthesis of 1H,1′H-4,4′- bipyrazole[30]
3.2 1H,1′H-4,4′-联吡唑含能化合物的合成及性能
2013 年,Kostiantyn V.Domasevitch 等[31]以1H,1′H-4,4′-联吡唑为原料,利用不同的硝化条件,得到一系列的1H,1′H-4,4′-联吡唑类硝化产物(Scheme 16),将所合成的1H,1′H-4,4′-联吡唑硝基化合物性能列于表4。从表4 可以看出,这类化合物均有较好的耐热性能(Td≥298 ℃),化 合 物28(IS=30 J,FS>360 N,D=7528 m·s-1,Td=382 ℃)与HNS(IS=5 J,FS>360 N,D=7629 m·s-1,Td=320 ℃)性能比较,两者有相近的爆轰性能,但是28 有更好的感度性能和更优异的耐热性能;在所合成的5 种硝基化合物中,以化合物29(ρ=1.855 g·cm-3,D=8256 km·s-1,p=28.6 GPa,IS=20 J,FS>360 J,Td=314 ℃)和30(ρ=1.820 g·cm-3,D=8520 km·s-1,p=31.1 GPa,IS=4.5 J,FS =192 J,Td=298 ℃)综合性能尤为突出,相较于耐热炸药HNS,29和30具有更好的爆轰性能,在耐热炸药方面前景突出。
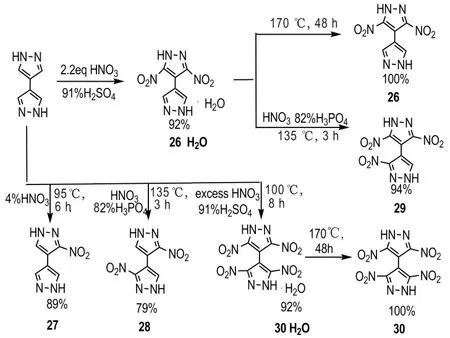
Scheme 16 Synthesis of 1H,1′H-4,4′- bipyrazole derivatives[31]
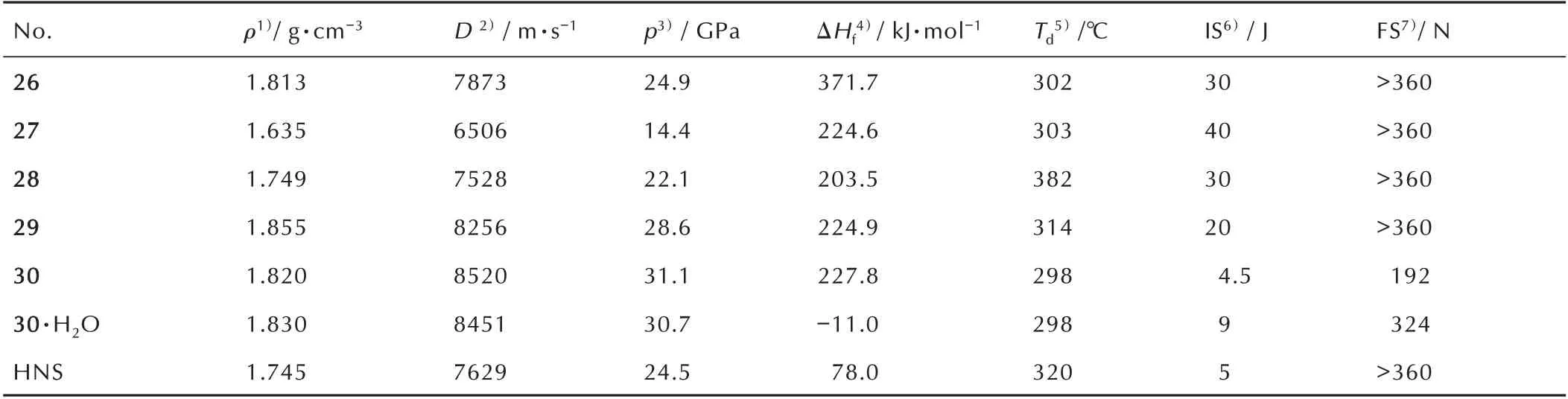
表4 26~30[31]与HNS 的物化及爆轰性能Table 4 The performances of physico-chemistry and detonation for 26~30 and HNS
4 1′H-1,4′-联吡唑含能化合物
4.1 1′H-1,4′-联吡唑母体环(Ⅲ)的构建
1′H-1,4′-联吡唑的构建分为两种情况:1、单吡唑环上取代基与水合肼作用,发生合环反应;2、双吡唑环之间的亲和取代反应。明确应用于含能材料方面的构建有如下两种方式。
二醛缩合法:1988 年,Kral,B.等[32]采用2-(4-硝基-1H-吡唑-1 基)丙二醛与水合肼进行缩合反应得到硝基1′H-1,4′-联吡唑母体环(Scheme 17)。
3,4,5-三硝基吡唑法:3,4,5-三硝基吡唑(TNP)作为一种重要的硝基吡唑类化合物,具有高密度、高能量、低感度的优点,在含能材料领域具有广阔的应用前景[33-34];同时TNP 也是一种重要的含能中间体,以其为原料[35-43],2010 年,Dalinger,I. L.等[44]利用4-位硝基的活性,在NaOH 水溶液中80~90 ℃下,与1H-吡唑发生亲核取代反应,然后再进行酸化得到硝基取代1′H-1,4′-联吡唑类含能化合物(Scheme 18),收率为52%~80%。

Scheme 17 Synthesis of 4-nitro-1′H-1,4′-bipyrazole[32]

Scheme 18 Synthesis of 4-R-3′,5,5′-trinitro-1′H-1,4′-bipyrazole[44]
4.2 1′H-1,4′-联吡唑含能化合物的合成及性能
2014 年,Chuan Li 等[45]采用上述方法二,以3,4,5-三硝基吡唑和4-氯吡唑为原料,经过亲核取代得到C-N 相连的1′H-1,4′-联吡唑,随后再在硝硫混酸、氨水中发生硝化、氨解等反应得到化合物33,总收率为24%;然后采用H2O2/H2SO4对化合物33 进行氧化,以40%的收率得到多硝基取代的C—N 联吡唑化合物34;鉴于化合物33 分子结构本身的酸性,利用N-H 的活性,对其进行氨化得到中性分子35,收率为57%;以化合物33 为母体,与多种碱性配体作用,得到9 种含能盐33a~33i(Scheme 19)。将所得到化合物的性能数据列于表5。从表5 可以看出,所合成的化合物热稳定性较好,热分解温度均在228 ℃以上。化合物33(ρ=1.89 g·cm-3,D=8600 m·s-1,p=35.0 GPa,IS>40 J,Td=242 ℃)和35(ρ=1.87 g·cm-3,D=8648 m·s-1,p=35.1 GPa,IS>40 J,Td=284 ℃)均有与RDX 相接近的爆轰性能,另外33和35比RDX 具有更好的安全性能。综合性能最为优异的是化合物34(ρ=1.82 g·cm-3,D=8814 m·s-1,p=37.0 GPa,IS=28 J,Td=297 ℃),而且其热分解点接近300 ℃,具有能量高、感度低及良好的热安定性。另外,所合成的系列有机盐33a~33i(ρ=1.67~1.88 g·cm-3,D=8041~8615 m·s-1,IS>40 J,Td=228~297 ℃)也表现出较为优异的综合性能,在所合成的系列有机盐中,以单铵盐33a(ρ=1.88 g·cm-3,D=8615 m·s-1,p=34.6 GPa,IS>40 J,Td=262 ℃)性能最优异。综上,从所得的性能结果来看,此类含能化合物及有机盐在混合炸药和固体推进剂方面均有良好的应用潜力。
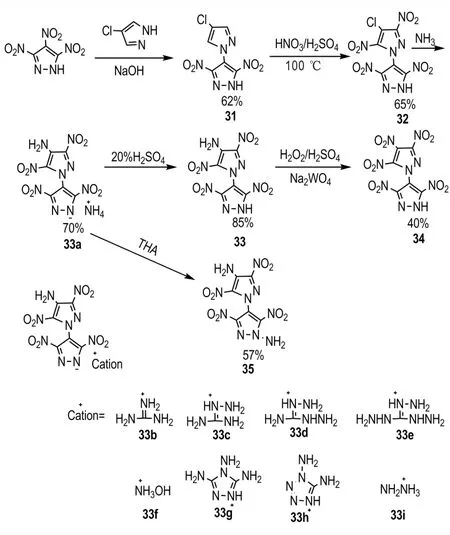
Scheme 19 Synthesis of 1′H-1,4′-bipyrazole derivatives[45]
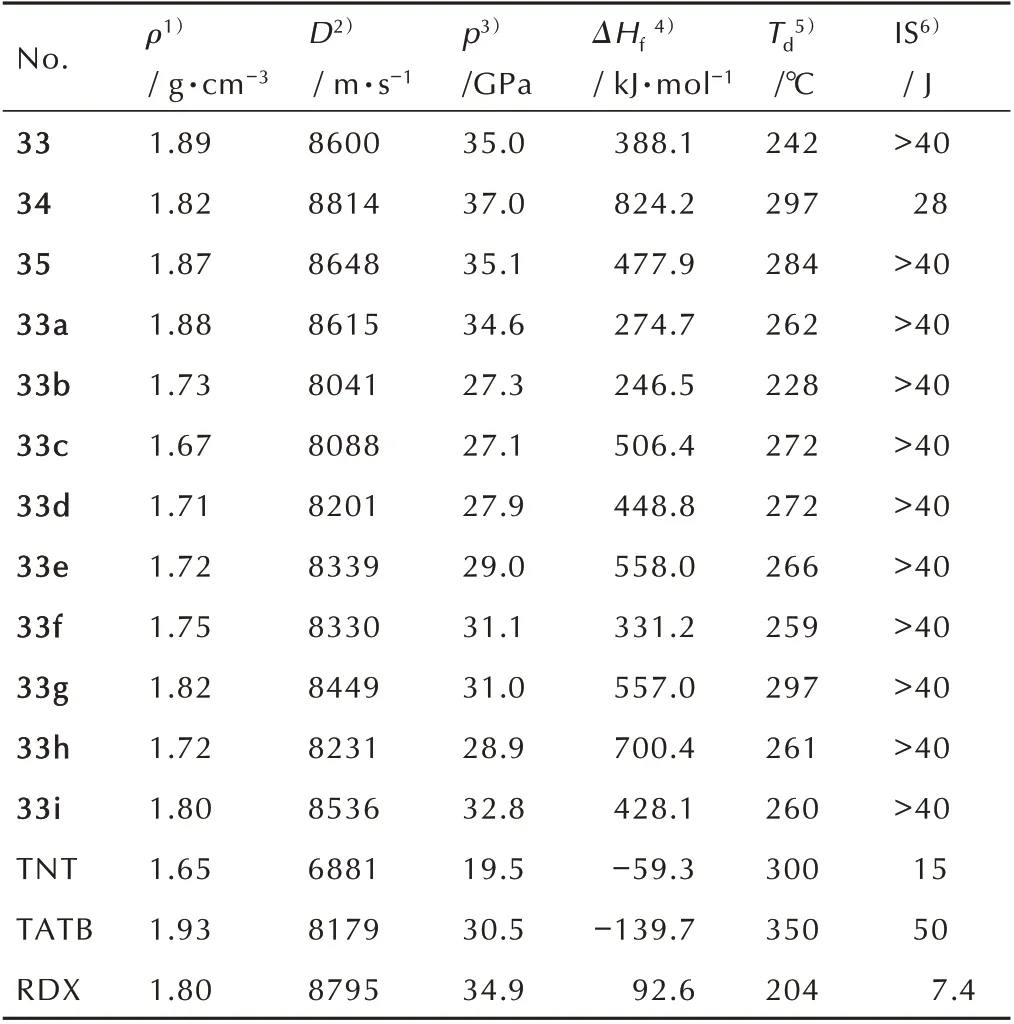
表5 33~35、33a~33i[45]与TNT、TATB、RDX 的物化及爆轰性能Table 5 The performances of physico-chemistry and detonation for 33~35,33a~33i,TNT,TATB and RDX
5 2′H-1,3′-联吡唑(Ⅳ)含能化合物
室温下,乙腈溶液中,1,4-二硝基吡唑与吡唑反应,以较高的收率得到硝基取代2′H-1,3′-联吡唑化合物[46-47],然 后 采 用 硝 化 试 剂HNO3/AcOH/Ac2O 对 其进行硝化得到化合物36(Scheme 20),收率为90%。
前期研究表明,TNP与1H-吡唑发生亲核取代反应,是在4-位硝基上发生。2011 年,Dalinger,I.L.等[48]将TNP 替代1-甲基-3,4,5-三硝基吡唑(MTNP)[49-52]进行上述反应时,由于区域特异性,在MTNP 5-位硝基上发生取代反应,所得到的是相应的硝基取代2′H-1,3′-联吡唑化合物(Scheme 21)。
2019年,Mao-xi,Zhang等[53]以4-氨基-3,5-二硝基吡唑为原料,经过重氮化得到4-重氮基-3,5-二硝基吡唑[29],然后再与4-氨基-3,5-二硝基吡唑发生取代反应得到化合物4-重氮基-双(4-氨基-3,5-二硝基吡唑-1-基)吡唑(LLM-226)(Scheme 22),总 收 率 为51%。其 中LLM-226 密度为1.83 g·cm-3,分解峰温为(Td)278 ℃,H50为31 cm(2.5 kg落锤),对摩擦、火花不敏感。

Scheme 20 Synthesis of compound 36[46-47]
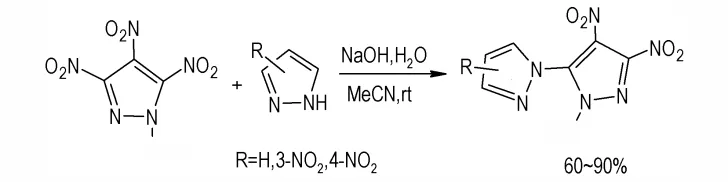
Scheme 21 Synthesis of 2′H-1,3′-bipyrazole derivatives[48]
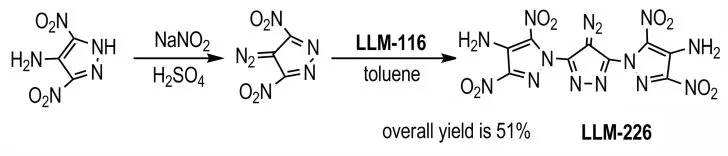
Scheme 22 Synthesis of LLM-226[53]
6 1′H,2H-3,4′-联吡唑(Ⅴ)含能化合物的合成及性能
1′H,2H-3,4′-联吡唑含能化合物的研究比较少,只有1993 年,Shevelev,S. A.等[54]进行了此方面的报道,且文献只是给出了1′H,2H-3,4′-联吡唑衍生物的结构和合成过程,没有报道性能数据。Shevelev,S.A.等采用两种原料得到了硝基取代1′H,2H-3,4′-联吡唑(37)。一种是2-(4-硝基-1H-吡唑-3-基)丙二醛为原料,与肼作用发生缩合反应得到37,收率为91%;另外一种是采用38 为原料与肼发生环化反应得到化合物37(Scheme 23),收率为81%。
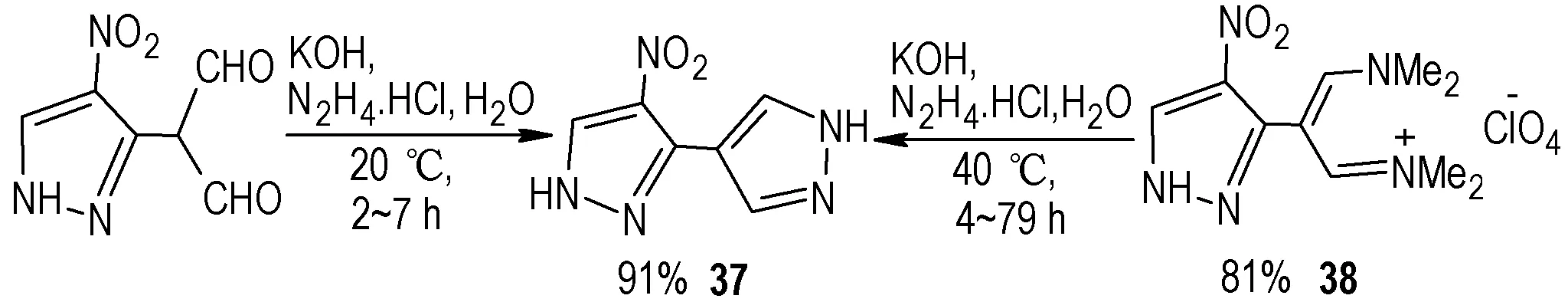
Scheme 23 Synthesis of compound 37 and 38[54]
利用同样的环化方法,通过改变母体结构得到两种联吡唑化合物39 和42,然后对这两种联吡唑化合物进行硝化,采用不同的硝化条件分别得到N—NO2硝化产物40 和41,以及C-NO2硝化产物43 和44(Scheme 24)。
7 结论与展望
联吡唑骨架结构因其具有N—N 杂五元芳香环结构,且可以形成共轭大π 键,具有高生成焓、高密度、正氧平衡、钝感及热稳定性好的优点,因而构建联吡唑骨架含能化合物成为设计合成高能低感或耐热单质炸药的重要途径。基于联吡唑环之间键合方式的不同,联吡唑包括2H,2′H-3,3′-联吡唑(Ⅰ)、1H,1′H-4,4′-联吡唑(Ⅱ)、1′H-1,4′-联吡唑(Ⅲ)、2′H-1,3′-联吡唑(Ⅳ)、1′H,2H-3,4′-联吡唑(Ⅴ)和1,1′-联吡唑(Ⅵ)6 种联吡唑结构单元。其中Ⅰ、Ⅱ和Ⅲ三种联吡唑结构单元在含能材料领域的研究较为广泛,已合成出大量的综合性能优异的联吡唑含能化合物;Ⅳ和Ⅴ两种联吡唑结构单元在含能材料领域的研究较少,只有合成方面的报道,性能研究起步较晚,但从已报道的化合物的性能来看在含能材料领域也有一定的前景,可以作为联吡唑含能化合物发展的一个方向;Ⅵ型联吡唑含能化合物目前还未有合成和性能方面的报道。综上,联吡唑含能化合物进一步的发展趋势应集中在以下几个方面:
(1)目前,在已合成的化合物中筛选综合性能优异的联吡唑含能化合物,尽快实现其高效制备并开展应用研究,寻找制备更为简单的母体合成及含能基团引入方法。以Ⅰ、Ⅱ、和Ⅲ三种联吡唑含能化合物为研究对象。
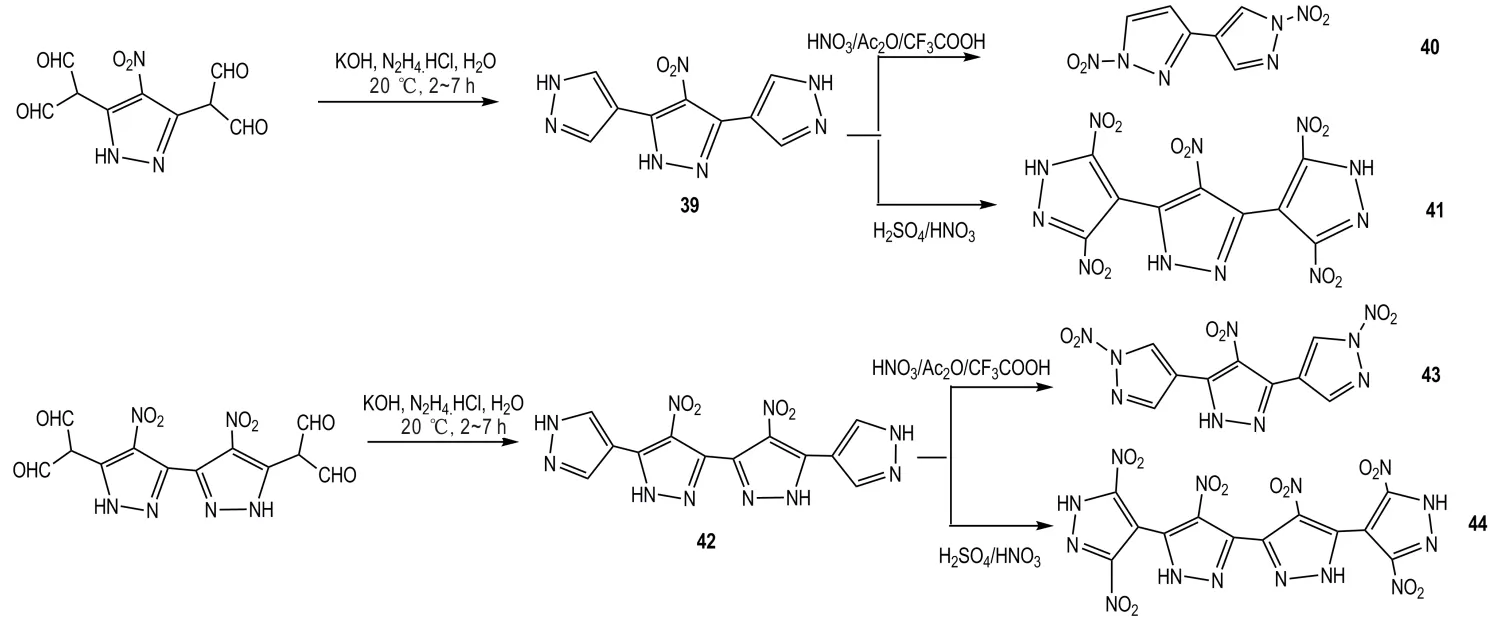
Scheme 24 Synthesis of 1′H,2H-3,4′-bipyrazole derivatives[54]
(2)寻找制备更为简单、性能更为优异的含能化合物仍是含能材料研究领域的长期目标。对于联吡唑母体,通过改变不同的含能基团和引入不同的富氮阳离子策略,有利于合成出能量与感度性能兼备,综合性能优异的含能化合物,这些化合物在诸多性能上都表现出传统含能化合物所不具备的优势。
(3)Ⅳ及Ⅴ两种联吡唑含能化合物的性能研究较少,通过研究这两种类型联吡唑化合物的性能,判断出这两种联吡唑含能化合物的性能特点;对于Ⅵ型联吡唑设计及探索其母体合成方法以及含能基团的引入方法,将该领域的研究继续扩展,完善联吡唑含能化合物的研究。
