1,2-双(5,5′-二硝胺基-1,3,4-噁二唑-2-)乙烷的合成与性能
2020-07-11马英杰卢艳华曹一林何金选
马英杰,卢艳华,曹一林,何金选
(航天化学动力技术重点实验室,湖北航天化学技术研究所,湖北 襄阳 441003)
1 引言
噁二唑是一类重要的含能结构单元,噁二唑环中的所有原子都共平面,结构紧凑,因此噁二唑类化合物均有较高的密度;噁二唑环内存在活性氧,能够提高整体结构的氧平衡,环上的氧、氮具有未成对的电子,可与π 键形成共轭,具有类似苯环的结构,其较大的芳香性增强了噁二唑环的稳定性[1-2]。
在噁二唑类含能化合物的的合成中,呋咱(1,2,5-噁二唑)这一同分异构体最受研究者青睐[3],如3,3′-二硝胺基-4,4′-二呋咱[4],3,3′-二硝氨基-4,4′-偶氮呋咱[5],3,3′-二硝基-4,4′偶氮氧化呋咱[6]。此外,以另一种同分异构体1,2,4-噁二唑[7-9]为骨架,研究者也合成出不少性能优良的含能化合物,如5,5′-二硝胺基-3,3′-联1,2,4-噁二唑、5,5′-二(三硝基甲基)-3,3′-联1,2,4-噁二唑等。而1,3,4-噁二唑作为噁二唑的另一种同分异构体,由于较低的生成焓而在含能材料领域一直未得到关注,近几年越来越多关于1,3,4-噁二唑类含能化合物的研究成果表明,1,3,4-噁二唑类含能化合物具有成为高能钝感材料的潜力,如密度达到2.0 g·cm-3的5,5′-二硝胺基-联1,3,4-噁二唑(ICM-101)[10]。1,3,4-噁二唑环稳定的环结构,可能会使1,3,4-噁二唑类含能材料更容易达到能量与感度的平衡。
研究发现,有机二羧酸酯,通过肼解、环化两步反应可制得一类带有氨基的双噁二唑化合物,以该类化合物作为中间产物通过硝化可得到带硝胺基噁二唑结构的含能化合物。为了得到钝感的1,3,4-噁二唑类含能化合物,本研究合成了2 个具有双氨基噁二唑的含能中间体,对其中的1,2-双(5,5′-二氨基-1,3,4-噁二 唑-2-)乙 烷 进 行 硝 化,得 到1,2-双(5,5′-二 硝 胺基-1,3,4-噁二唑-2-)乙烷(BNOE),同时对其结构和性能进行了鉴定和测试,分析了其热稳定性及感度性质,预估了爆轰性能。
2 实验部分
2.1 试剂与仪器
发烟硝酸,分析纯;乙醇,分析纯;水合肼(85%),分析纯;丙二酸二乙酯,试剂纯;丁二酸二甲酯,试剂纯;碳酸氢钾,分析纯。以上试剂均为国药集团化学试剂有限公司。溴化氰,工业级,山东淄博格林艾普化工有限公司。
EQUINOX 55 型FT-IR 红外光谱仪,德国Bruker公司;2695 型高效液相色谱仪,美国waters 公司;Vario EL Ⅲ型元素分析仪,Elementar 公司;SDTQ600TG-DSC 联 用 仪,美 国TA 公 司;WL-1 型 落锤撞击感度仪、WM-1 型摩擦感度仪、WM-1 型静电感度仪,湖北航天化学技术研究所。
2.2 实验
2.2.1 合成路线
丙二酸二乙酯、丁二酸二甲酯通过肼解,与溴化氰反应成环,得到了5,5′-亚甲基双(1,3,4-噁二唑-2-氨基)(2a)、1,2-双(5,5′-二氨基-1,3,4-噁二唑-2-)乙烷(2b)两个2-氨基-1,3,4-噁二唑类含能中间体。用发烟硝酸对2b 硝化得到1,2-双(5,5′-二硝胺基-1,3,4-噁二唑-2-)乙烷(3b),具体合成路线如Scheme 1所示。
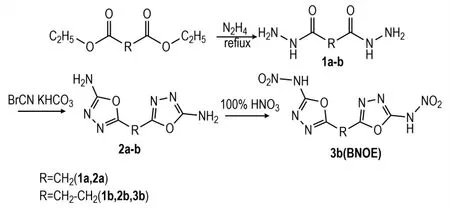
Scheme 1 Synthetic route of 1,2-bis(5,5′-nitramino-1,3,4-oxadiazol-2-)ethane
2.2.2 丙二酰肼(1a)的合成
在1000 mL 的四口烧瓶中依次加入500 mL 的乙醇、48 g(0.3 mol)的丙二酸二乙酯,待丙二酸二乙酯完全溶解于乙醇中后,缓慢滴加30 g(0.6 mol)水合肼,随后加热至90 ℃,回流反应4 h,冷却结晶,过滤,再经乙醇洗涤,干燥得到丙二酰肼27.4 g,产率70%[11]。
Anal. Calcd for C3H8O2N4:C 27.28,H 6.07,N 42.43,Found C 27.62,H 6.02,N 42.17;1H NMR(500 MHz,DMSO-d6,25 ℃)δ:9.1(br,4H,—NH2),4.2(br,2H,—NH),2.89(s,2H,—CH2);13C NMR(125 MHz,DMSO-d6,25 ℃)δ:166.0(CO),40(CH2);IR(KBr,ν/cm-1):3302,3270,3203,3133(—NH—NH2),2883(—CH2),1679,1649(—CO—)。
2.2.3 5,5′-亚甲基双(1,3,4-噁二唑-2-氨基)(2a)的合成
冰水浴中,向装有温度计的1000 mL 的四口烧瓶中加入500 mL 的水,待烧瓶中的水温度降至5 ℃时,向烧瓶中依次加入6.6 g(0.05 mol)丙二酰肼,11.1 g(0.11 mol)碳酸氢钾。完全溶解后,加入10.6 g(0.10 mol)溴化氰。保持恒温(5 ℃)搅拌反应1 h,撤掉冰浴,室温搅拌4 h,过滤,分别用水和二氯甲烷洗涤,真空干燥,得到产物黄色固体8.32 g,产率91.43%。
Anal. Calcd for C5H6O2N6:C 32.96,H 3.30,N 46.15;Found C 33.05,H 3.10,N 46.43. DSC(10 ℃·min-1):241.8 ℃(dec.);1H NMR(500 MHz,DMSO-d6,25 ℃)δ:7.063(s,4H,—NH2),4.26(s,2H,—CH2);13C NMR(125 MHz,DMSO-d6,25 ℃)δ:163.5(CNH),145.8(OCN),40(CH2);IR(KBr,ν/cm-1):3307,3113(—NH2)2881(—CH2),1661,1593(—NN—),1262(—COC—)。
2.2.4 丁二酰肼(1b)的合成
在一个1000 mL的四口烧瓶中依次加入500 mL的乙醇、43.8 g(0.3 mol)的丁二酸二甲酯,待丁二酸二甲酯完全溶解于乙醇中后,缓慢的滴加30 g(0.6 mol)水合肼,随后加热至90 ℃,回流反应4 h,冷却结晶,过滤,再经乙醇洗涤,干燥得到白色固体32.9 g,产率76%。
Anal. calcd for C4H10O2N4:C 32.88,H 6.85,N 38.36;found C 33.01,H 6.71,N 38.21;1H NMR(500 MHz,DMSO-d6,25 ℃)δ:8.9(br,4H,—NH2),4.2(br,2H,—NH),2.2(t,2H,—CH2);13C NMR(125 MHz,DMSO-d6,25 ℃)δ:170.0(CO),29(CH2);IR(KBr,ν/cm-1):3314,3292,3202,3183(—NH—NH2),2878(—CH2—CH2),1631,1534(—CO—)。
2.2.5 1,2-双(5,5′-二氨基-1,3,4-噁二唑-2-)乙烷(2b)的合成
冰水浴中,向装有温度计的1000 mL 的四口烧瓶中加入500 mL 的水,待烧瓶中的水温度降至5 ℃时,向烧瓶中依次加入7.3 g(0.05 mol)丁二酰肼,11.1 g(0.11 mol)碳酸氢钾。完全溶解后,加入10.6 g(0.10 mol)溴化氰。保持恒温(5 ℃)搅拌反应1h,撤掉冰浴,室温搅拌4 h,过滤,分别用水和二氯甲烷洗涤,真空干燥,得到产物白色固体8.85 g,产率90.31%。
Anal. Calcd for C6H8O2N6:C 36.73,H 4.08,N 42.86;Found C 36.62,H 3.94,N 42.32。DSC(10 ℃·min-1):284.2 ℃(dec.);1H NMR(500 MHz,DMSO-d6,25 ℃)δ:7.08(s,4H,—NH2),2.31(t,4H,—CH2);13C NMR(125 MHz,DMSO-d6,25 ℃)δ:163.7(CNH),146.2(OCN),30(CH2);IR(KBr,ν/cm-1):3312,3108(—NH2)2777(—CH2),1662,1592(—NN—),1139(—COC—)。
2.2.6 1,2-双(5,5′-二硝胺基-1,3,4-噁二唑-2-)乙烷(3b)的合成
冰水浴中,向装有温度计的100 mL 的圆底烧瓶中加入50 mL 的发烟硝酸,分批加入5 g(0.028 mol)2b,待2b 完全溶解后,撤掉冰浴,常温搅拌过夜。将反应后的硝化液倒入500 g 的冰水中冷却,有白色固体析出,过滤,用水洗涤,真空干燥,得到产物白色固体5.31 g,产率72.74%。
Anal. Calcd for C6H6O6N8:C 25.17,H 2.10,N 39.16;Found C 25.01,H 2.17,N 38.87;1H NMR(500 MHz,DMSO-d6,25 ℃)δ:13.75(br,2H,—NH),2.28(t,4H,—CH2);13C NMR(125 MHz,DMSO-d6,25 ℃)δ:163.6(CNH),145.9(OCN),29.8(CH2);IR(KBr,ν/cm-1):3168(—NH—),2789(—CH2),1583,1565(—NN—),1385(—NO2)1139(—COC—)。
2.2.7 性能测试
撞击感度:依据GJB5891.22-2006 方法,用落锤撞击感度仪测试,条件:药量(20±0.5)mg,落锤质量10 kg。
摩擦感度:依据GJB5891.24-2006 方法,用摩擦感度仪测试,条件:药量(20±0.5)mg,摆角90°。
静电感度:依据GJB5891.27-2006 方法,用静电感度仪测试,条件:药量(20±0.5)mg,电容3×3900 pF,针距0.5 mm。
密度:依据GB4472-1984 标准,采用密度瓶法进行测试,条件:药量(2.5±0.1)g,介质质量22 g,介质密度0.8526 g·cm-3,测试温度25 ℃。
3 结果与讨论
3.1 成环反应溶剂的选择
溴化氰与酰肼反应成环是合成1,3,4-噁二唑-2-氨基的常见方法。但是在文献报道中,通常采用甲醇或者乙醇作为反应溶剂[12],这是为了避免溴化氰与水接触而产生剧毒的氢氰酸,但是由于2a、2b 中间体在醇中的溶解度较好,使得以醇作为溶剂在产物分离时有较大的困难。对传统的方法进行改进,用水替换醇作为溶剂,为了避免溴化氰与水接触带来的危险性,同时也是为了促进反应的进行,在反应体系中加入过量的碱(碳酸氢钾)。
3.2 5-甲基-2-氨基-1,3,4-噁二唑(NAOz)的环化反应机理
合成2-氨基-1,3,4-噁二唑成环反应的反应机理很少见文献报道。为了简化计算过程,采用Gaussian 09 量子化学计算软件,分析了5-甲基-2-氨基-1,3,4-噁二唑(NAOz)的环化反应机理。其他相似结构(如2a 和2b)遵循同样的反应机理。对反应过程中的反应物、中间体、过渡态和产物的分子结构进行了结构优化和单点能计算,计算采用密度泛函理论(DFT)的B3LYP 方法在6-311+G(2df,2p)//6-311+G(2df,2p)基组水平上进行。通过振动频率分析检验所计算分子结构的属性(过渡态或稳定结构)。采用内禀反应坐标(IRC)方法,对过渡态结构进行了验证。
NAOz 的合成过程实际上可分为两个反应阶段:肼解反应和成环反应。
(1)肼解反应机理
肼解反应的过程如Scheme 2 所示。
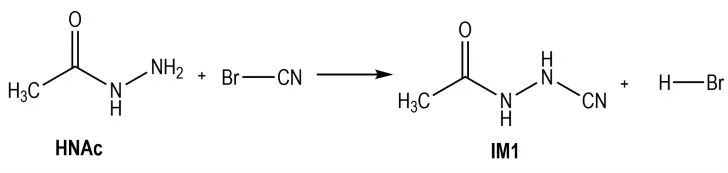
Scheme 2 Synthetic route of N-cyanogenhydrazine
计算了溴化氰分子的Mulliken 电荷分布(图1),Br 原子带部分正电荷(+0.300 e),相应的CN 带部分负电荷(-0.300 e)。乙酰肼的电荷分布及N-氰基乙酰肼的原子序号见图2。
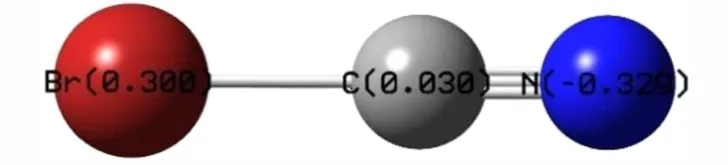
图1 溴化氰的电荷分布图Fig.1 The charge distribution of cyanogen bromide
溴化氰中带正电荷的溴原子,与酰肼反应,夺走乙酰肼的—NH2上的H-并带走一对电子,使乙酰肼的β氮原子(N(11))上带有正电荷,而带负电荷的CN-进攻带正电荷的N 原子,从而形成中间体IM1(N-氰基-乙酰肼)。计算表明(表1),反应前后的吉布斯自由 能 变 化 值 为-42.18 kJ·mol-1。IRC 分 析 显 示,这 步反应近似是一个无能垒的反应过程。产物之一为溴化氢,而碱中和溴化氢促进反应向正方向进行。
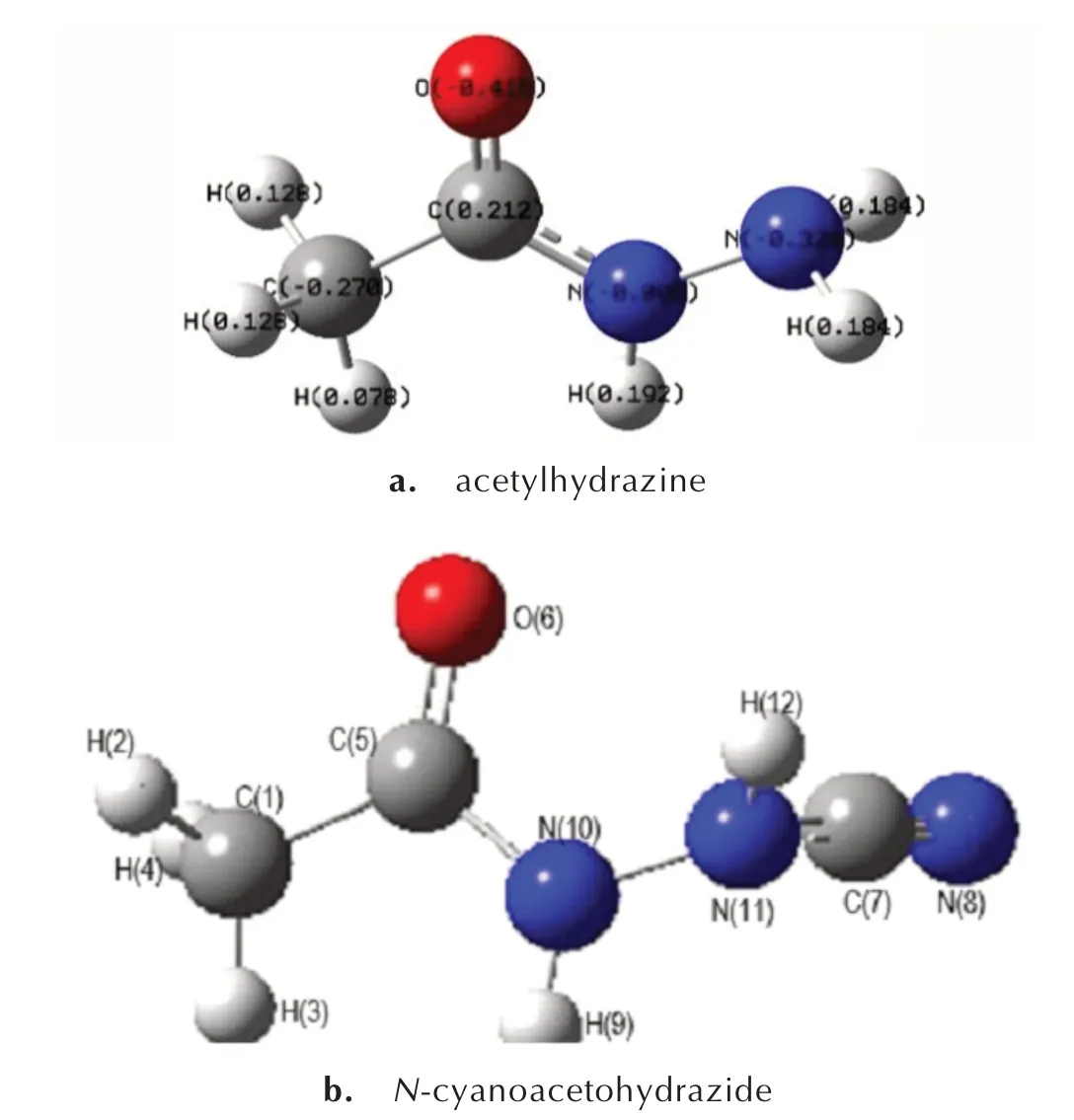
图2 乙酰肼的电荷分布及N-氰基乙酰肼的原子序号Fig.2 Charge distribution of acetylhydrazine and atoms number of N-cyanoacetohydrazide
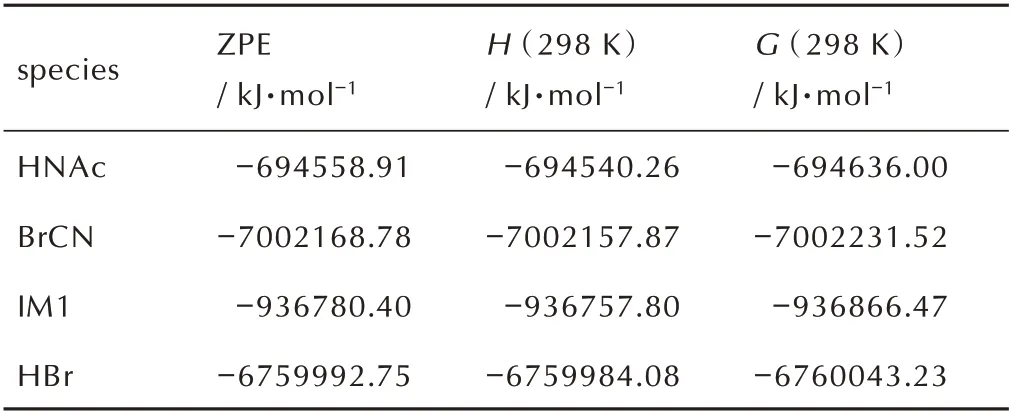
表1 合成N-氰基乙酰肼反应物和中间产物的零点能、生成焓和自由能Table 1 Zero-point engergies(ZPE),enthalpies(H)and free energies(G)of reactants and intermediates during the synthesis of N-cyanoacetohydrazide
(2)5-甲基-2-氨基-1,3,4-噁二唑成环反应机理
采用B3LYP 方法在6-311+G(2df,2p)水平上优化了反应物、各中间体、过渡态和产物的几何构型(图3),计算结果列于表2,ΔG为反应物、各中间体、过渡态和产物的相对吉布斯自由能。反应过程中各驻点物质的几何结构见图3,势能面示意图见图4。
在碱性环境下,IM1 的N 上的一个质子与碱反应,形成中间体。N(10)和N(11)上的质子均可以与OH-反应而失去。计算表明,失去N(10)上的质子后形成中间体IM3,有利于烯醇重排,N(11)上的H 原子可以转移到O 上;而如果N(11)上的质子和OH-反应而失去后形成中间体IM2,N(10)上的H 原子由于空间位阻,无法转移到O 上。因此,以失去N(10)上质子而形成的中间体IM3 占优势。中间体IM3 的N(11)上的质子经历过渡态TS1 可以转移给羰基的O(6)上,形成中间体IM4。这一反应的能垒为33.59 kJ·mol-1,吸热23.61 kJ·mol-1。在中间体IM4 中,N═C═N 绕N(10)—N(11)单键旋转,经过过渡态TS2,克服48.68 kJ·mol-1的 能 垒,转 化 为 中 间 体IM5,吸 热44.65 kJ·mol-1。IM5 的O(6)上的H(12)越过能垒59.28 kJ·mol-1,转移到N(8)上,形成中间体IM6,放热21.67 kJ·mol-1。C(7)带有部分的正电荷,而O(6)上带有部分负电荷,越过一个较低的能垒(20.64 kJ·mol-1)形成环状中间体IM7。IM7 获得一个质子形成最终的产物。整个反应是一个放热反应(49.06 kJ·mol-1),碱性环境有利于反应的进行。
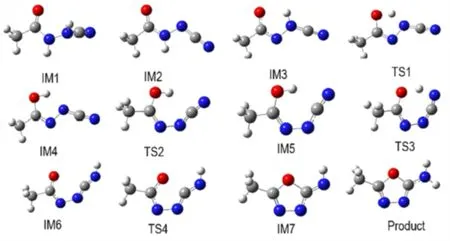
图3 合成5-甲基-2-氨基-1,3,4-噁二唑的中间体、过渡态和产物的几何构型Fig.3 The geometrical structures of the intermediate,transition state and product in the synthesis of 5-methyl-2-amino-1,3,4-oxadiazole
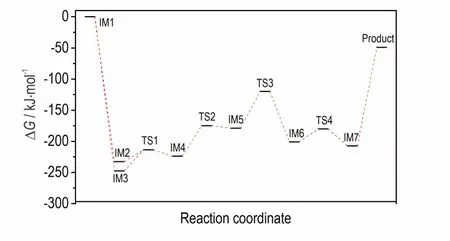
图4 6-311+G(2df,2p)水平上中间体、过渡态和产物的势能面示意图Fig.4 Potential energy profiles of intermediate,transition state and product at the 6-311+G(2df,2p)level
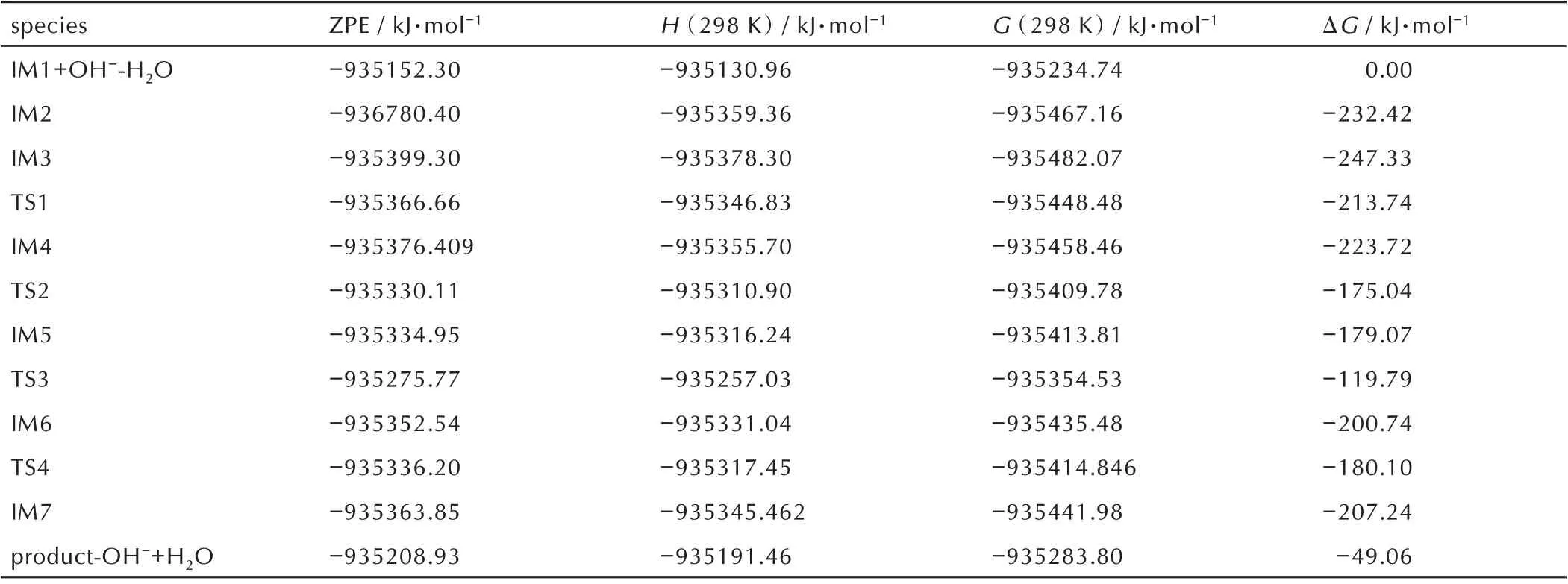
表2 合成5-甲基-2-氨基-1,3,4-噁二唑反应物和中间产物的零点能、生成焓和自由能Table 2 Zero-point engergies(ZPE),enthalpies(H)and free energies(G)of reactants and intermediates during the synthesis of 5-methyl-2-amine-1,3,4-oxadiazol
3.3 1,2-双(5,5′-二硝胺基-1,3,4-噁二唑-2-)乙烷的热性能
1,2-双(5,5′-二硝胺基-1,3,4-噁二唑-2-)乙烷的TG-DSC 曲线如图5 所示。通过分析可知,BNOE 的热分解过程中没有出现明显的吸热峰,只有一个放热分解峰,这表明在热分解过程中BNOE 不存在吸热融化的相变过程,由固相开始分解。BNOE 的起始分解温度为202.2 ℃,在208.6 ℃时达到DSC 峰值,整个过程质量损失66%。表明该化合物的分解温度较高,耐热性能较好。
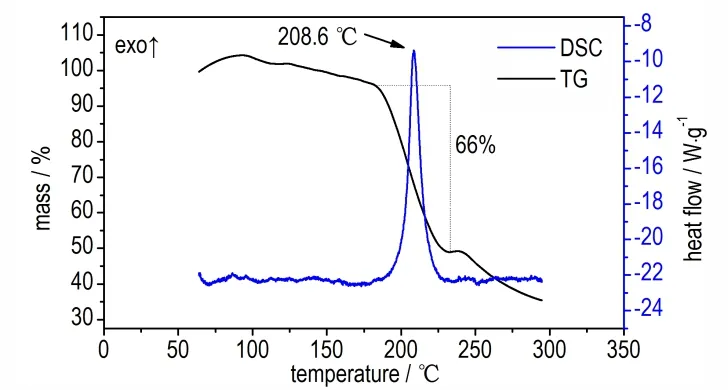
图5 BNOE 的TG-DSC 曲线Fig.5 TG-DSC curves of the BNOE
3.4 1,2-双(5,5′-二硝胺基-1,3,4-噁二唑-2-)乙烷的感度
1,2-双(5,5′-二硝胺基-1,3,4-噁二唑-2-)乙烷的撞击感度、摩擦感度和静电感度测试结果见表3,为了与常用炸药比较,将六硝基六氮杂异伍兹烷(CL-20)[13]、二硝酰胺铵(ADN)[14]、黑索今(RDX)[15]的文献结果列于表3。
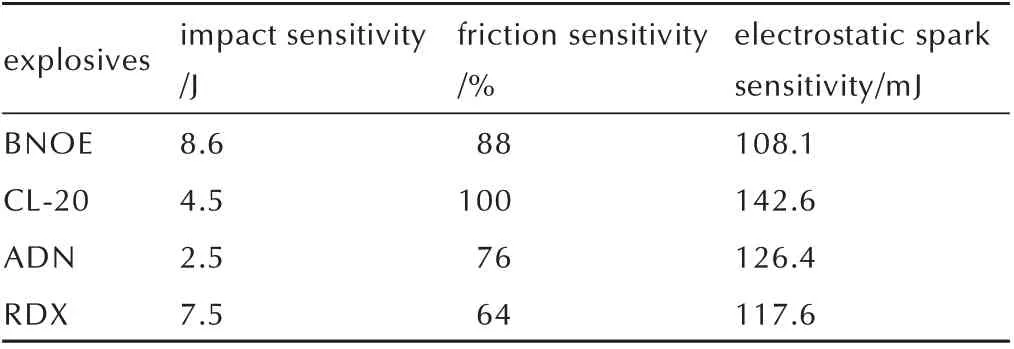
表3 感度测试结果Table 3 The results of sensitivity test
由表3 可知,1,2-双(5,5′-二硝胺基-1,3,4-噁二唑-2-)乙烷的撞击感度低于CL-20、ADN、RDX,摩擦感度低于Cl-20 但是高于ADN、RDX,静电感度高于Cl-20、ADN、RDX,综合分析认为,1,2-双(5,5′-二硝胺基-1,3,4-噁二唑-2-)乙烷的感度水平与RDX 相当。这 主 要 得 益 于1,2-双(5,5′-二 硝 胺 基-1,3,4-噁 二唑-2-)乙烷中的1,3,4-噁二唑环结构的芳香性,有效降低了分子间的偶极矩,使得感度水平较低。
3.5 1,2-双(5,5′-二 硝 胺 基-1,3,4-噁 二 唑-2-)乙 烷(BNOE)的爆轰性能


4 结论
(1)丙二酸二乙酯、丁二酸二甲酯通过肼解,与溴化氰反应成环,得到了5,5′-亚甲基双(1,3,4-噁二唑-2-氨基)、1,2-双(5,5′-二氨基-1,3,4-噁二唑-2-)乙烷两个2-氨基-1,3,4-噁二唑类含能中间体,并通过量子化学研究了成环反应的机理,整个反应是一个吸热反应(59.44 kJ·mol-1),而且碱性环境有利于反应的正向进行。
(2)研 究 了1,2-双(5,5′-二 氨 基-1,3,4-噁 二唑-2-)乙烷的硝化反应,硝化得到1,2-双(5,5′-二硝胺基-1,3,4-噁二唑-2-)乙烷。1,2-双(5,5′-二硝胺基-1,3,4-噁 二 唑-2-)乙 烷 的 密 度 为1.714 g·cm-3。TG-DSC 分析显示1,2-双(5,5′-二硝胺基-1,3,4-噁二唑-2-)乙烷起始分解温度较高为202.2℃,具有良好的热稳定性。
(3)用Gaussian09 软件预测1,2-双(5,5′-二硝胺基-1,3,4-噁二唑-2-)乙烷固相生成焓为48.25 kJ·mol-1。1,2-双(5,5′-二硝胺基-1,3,4-噁二唑-2-)乙烷的理论爆压为22.6 GPa,理论爆速为7663 m·s-1。感度测试表明1,2-双(5,5′-二硝胺基-1,3,4-噁二唑-2-)乙烷的撞击感度为8.6 J,摩擦感度88%,静电感度为108.1 mJ,感度水平与RDX 相当。
致谢:感谢南京理工大学化工学院王鹏程博士在爆轰性能预测时给予的指导和帮助。
